脑小血管病患者颅内大动脉狭窄的临床预测评分系统构建
马佳丽 李永秋 王玉青 王恺闻 李佳宁 王月华 东晶晶 王嘉瑶陈 红 李 媛 韩明宇
1)河北医科大学研究生院,河北 石家庄 050017 2)唐山市工人医院,河北 唐山 063000 3)华北理工大学研究生院,河北 唐山 063200
脑血管病严重威胁人们的生活生存质量[1],早期做好疾病防治工作至关重要。而脑血管病不仅包括脑大血管病,如常见的脑梗死、脑出血等,还包括症状隐匿的脑小血管病(cerebral small vessel disease,CSVD)。尽管目前认为,二者的发生发展机制存在一定差异[2-4],但二者存在解剖结构上的联系,因此脑血管病危险因素可能对CSVD患者亦存在潜在影响,且目前研究已证实增龄、高血压特别是血压变异性为CSVD的独立影响因素[5-7]。与脑大血管病相比,CSVD具有更高的患病率[8],而脑大血管病的直接原因为颅内大动脉病变[9],这提示在CSVD患者中,颅内大动脉病变的情况存在差异。脑梗死作为神经科最常见的疾病,其对患者远期生活质量存在严重威胁[10],因此,本研究以CSVD患者为研究对象,探索其存在颅内大动脉狭窄的危险因素,并构建预测评分系统,将不同指标进行量化,为脑梗死的防治提供精准指导。
1 对象与方法
1.1 研究对象收集2020-01—2021-06 于唐山市工人医院神经内科就诊的CSVD患者,所有对象自愿接受头MRI+MRA+SWI检查及糖化血红蛋白、血浆同型半胱氨酸水平化验,并自愿提供一般信息及既往病史。入组标准:(1)CSVD诊断明确[11];(2)身体一般情况良好,无全身各脏器功能衰竭等;(3)无精神障碍,可取得良好配合。排除标准:(1)影像学检查、实验室资料不完善者;(2)合并严重脑血管病或其他系统严重疾病者;(3)意识障碍,无法配合完成相关检查化验者;(4)不愿提供一般信息及既往病史者。
1.2 数据收集收集研究对象的基线资料,包括基本信息(年龄,性别)、目前公认的可导致大动脉狭窄的危险因素(高血压[12]病史,糖化血红蛋白、血浆同型半胱氨酸化验,吸烟史:平均≥1支/d,且持续时间≥1 a,饮酒史:平均≥30 g/d,且持续时间≥6 个月,既往脑卒中病史)、CSVD特征(CSVD总负荷:依据4分制标准[13],影像学特征:选取腔隙(图1A)、脑微出血(图1B)、脑白质高信号(图1C)、血管周围间隙扩大(图1D)四种最常见影像学改变。根据患者头颈MRA 检查评估是否存在颅内大动脉狭窄并分组,将MRA存在程度≥50%的大动脉狭窄者定义为存在颅内大动脉狭窄(图2)。
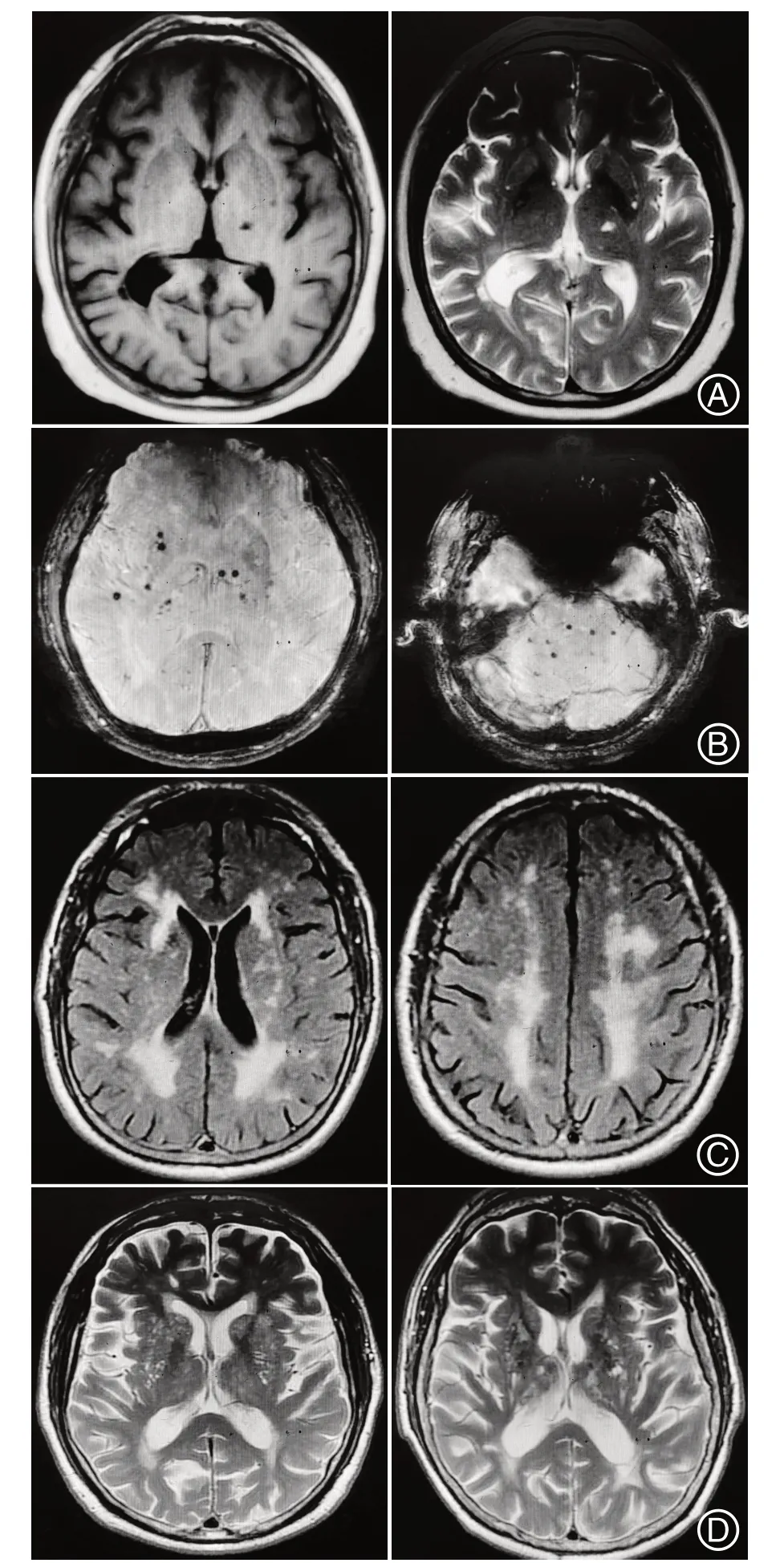
图1 CSVD影像学特征Figure 1 Imaging features of CSVD
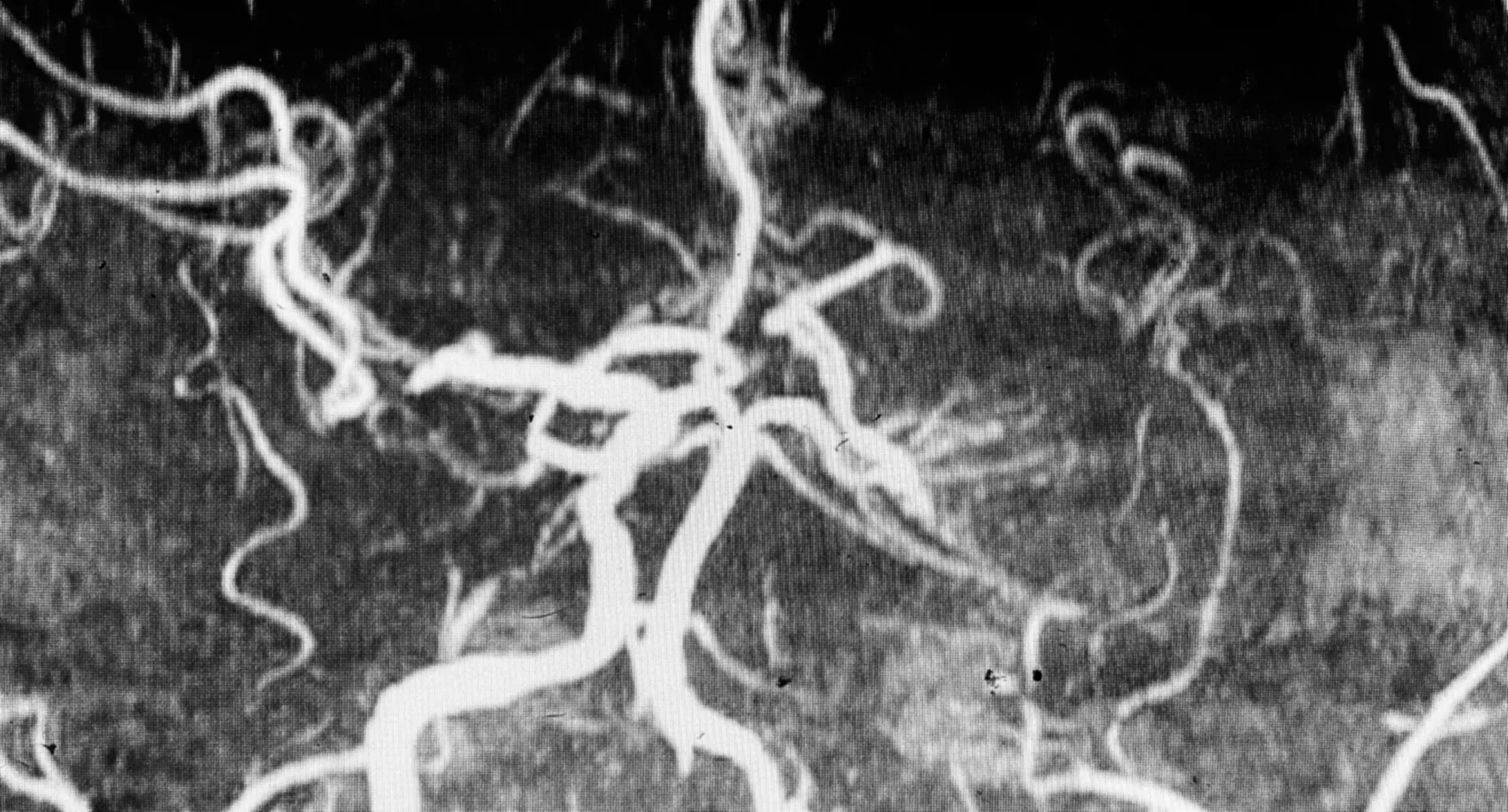
图2 头MRA检查提示左侧颈内动脉颅内段未显影Figure 2 MRA demonstrated stenosis of the left internal carotid artery
1.3 统计学方法采用SPSS 25.0 软件进行统计学分析。计量资料分别采用均数±标准差(±s)、t检验进行描述和分析,计数资料采用构成比、χ2检验进行描述和分析。通过单因素及多因素二元Logistic 回归分析探索CSVD 患者存在颅内大动脉狭窄的独立危险因素,提取各因素回归系数并进行转换、赋分,建立CSVD患存在颅内大血管狭窄的预测评分系统,选取最大约登指数相应位置确定截断值。绘制ROC曲线并计算AUC,通过Hosmer-Lemeshow检验模型拟合优度。P<0.05为差异有统计学意义。
2 结果
2.1 基线数据共纳入799 例CSVD 患者,其中395例(49.4%)存在颅内大动脉狭窄,404例(50.6%)无颅内大血管狭窄。2 组患者在年龄、高血压、糖化血红蛋白、血浆同型半胱氨酸水平、既往卒中史、CSVD总负荷、脑微出血、脑白质高信号、血管周围间隙扩大方面均存在差异(P<0.05)。见表1。
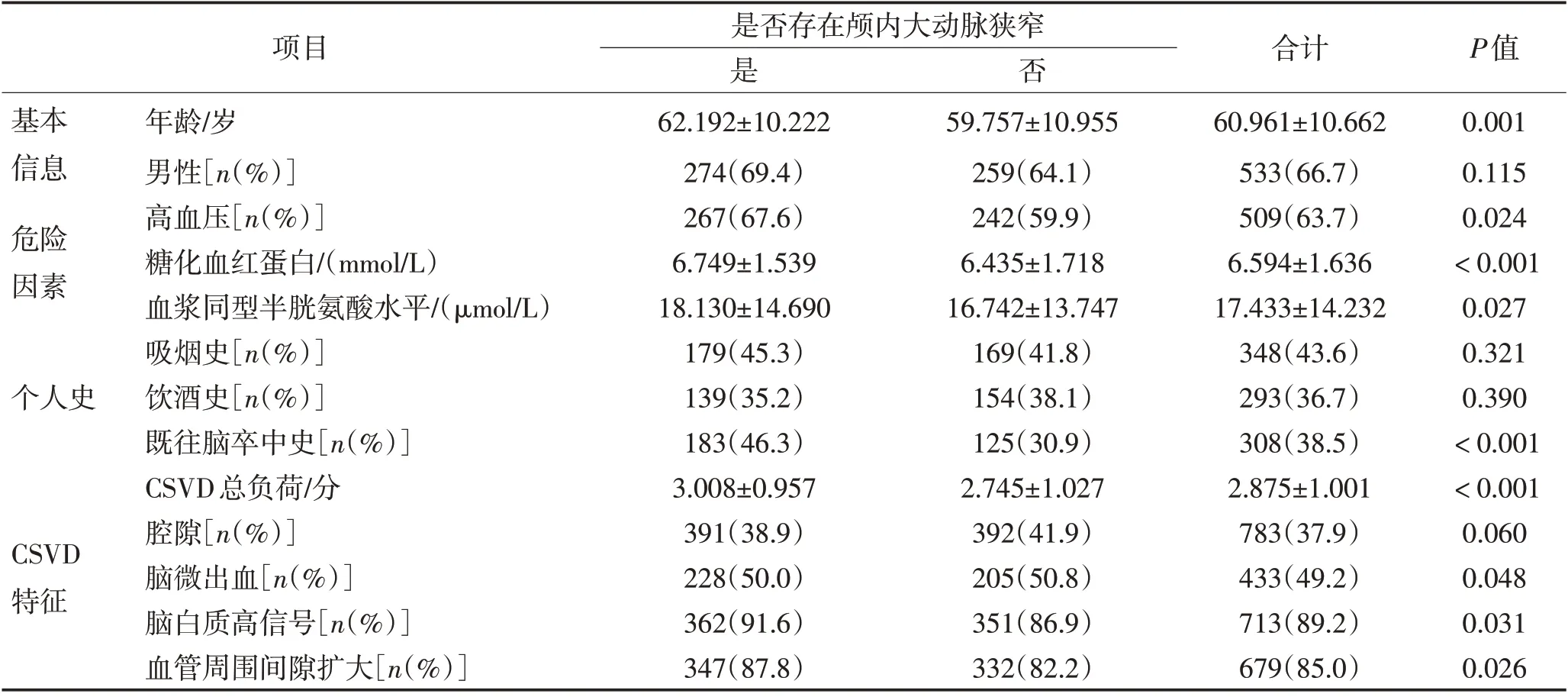
表1 基线数据比较Table 1 Baseline data
2.2 CSVD患者存在颅内大动脉狭窄的独立影响因素探索对有差异的因素进行多因素二元Logistic回归分析,结果显示,年龄、糖化血红蛋白、血浆同型半胱氨酸水平、既往脑卒中史、CSVD 总负荷差异具有统计学意义(P<0.05),性别、高血压、吸烟史、饮酒史、CSVD类型无统计学意义(P>0.05)。见表2。
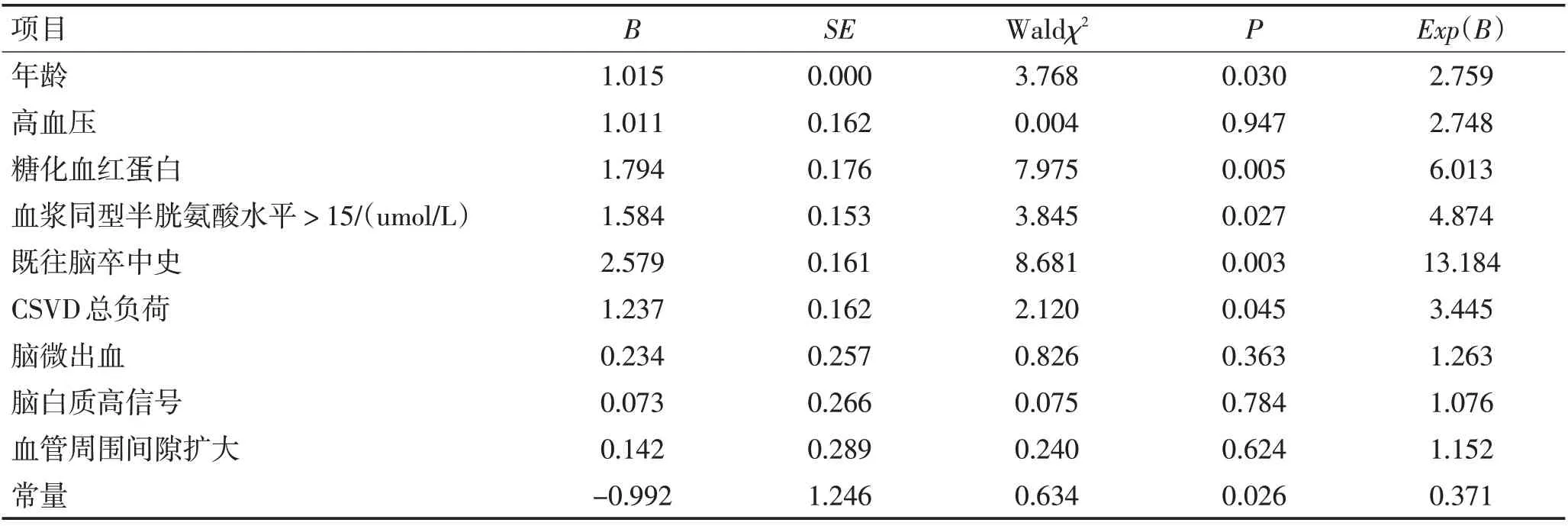
表2 多因素二元Logistic回归Table 2 Multivariate binary Logistic regression
2.3 预测评分系统构建及预测效能评价将年龄、CSVD总负荷、糖化血红蛋白、血浆同型半胱氨酸水平>15 umol/L、既往脑卒中史纳入预测评分系统的构建。将年龄以10岁为段划分,所纳入对象年龄为18~90岁;糖化血红蛋白水平以1 mmol/L为段划分,所纳入研究对象糖化血红蛋白数值最低为4.3 mmo/L,最高为20 mmol/L;CSVD总负荷按照1分为段划分。根据各因素回归系数进行相应赋分,形成总分为20分的评分系统(表3)。根据最大约登指数确定截断值为8分,故认为评分≥8 分为存在颅内大动脉狭窄,评分0~7分为不存在颅内大动脉狭窄。绘制ROC曲线(图6),AUC值为0.809(95%CI:0.762~0.855,P<0.001)。采用Hosmer-Lemeshow检验拟合优度,χ2=100.485,P=0.497,认为模型拟合优度较高。应用评分系统对799例CSVD患者是否存在颅内大血管狭窄进行评估(表4),灵敏度、特异度分别为82.5%、83.9%。
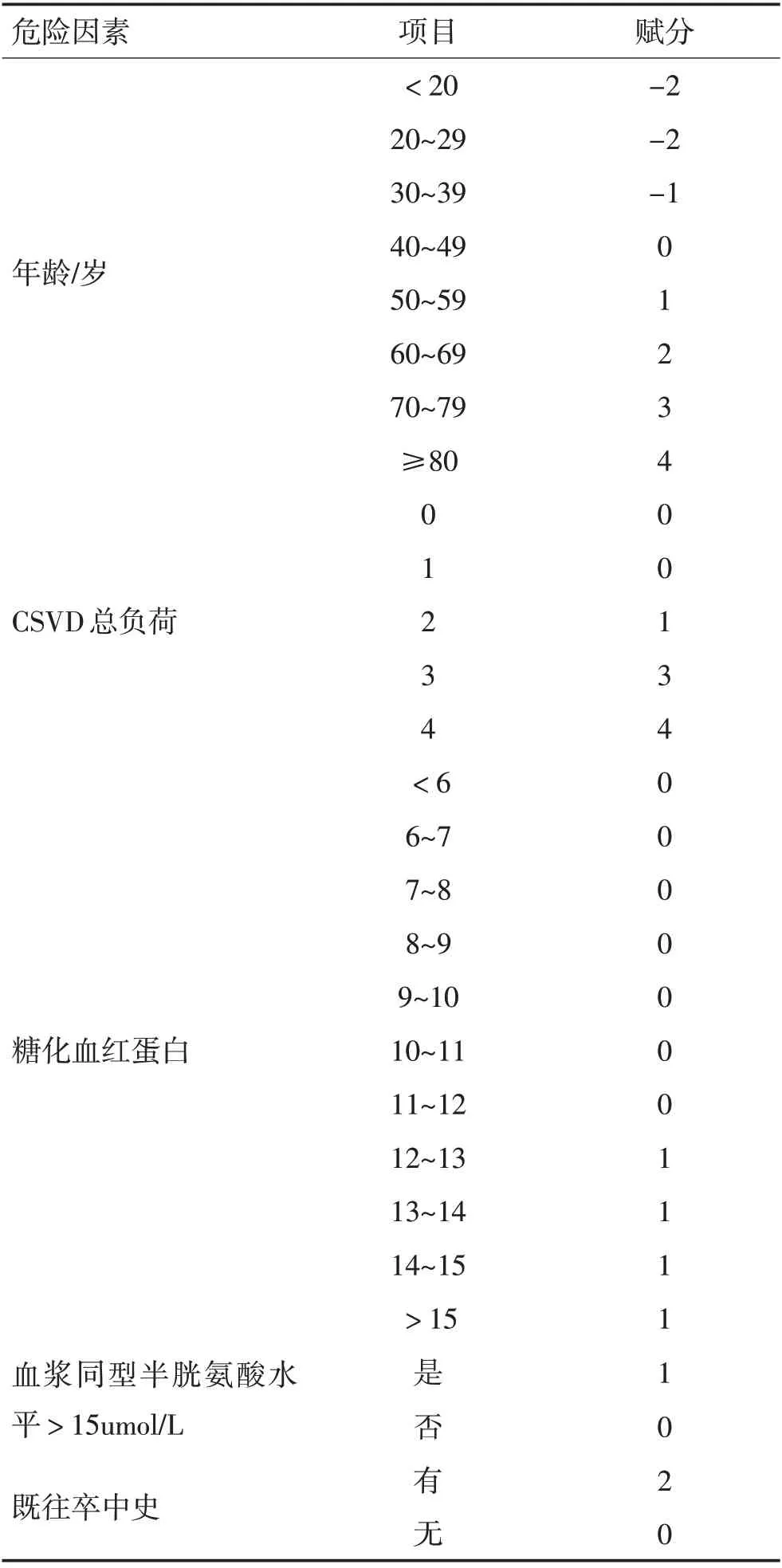
表3 CSVD患者存在颅内大动脉狭窄的预测评分表Table 3 Predictive scoring system for large intracranial artery stenosis in patients with CSVD
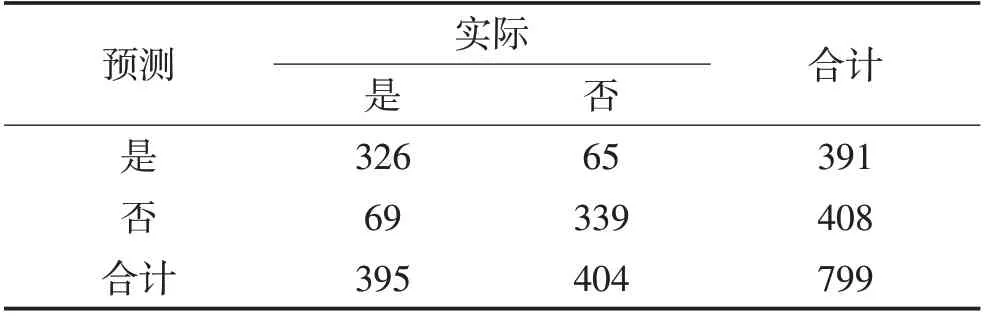
表4 预测评分系统的预测结果与实际情况比较Table 4 Prediction results and actual situation of predictive scoring system
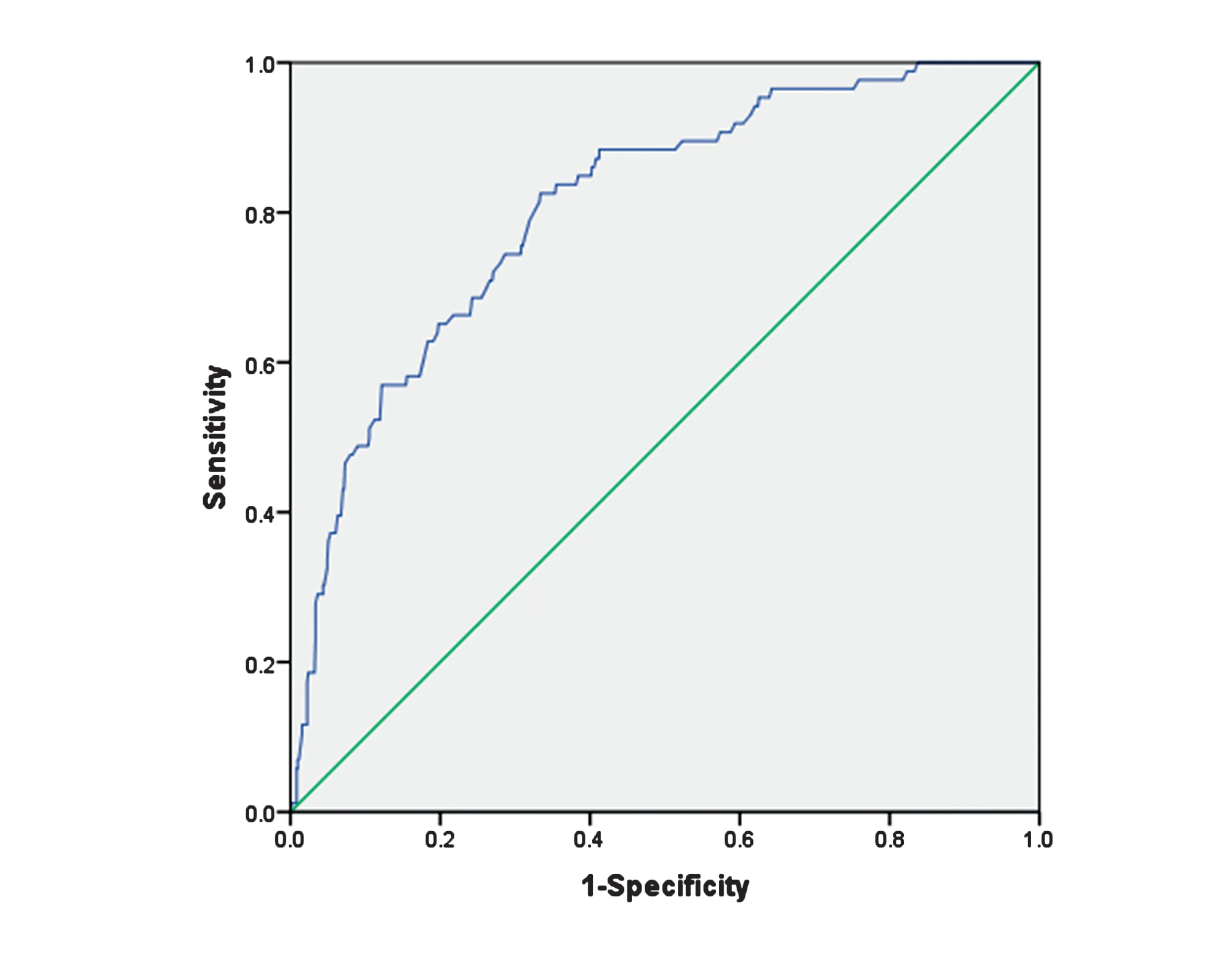
图3 预测评分系统预测CSVD患者是否存在存在颅内大动脉狭窄的ROC曲线Figure 3 ROC curve of predictive scoring system for predicting the presence of large intracranial artery stenosis in patients with CSVD
3 讨论
尽管单纯的CSVD 症状往往隐匿[14],但研究表明,存在CSVD 的患者发生急性脑卒中时预后更差[15-17]。且随着CSVD 总负荷的增高,全脑结构功能的不可逆损伤加重,导致患者的各方面临床症状逐渐明显[18-19],在此基础上,一旦发生新发脑卒中,将对患者的生存质量造成严重威胁,甚至危及生命[20-21]。因此,越来越多的研究投入到CSVD的发生发展及其与脑大血管病的联系中。
本研究发现,糖化血红蛋白、血浆同型半胱氨酸水平是CSVD 患者存在颅内大动脉狭窄的可干预独立影响因素。这可能与二者均可导致血管内皮细胞损伤有关[22],激活的炎性因子、免疫活性物质等在细胞内堆积,直接和间接导致血脑屏障功能破坏[23-25],促进CSVD 的发生发展。而颅内大动脉因血管内皮细胞损伤启动了血栓形成[26],同时血流动力学的改变、代偿性的血管收缩等进一步促进栓子形成[27]。因此,糖化血红蛋白、血浆同型半胱氨酸水平的变化可同时影响脑大血管病和CSVD 的发生发展。在此基础上,推测脑大血管病和CSVD可能存在类似的发病机制,但因解剖学特点的差异,二者在影像学改变、临床症状等方面均存在不同。
此外,脑大血管病与CSVD的起病形式差异提示二者间可能存在某些潜在联系。CSVD 为慢性进展性疾病[28],而本研究中发现的两项可干预指标均为反应机体代谢功能的指标,提示代谢异常在CSVD的发生发展中可能起到一定作用。一方面,代谢异常导致血液黏度增高、神经细胞代谢废物直接在脑内堆积[29-30];代谢紊乱的神经递质等可直接或间接干扰正常的脑功能,这符合“脑-肠轴”理论[31]的观点;另一方面,代谢通路异常可导致脂质沉积,加重动脉粥样硬化斑块形成[32]。当血管狭窄累积到一定程度时,则可能导致急性缺血性脑卒中,同时,在长期CSVD对神经血管单元损害的基础上,脑白质纤维联系破坏范围更广、程度更重[33-34],患者多预后不良。
脑大血管病与CSVD 可能存在相互促进作用。在CSVD患者中,颅内小动脉、小静脉管壁玻璃样变、纤维素样坏死[35]等,导致血管壁直径改变,小动脉壁弹性减低、脆性增加[36-37],直接引起远端血流动力学变化,进而间接导致主干血流动力学异常;而免疫活性物质在细胞内的堆积加重血管内皮细胞功能紊乱[38],多种途径促进大动脉粥样硬化形成。大动脉粥样硬化形成导致管腔狭窄,加重远端血流灌注不足[39],促进并加重CSVD;如斑块为不稳定斑块,一旦脱落则直接导致远端血管供血区域的新发小缺血灶形成[40];血流动力学紊乱导致血管内外压力差异常,进而影响小静脉、组织液回流等[41]。此外,有研究表明,脑大血管病与CSVD 不仅在发病机制上相互促进,二者在临床症状严重程度等方面亦存在相互作用[42]。因此,发现并加强对危险因素特别是二者潜在的共同危险因素的干预,是有待深入探讨的重要课题之一。
在CSVD 患者中,年龄、CSVD 总负荷、糖化血红蛋白、血浆同型半胱氨酸水平及既往脑卒中病史是患者存在颅内大动脉狭窄的独立影响因素,以此建立的预测评分系统具有较好的预测效能。但本研究为单中心、回顾性横断面研究,可能存在一定纳入偏倚及回忆偏倚。未来有必要继续开展多中心、大样本的队列研究,以验证并更新本研究结论,为脑血管病患者的临床管理提供更有针对性的建议。

