COPD肺组织中MAL、IL-10、TNF-α的表达
郑鑫蓥 夏之 肖琳琳 彭果然 彭光耀 刘鑫
多数气道疾病会出现持续反复性炎症和气道上皮发生结构性破坏的现象,而COPD 最主要的病理特征是气道炎症和气道重构。T—lymphocyte maturation associated protein(MAL)是一种膜蛋白,在顶端运输机理中具有关键作用,对维持上皮细胞内环境的稳定性具有重要意义。IL-10(白细胞介素-10)常作为抗炎因子,肿瘤坏死因子-α(TNF-α)则被视为促炎因子,二者是COPD中公认的经典因子。本研究通过检测人肺组织中MAL及COPD大鼠肺组织中MAL、IL-10、TNF-α的表达变化,初步探讨三者的相关性,以冀为防治COPD的研究提供依据。
资料与方法
一、材料
1 人肺组织标本
收集2012年1月至2015年7月在南华大学第一附属医院行肺叶切除术患者的病历。纳入标准:(1)符合 COPD 的诊断标准(2)通过伦理审查委员会审核(3)病历资料完整;排除标准: ①除肺癌外合并其他严重器官、系统病变。分别选取5例符合标准的COPD及肺功能正常的病例,收集用以与肿瘤组织作对照的癌旁肺组织,所选择的肺组织远离肺癌病变5cm以上,病理证实无肿瘤侵袭,肺组织已经完成包埋。
2 大鼠标本和试剂
选取16只健康雄性SD大鼠(250±10g),雄狮香烟(浙江烟草工业有限公司),MAL抗体、LPS脂多糖(Sigma, USA)、DAS染色试剂盒、TNF-α ELISA试剂盒(博奥森公司)、IL-10 ELISA试剂盒、MAL ELISA试剂盒。
二、方法
1 人肺组织
人肺组织已经完成包埋,取肺组织,经过HE染色处理,观察病理变化。利用免疫组化法检测MAL 蛋白表达,使用图像采集系统,测量5个支气管上皮细胞的整体光密度(IODs),取其平均值,即为MAL 蛋白表达(主体为支气管上皮细胞)的相对水平。
2 大鼠肺组织
用随机数表法将购于南华大学动物部的健康SD大鼠体重(250±10)g分为正常组和COPD模型组,每组8只。在实验的首日和第14日,分别向COPD组大鼠经气管滴注LPS 溶液(1g/L)200ul,并每天熏吸雄狮牌香烟(焦油15mg,烟碱1.0mg),每只大鼠每天2次,每次1支,每次半小时,共28天。正常对照组在1天和14天时向气道内滴加等量生理盐水。COPD模型成功建立后水含氯醛腹腔麻醉,腹主动脉放血处死大鼠。对肺组织进行固定(选用福尔马林-中性,浓度为10%),石蜡包埋、切片,采用HE染色观察肺组织损伤和炎性浸润;免疫组化方法检测MAL蛋白的表达;ELISA检测肺组织匀浆上清液中MAL、TNF-α和IL-10的表达。
三、统计分析

结 果
一、HE染色观察肺组织损伤和炎性浸润
正常肺组织结构无异常,肺泡和细支气管未出现结构性变化,只发现少量的炎症细胞;COPD组中则出现损伤的上皮黏膜,被破坏的肺泡和窄化后的细支气管,炎症细胞浸润范围更大(图1)。
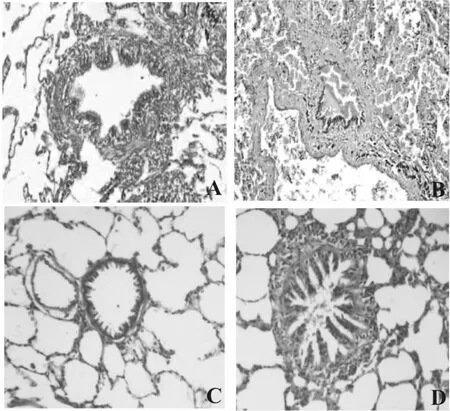
图1 COPD肺组织病理学变化(HE 染色,200×)
二、免疫组化检测MAL蛋白的表达
棕黄色颗粒代表MAL蛋白,主要分布于气道上皮细胞,正常组MAL蛋白的表达明显高于COPD组,差异有统计学意义(见表1,图2、3)。
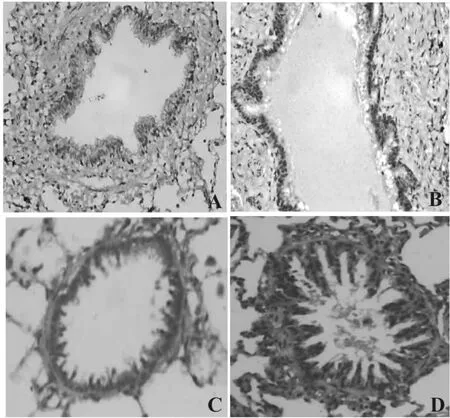
图2 COPD肺组织中MAL的表达(免疫组化,200×)

表1 气道上皮 MAL 蛋白的光密度OD值

图3 气道上皮MAL蛋白平均光密度(AOD)
三、ELISA检测大鼠肺组织匀浆上清液中 MAL、IL-10、TNF-α
表达与正常组相比,COPD组IL-10和MAL水平显著升高(P<0.05),COPD组肺组织中TNF-α水平显著高于正常组(P<0.05)(表2,图4)。
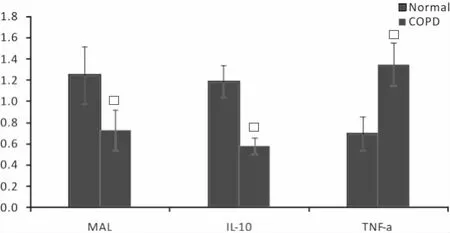
图4 两组大鼠肺组织中MAL、IL-10、TNF-α的表达
表2 两组大鼠肺组织中MAL、IL-10、TNF-α的表达
四、大鼠BALF的细胞计数
与正常组相比,COPD组相关炎性细胞计数明显增多,差异有统计学意义(表3,图5)。
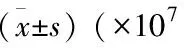
表3 大鼠BALF白细胞计数及分类个/L)
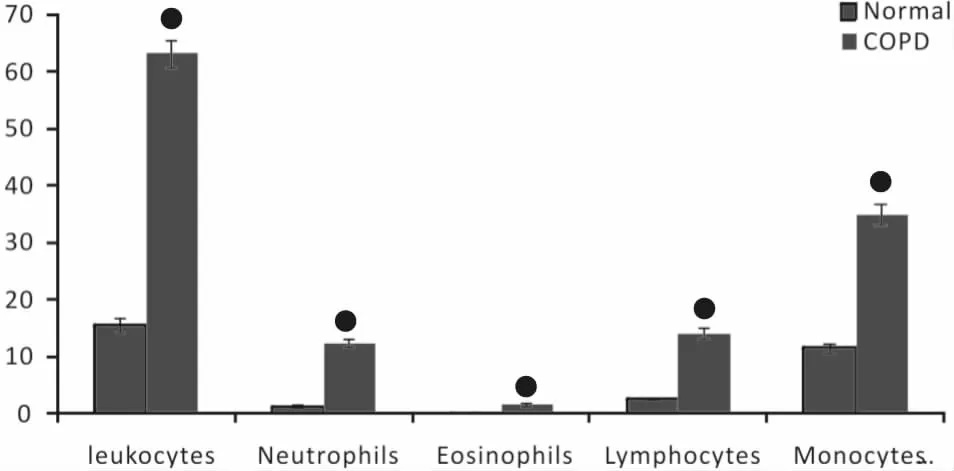
图5 大鼠BALF白细胞计数及分类个/L)
五、采用相关性分析方法探讨MAL、IL-10与TNF-α 之间的关系
IL-10与MAL表达水平呈正相关(r=0.749,P<0.001),且关系显著;TNF-α分别与IL-10、MAL呈负相关(r=-0.840,P<0.001;r=-0.665,P<0.001),且关系显著(表4,图6,图7,图8)。
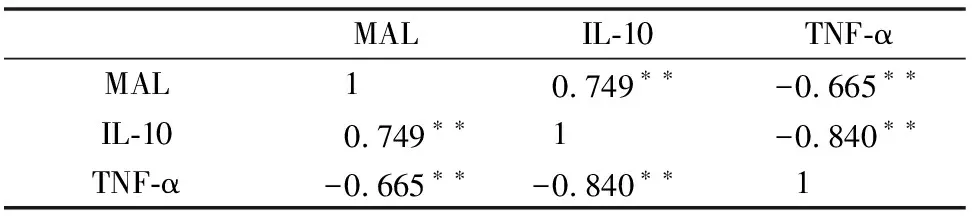
表4 MAL、IL-10与TNF-α三者间的两两相关性
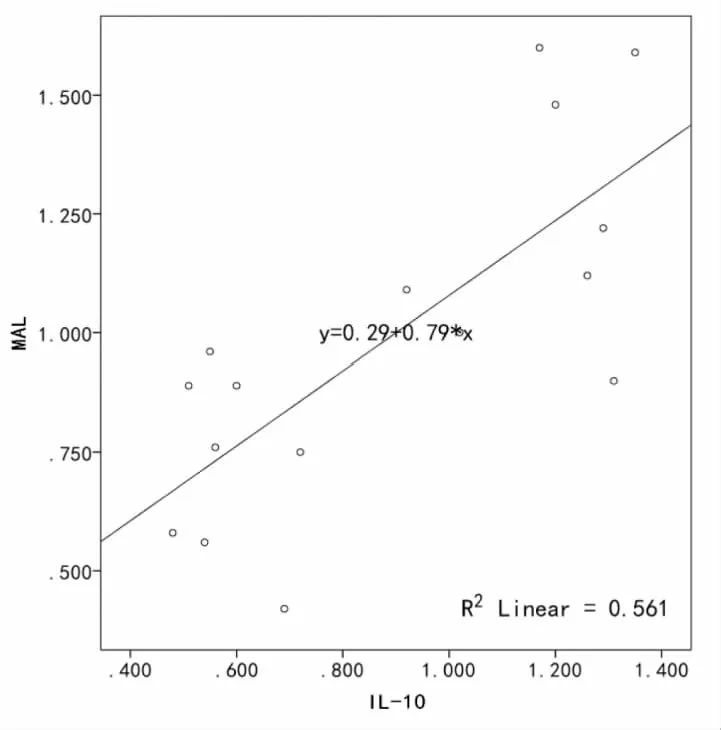
图6 MAL与IL-10呈正相关
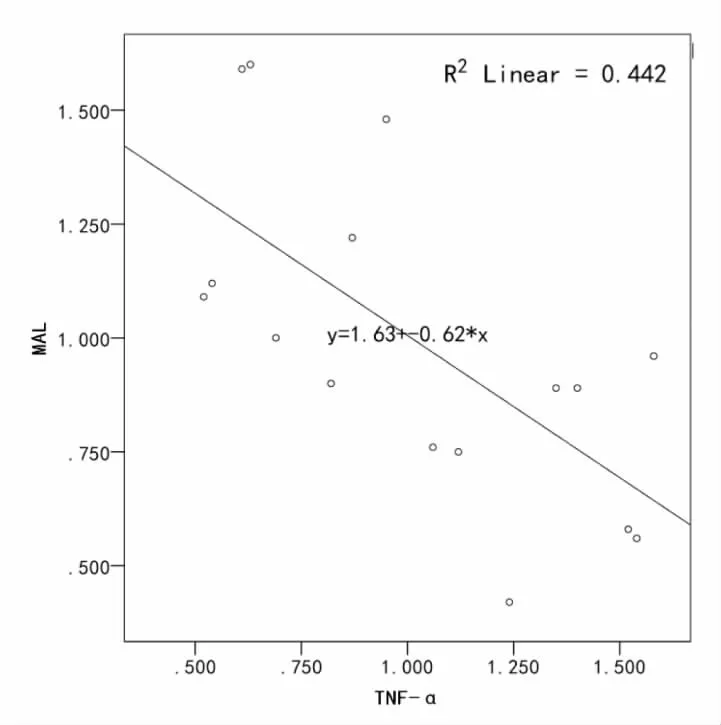
图7 MAL与TNF-α 呈负相关
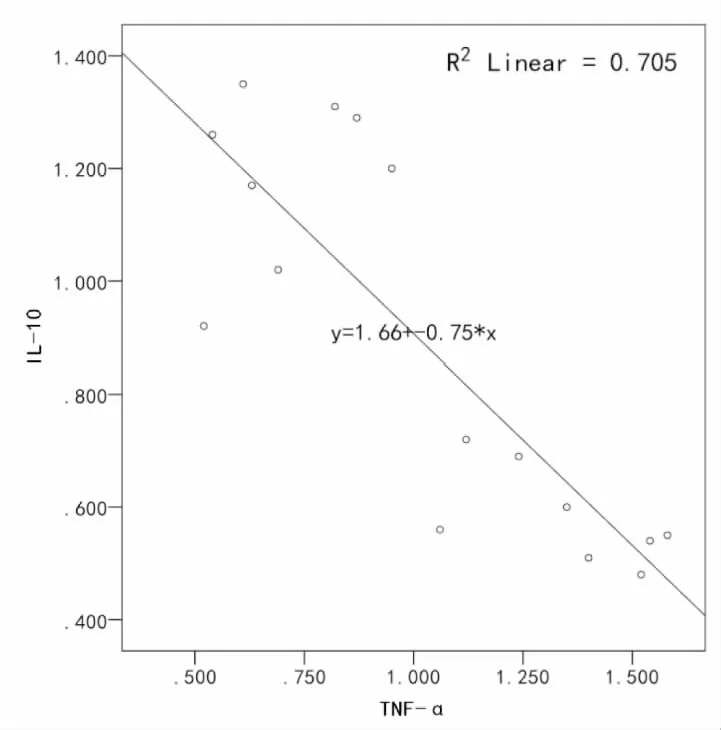
图8 IL-10与TNF-α 呈负相关
讨 论
COPD的发病机制尚未完全明了,其特征是肺弹性组织破坏和(或)炎症黏性分泌物,且炎症免疫细胞的相互作用会导致组织的破坏及弹性蛋白、胶原蛋白的改变,最终出现气道重塑[1]。
本实验结果显示,与正常组对比,COPD大鼠中TNF-α表达明显升高(P<0.05),IL-10表达明显降低(P<0.05),与文献一致[2]。TNF-α 已被确定为NF-κB的一种强大激活剂,可放大炎症过程[3],能诱导其他介质发生瀑布式聚集反应。肺组织内炎症介质的长期聚集会形成慢性黏液高分泌状态,同时小气道炎症加剧,会使纤维组织形成从而导致气道重塑,最终发展为慢阻肺。EurlingsI.M.等发现在COPD大鼠肺泡壁和气道肺泡表面活性蛋白 C 生成细胞中表现出 TNF-α 的过表达[4],提示TNF-α不仅参与了气道炎症状态的形成,其表达会随气道炎症状态加重而增加。部分学者认为IL-10调控功能的潜在机制是与特定的细胞表面受体(IL-10R)结合,抑制NF-κb的核易位及其dna结合活性,阻断TNF-α等促炎因子[5]。我们推测,IL-10降低及其调控分泌的促炎因子,如TNF-α的增加可能是气道上皮结构失去完整性的结果之一。
MAL分布于细胞表面,是一种典型状态的顶端膜蛋白,可以对于上皮细胞的生理性分泌与吸收功能产生关键性调节。在哮喘小鼠肺组织及哮喘血清刺激气道上皮细胞中的MAL表达均下调[6-7]。可以推测MAL对于炎症的抑制与延缓效应,对于气道重塑和高反应性的影响,都是借助上皮细胞的结构形态与功能的维持作用来实现的。COPD的特征之一是持续的气道慢性炎症状态,在COPD肺组织内,是否也存在MAL表达水平的下降呢?本实验发现正常人及大鼠肺组织中 MAL 表达显著,此外,在人体内,肺泡与气道组织的上皮细胞是MAL存在的主要部位,以人和大鼠为研究对象,罹患COPD 的个体均会出现MAL表达水平显著降低的现象,对比正常组差异显著(P<0.05),说明 MAL 参与了 COPD 的发病过程。相关性分析显示MAL水平与IL-10呈显著正相关(P<0.001);IL-10、MAL显著负相关于TNF-α(P<0.001),根据实验结果推断,MAL表达水平降低后,会对纤维化因子和促炎因子的分泌(主要为气道内的上皮细胞)产生促进作用,对抗炎因子产生抑制作用,进而加速气道炎症的发生,促进气道重塑进程,最终导致COPD病程发展。本研究仅初步探讨了人肺组织中MAL及COPD大鼠模型中MAL、IL-10、TNF-α 的表达和相关性,具体调节机制仍不明确,需深入的研究,以期为 COPD 的防治提供新的思路。

