麦冬、大黄饮片电子束辐照灭菌工艺研究
王 钢 王 丹,* 何 毅 付 孟 唐艺文 青 川 高 鹏 黄 敏
(1 西南科技大学生命科学与工程学院,四川 绵阳 621010;2 四川省原子能研究院,四川 成都 610101;3 辐照保藏四川省重点实验室,四川 成都 610101)
麦冬(Ophiopogonjaponicus)、大黄(RheumpalmatumL.)是两种重要的传统中药材,广泛应用于临床制剂和保健品领域[1-2]。麦冬水分、糖分含量较高,表皮容易破损黏连;大黄根茎较大,干燥困难。两种药材在采收、干燥、炮制加工及贮藏等环节中均易感染微生物,造成变质、腐败等问题[3]。目前,麦冬、大黄的加工贮藏方式主要是硫磺熏蒸。但硫磺熏蒸易造成二氧化硫残留超标[4],降低药材品质,甚至对人体健康造成危害[5]。因此,亟待研究一种新的药材加工贮藏方式。
辐照技术作为一种绿色、高效的杀菌技术,能最大限度地保持中药材的性状、活性成分含量及药理活性[6]。60Co-γ射线辐照能显著降低大黄、麦冬、川芎等中药材中的细菌和霉菌含量,对药材的主要活性成分含量和指纹图谱相似度均无显著影响[4,7]。近年来,随着高能电子加速器(10 MeV)的研发和推广,电子束辐照技术逐渐被发展完善[8]。与γ射线辐照相比,电子束辐照技术具有投入成本低、安全性更强、加工效率高、射线利用率高、不产生核废物等优点,目前已得到广泛的推广应用。2015年发布的《中药辐照灭菌技术指导原则》,已将高能电子束作为降低药品微生物含量的灭菌方式之一[9]。
高能电子束辐照技术在我国起步较晚,缺乏辐照生物学效应、辐照加工工艺、质量标准等基础性研究。目前,电子束辐照在肉品贮藏和果蔬保鲜领域中的应用被广泛报道[10-12],但在中药贮藏养护中的应用研究较少[13],尤其是用于麦冬和大黄的贮藏养护更是鲜有报道。为此,本研究以麦冬、大黄饮片为试验材料,探究不同剂量高能电子束辐照对两种药材饮片微生物数量、理化指标、指纹图谱及有效成分含量的影响;探究不同堆码厚度、不同辐照方式对两种饮片辐照吸收剂量分布及吸收剂量不均匀度的影响,旨在探明适宜麦冬、大黄饮片的辐照灭菌工艺,为麦冬、大黄加工贮藏以及电子束辐照在中药材中的应用提供理论依据与技术支撑。
1 材料与方法
1.1 材料与试剂
麦冬、大黄饮片购自四川省中兴药业有限公司,经西南科技大学侯大斌教授鉴定为麦冬(Ophiopogonjaponicus)的干燥块根、掌叶大黄(RheumpalmatumL.)的干燥根茎。
甲基麦冬黄烷酮A、甲基麦冬黄烷酮B、芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚对照品(纯度均≥ 98%),成都埃法生物科技有限公司;甲醇、乙腈均为色谱纯,赛默飞世尔科技(中国)有限公司;磷酸为分析纯,成都市科隆化学品有限公司;胰酪大豆胨琼脂培养基、沙氏葡萄糖琼脂培养基,北京奥博星生物技术有限责任公司;重铬酸银剂量计,四川省原子能研究院自制,校准标准参照《JJG 1028-1991使用重铬酸银剂量计测量γ射线水吸收剂量标准方法》[14]。
1.2 仪器与设备
5804R高速离心机,德国Eppendorf公司;RHCX-350超声清洗器,济宁荣汇超声波设备有限公司;HH-W600数显三用恒温水箱,金坛市医疗仪器厂;GH6000型隔水培养箱,天津市泰斯特仪器有限公司;IS1020高能电子加速器,同方威视科技(北京)有限公司;GE60DA高压蒸汽灭菌锅,美国致微公司;UltiMate3000DGLC双三元、二维液相色谱仪系统,美国赛默飞世尔公司;SI-234电子天平,丹佛仪器(北京)有限公司。
1.3 试验方法
1.3.1 辐照处理 在重庆恒德辐照有限公司进行电子束辐照,电子加速器功率为20 kW,电子束能量为10 MeV,剂量率设定为260 Gy·s-1。麦冬、大黄饮片辐照剂量设定为2、4、6、8 kGy,以未辐照样品为对照,重铬酸银剂量计测得样品的实际吸收剂量分别为1.959、4.167、6.114、7.824 kGy。所有样品均设置3个重复。
1.3.2 微生物检验 麦冬饮片需氧菌总数、霉菌和酵母菌总数按《中华人民共和国药典》2020版[15]检测。大黄饮片需氧菌总数采用培养基稀释法测定,霉菌和酵母菌计数按平板涂布法检测[16]。需氧菌总数、霉菌和酵母菌总数含量检测结果以log(CFU·g-1)表示。
1.3.3 理化指标测定 将麦冬、大黄饮片粉碎过24目筛,混匀。按《中华人民共和国药典》2020版[10]测定麦冬、大黄的水分、总灰分及水溶性浸出物含量。
1.3.4 高效液相色谱(high performance liquid chromatography, HPLC)指纹图谱测定
1.3.4.1 色谱条件 Hyersil GOLD(250 mm×4.6 mm,5 μm);柱温30℃;进样量10 μL;流速1.0 mL· min-1; 麦冬检测波长296 nm[17],麦冬以乙腈-水 (65∶35,v/v) 为流动相;大黄检测波长254 nm,大黄以甲醇-0.1%磷酸溶液(85∶15,v/v)为流动相[10]。
1.3.4.2 对照品溶液制备 精密称取9.08 mg甲基麦冬黄烷酮A和10.2 mg甲基麦冬黄烷酮B对照品,分别加甲醇超声溶解并定容至25 mL,制成质量浓度分别为0.339 2、0.400 8 mg·mL-1的对照品供试液,用于麦冬指纹图谱测定;精密称取芦荟大黄素、大黄酸、大黄素、大黄酚和大黄素甲醚对照品适量,加甲醇分别制成每1 mL中含芦荟大黄素、大黄酸、大黄素、大黄酚各16 μg,含大黄素甲醚8 μg的对照品供试液,用于大黄饮片指纹图谱测定[10]。
1.3.4.3 供试品溶液制备 取麦冬粉末(过65目筛)3 g,加入30 mL甲醇超声提取30 min,于 10 414 r·min-1离心15 min[18],取上清液,过0.22 μm微孔滤膜,滤液即为麦冬供试品溶液;取大黄粉末(过65目筛) 约0.1 g,置于具塞锥形瓶中,精密加入50 mL 75%甲醇,称定质量,超声处理30 min,放冷,用75%甲醇补足减失质量,摇匀,过0.22 μm微孔滤膜,滤液即为大黄供试品溶液。
1.3.5 有效成分含量测定
1.3.5.1 线性关系的考察 精密称取1.3.4.2中的对照品溶液分别稀释制成浓度为0.1、0.2、0.4、0.6、0.8、1.0 mg·mL-1的溶液,计算回归方程。以色谱峰峰面积(Y)为纵坐标,各组分质量浓度(X, μg·mL-1)为横坐标,绘制标准曲线,计算回归方程和相关系数。
1.3.5.2 定量分析 按《中华人民共和国药典》2020版中通则0521高效液相色谱法中的外标法[15]计算麦冬、大黄饮片有效成分含量。
1.3.6 辐照加工工艺 麦冬饮片采用聚酯真空袋包装,产品密度0.38 g·cm-1;大黄饮片压碎装袋,产品密度0.21 g·cm-1,每袋厚度2 cm。每袋上下分别放置一对重铬酸银剂量计,跟踪实际吸收剂量。麦冬、大黄饮片分别采用单双面辐照工艺,剂量设置为4 kGy,具体工艺见图1。通过测定麦冬、大黄饮片在辐照加工过程中不同厚度的最大吸收剂量(Dmax)和最小吸收剂量(Dmin),计算对应的剂量不均匀度(U)=Dmax/Dmin,以U<1.2 为加工标准,确定麦冬、大黄饮片最适宜辐照加工工艺。
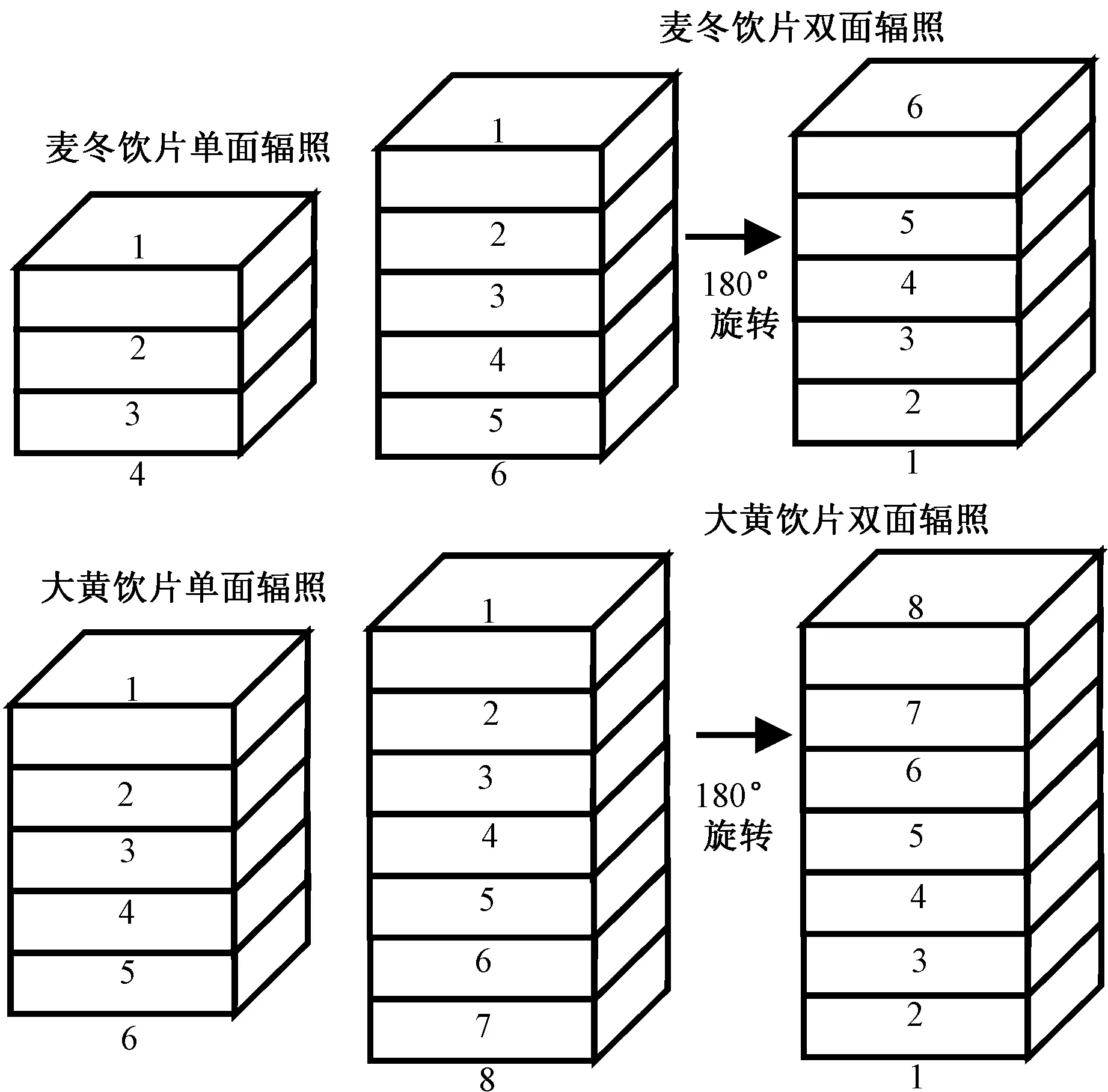
图1 麦冬、大黄饮片辐照工艺Fig.1 Irradiation process of decoction pieces of Ophiopogon japonicus and Rheum palmatum L.
2 结果与分析
2.1 不同剂量辐照处理对麦冬、大黄饮片中微生物存活数的影响
试验设定了5个辐照剂量组,辐照灭菌效果见图2。麦冬饮片的需氧菌总数、霉菌和酵母菌总数原始含菌量分别为5.57、3.53 log(CFU·g-1);大黄饮片的需氧菌总数、霉菌和酵母菌总数原始含菌量分别为6.08、5.38 log(CFU·g-1)。 麦冬饮片经2 kGy剂量辐照后,微生物数量下降至检测限以下[<1.0 log(CFU·g-1)];大黄饮片经2 kGy剂量辐照后,需氧菌总数减少了63%,霉菌和酵母菌总数减少了65%,经4 kGy剂量辐照后,微生物含量均下降至检测限以下。根据《中国药典》2020版[15],直接口服及泡服饮片需氧菌总数、霉菌和酵母菌总数限度分别为5、3 log(CFU·g-1)的规定,麦冬饮片辐照灭菌剂量为2 kGy时、大黄饮片辐照灭菌剂量为4 kGy时,微生物数量能达到限度标准。
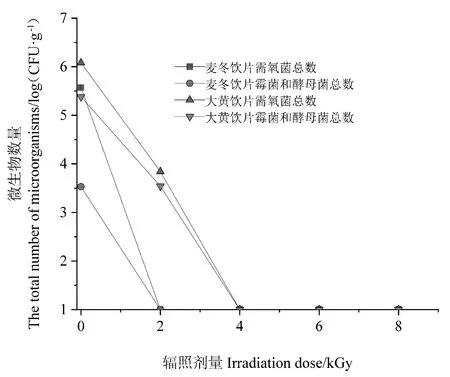
图2 麦冬、大黄饮片辐照灭菌效果Fig.2 Irradiation sterilization effect of decoction pieces of Ophiopogon japonicus and Rheum palmatum L.
2.2 不同剂量辐照处理对麦冬、大黄饮片理化指标的影响
麦冬、大黄饮片经0、2、4、6 和8 kGy 5种不同辐照剂量处理后,其理化指标结果见表1和2。由表1可知,辐照处理对麦冬饮片的理化性质水分、总灰分、水溶性浸出物含量均无显著影响(P>0.05)。由表2可知,辐照处理对大黄饮片的干燥失重和总灰分含量均无显著影响(P>0.05),0~6 kGy时,水溶性浸出物含量随辐照剂量的增加而显著增加,且增幅大体上与辐照剂量呈正相关。
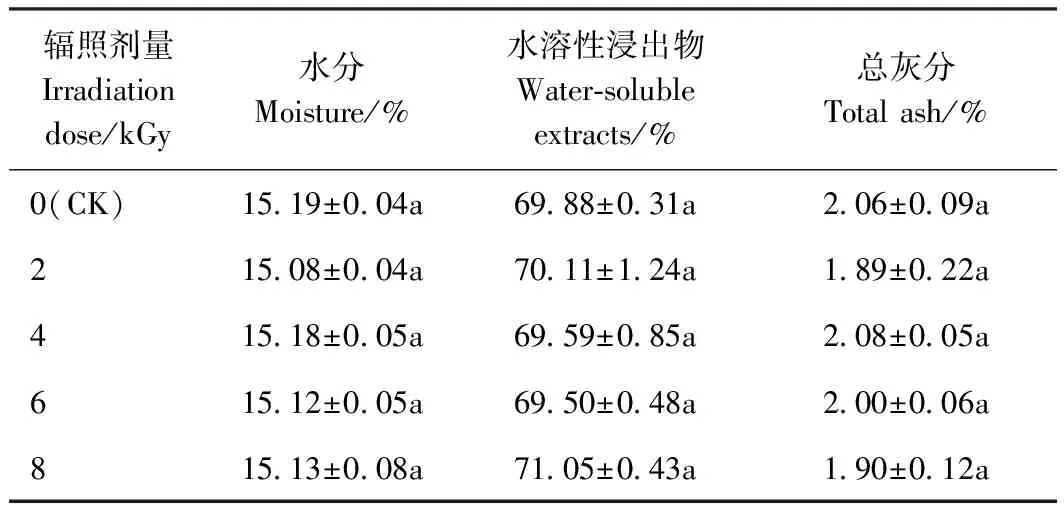
表1 不同剂量辐照处理对麦冬饮片水分、水溶性浸出物、总灰分的影响Table 1 Effects of different doses of irradiation on water, water-soluble extract and total ash of decoction pieces of Ophiopogon japonicus
2.3 不同剂量辐照处理对麦冬、大黄饮片指纹图谱变化的影响
甲基麦冬黄烷酮A、甲基麦冬黄烷酮B对照品指纹图谱如图3所示。芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚对照品指纹图谱如图4所示。在麦冬饮片指纹图谱上共选择标定了11个共有特征峰,通过与对照品比对,可确认8号峰为甲基麦冬黄烷酮A,9号峰为甲基麦冬黄烷酮B;在大黄饮片指纹图谱上共标定了7个共有特征峰,通过与对照品比对,可确认1、3、5、6和7号峰分别为芦荟大黄素、大黄酸、大黄素、大黄酚和大黄素甲醚。采用中药色谱指纹图谱相似度评价系统2.0软件分别对不同剂量电子束辐照麦冬、大黄饮片指纹图谱进行多点位校正、自动匹配,用中位数法生成对照图谱R,即共有模式图(图5、图6),并计算相似度(表3、表4)。分别以甲基麦冬黄烷酮A、大黄素为参比峰,计算麦冬饮片、大黄饮片特征峰的相对保留时间(表5、表6)。依据表中结果可知,5个辐照剂量下麦冬、大黄饮片特征峰相似度均达到0.99,相对保留时间的相对标准偏差(relative standard deviation, RSD)均小于0.5%,说明在2~8 kGy的辐照剂量不会对麦冬、大黄饮片的化学成分一致性产生影响。
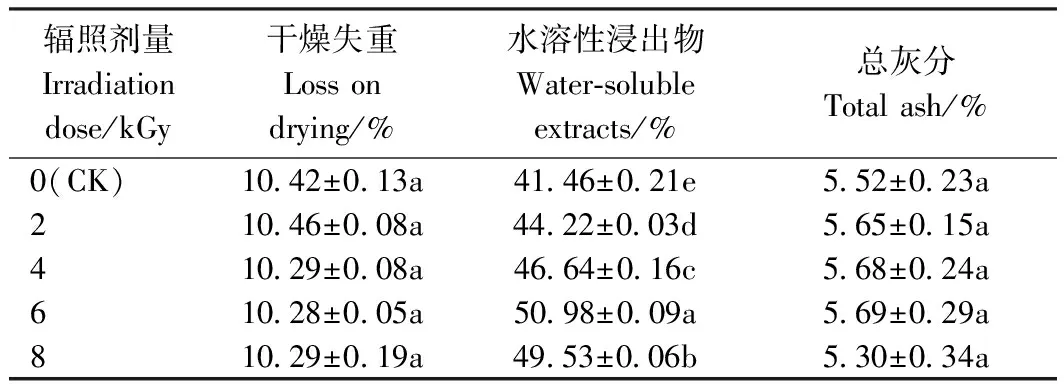
表2 不同剂量辐照处理对大黄饮片干燥失重、水溶性浸出物、总灰分的影响Table 2 Effects of different doses of irradiation on drying loss, water-soluble extract and total ash of decoction pieces of Rheum palmatum L.
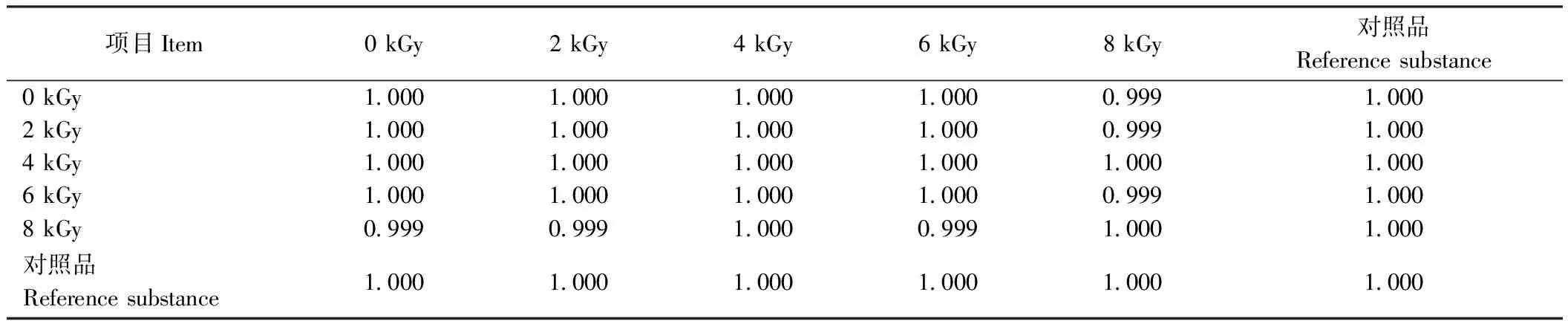
表3 不同剂量辐照处理对麦冬饮片相似度评价结果的影响Table 3 Effects of different doses of irradiation on similarity evaluation results of decoction pieces of Ophiopogon japonicus
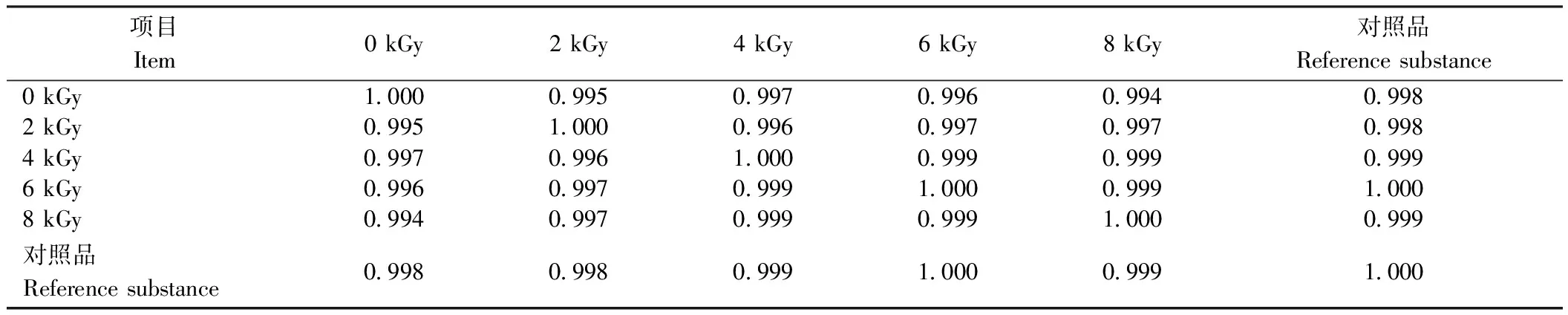
表4 不同剂量辐照处理对大黄饮片相似度评价结果的影响Table 4 Effects of different doses of irradiation on similarity evaluation results of decoction pieces of Rheum palmatum L.
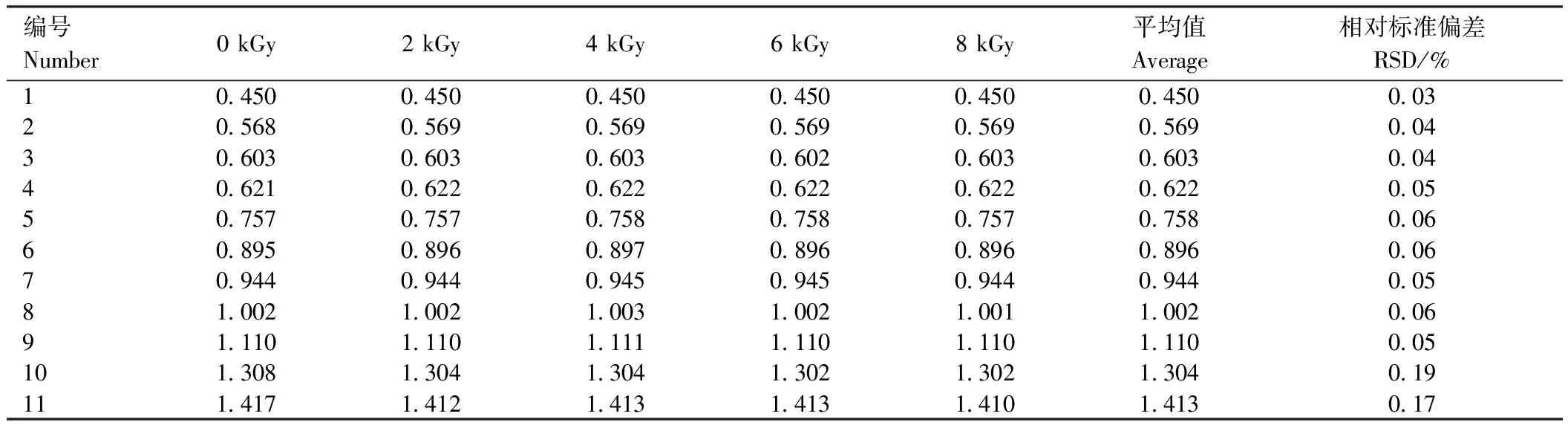
表5 不同剂量辐照处理对麦冬饮片指纹图谱相对保留时间的影响Table 5 Effects of different doses of irradiation on relative retention time of fingerprint of decoction pieces of Ophiopogon japonicus
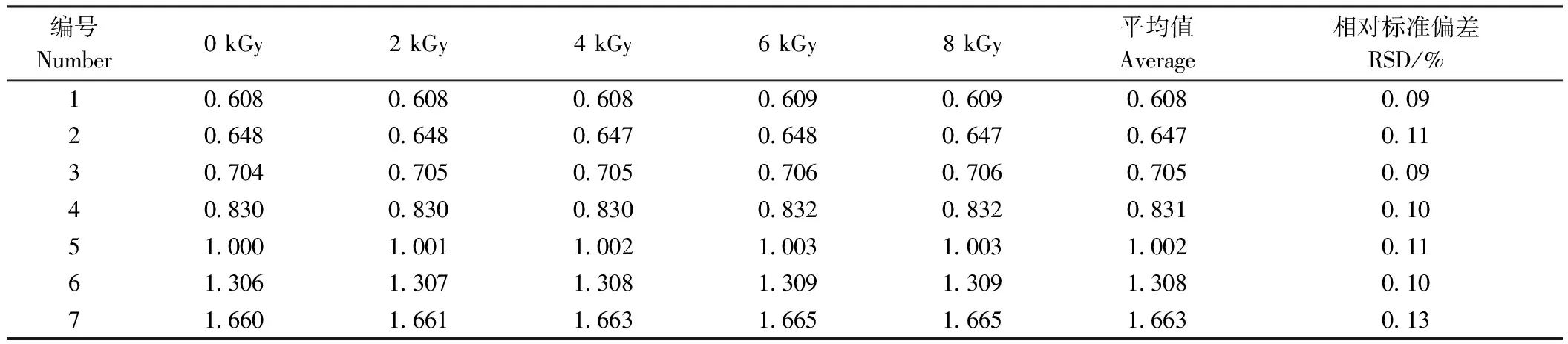
表6 不同剂量辐照处理对大黄饮片指纹图谱相对保留时间的影响Table 6 Effects of different doses of irradiation on relative retention time of fingerprint of decoction pieces of Rheum palmatum L.
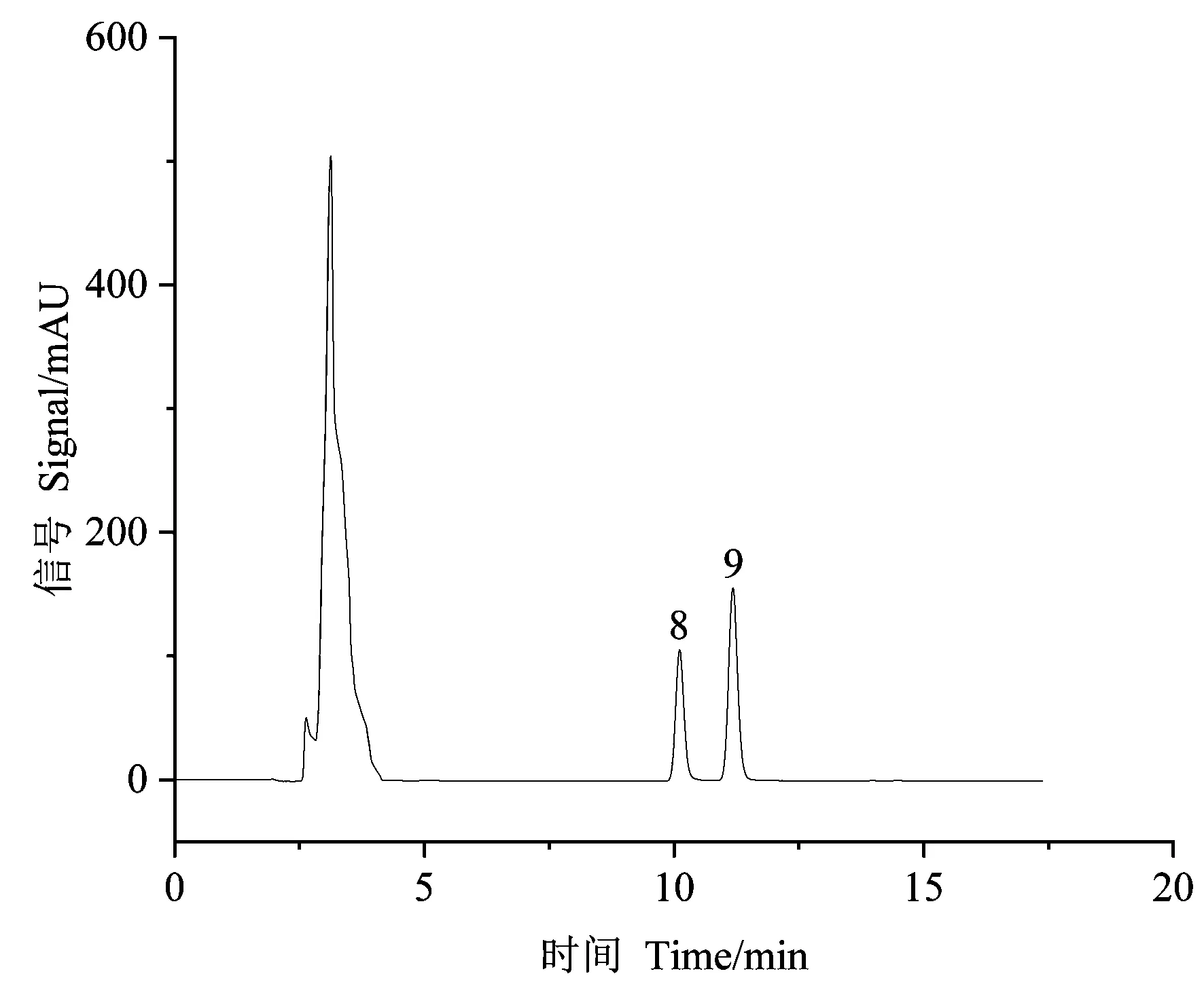
注:8: 甲基麦冬黄烷酮A; 9: 甲基麦冬黄烷酮B。Note: 8: Methylophiopogonanone A. 9: Methylophiopogonanone B.图3 麦冬饮片混合对照品 HPLC 色谱图Fig.3 HPLC chromatogram of mixed reference substance of decoction pieces of Ophiopogon japonicus
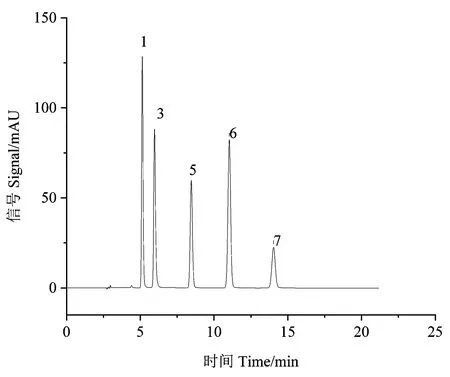
注:1: 芦荟大黄素; 3: 大黄酸; 5: 大黄素; 6: 大黄酚; 7: 大黄素甲醚。Note: 1: Aloe-emodin. 3: Rhein. 5: Emodin. 6: Chrysophanol. 7: Physcion.图4 大黄饮片混合对照品 HPLC 色谱图Fig.4 HPLC chromatogram of mixed reference substance of decoction pieces of Rheum palmatum L.
2.4 不同剂量辐照处理对麦冬、大黄饮片有效成分含量变化的影响
7种化合物的线性关系结果见表7,线性关系良好。不同剂量辐照后的麦冬饮片中的甲基麦冬黄烷酮A、甲基麦冬黄烷酮 B含量测定结果见表8,大黄饮片中的芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚含量测定结果见表9。各剂量下的有效成分含量无显著差异(P>0.05),表明5种剂量辐照处理后的麦冬饮片、大黄饮片有效成分含量无显著变化,即无分解及降解损失。故在2~8 kGy剂量辐照下对麦冬、大黄饮片中的有效成分含量均无影响,在此辐照剂量范围内辐照的两种药材饮片与未辐照处理的样品相比具有质量均一。
2.5 不同辐照工艺对麦冬、大黄饮片辐照剂量分布及剂量不均匀度的影响
在辐照加工中,测量产品中剂量分布的主要目的是为了确定最大吸收剂量Dmax和最小吸收剂量Dmin的位置和量值以及辐照剂量不均匀度(U)[19]。根据剂量跟踪测量结果,吸收剂量分布结果见表10。单面辐照条件下,麦冬饮片厚度为4 cm时,U=1.13,Dmin=3.81 kGy,高于最低有效剂量2 kGy;大黄饮片厚度为6 cm时,U=1.13,Dmin=4.35 kGy,高于最低有效剂量4 kGy,均符合加工标准。随辐照厚度增加,剂量不均匀度(U)增加,超出一定厚度时,Dmin小于最低有效剂量。双面辐照条件下,麦冬饮片厚度为10 cm时,U=1.18,Dmin=4.48;大黄饮片厚度为14 cm时,U=1.19,Dmin=5.95。不同厚度间的剂量不均匀度大致相等,且Dmin均高于最低有效剂量、Dmax均低于最高耐受剂量8 kGy。
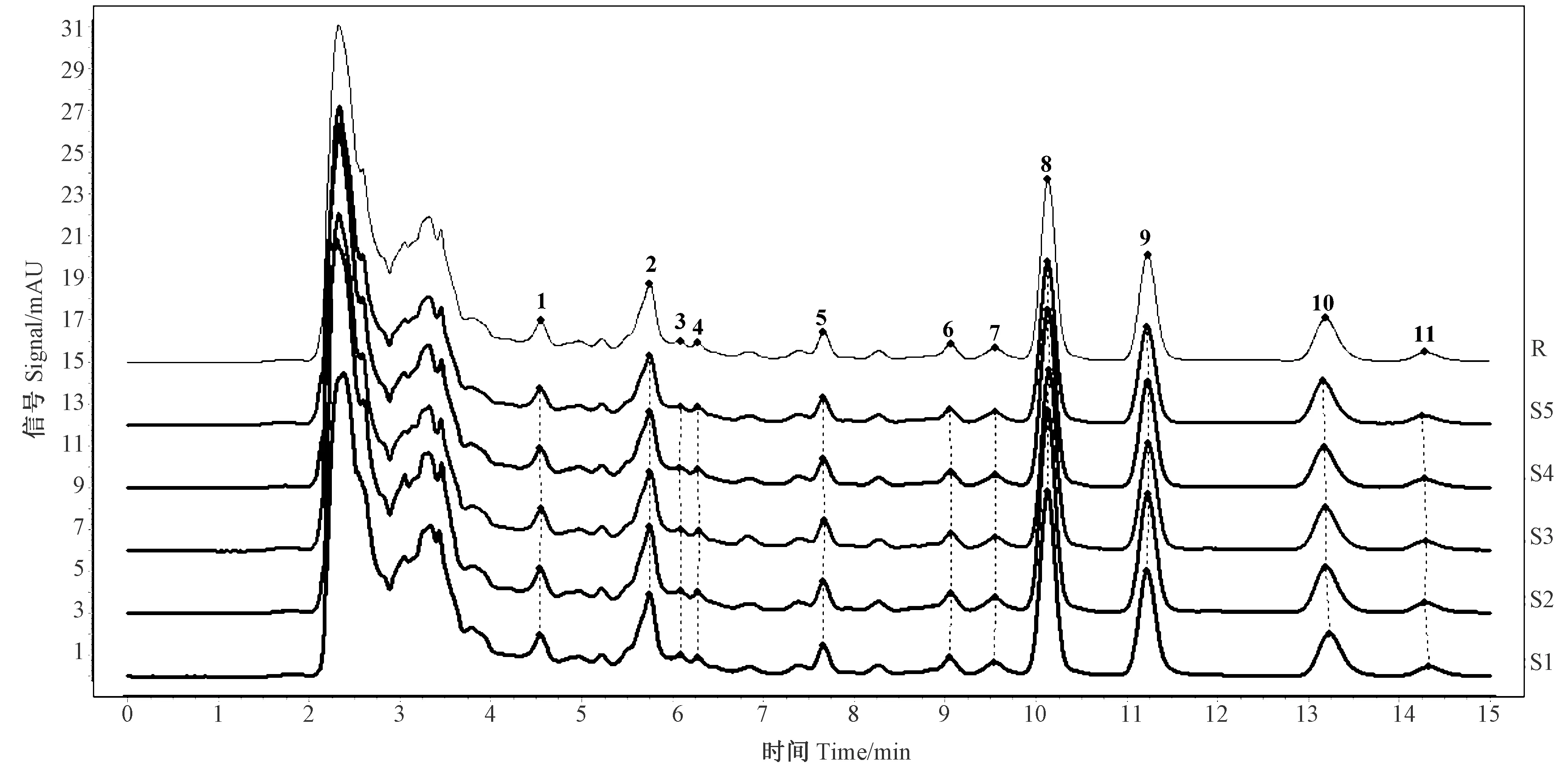
注:R: 对照图谱; S1: 未辐照; S2: 2 kGy辐照剂量; S3: 4 kGy辐照剂量; S4: 6 kGy辐照剂量; S5: 8 kGy辐照剂量。下同。Note: R: Control mapping. S1: Unirradiated. S2: 2 kGy irradiation dose. S3: 4 kGy irradiation dose. S4: 6 kGy irradiation dose. S5: 8 kGy irradiation dose. The same as following.图5 不同剂量辐照处理麦冬饮片指纹图谱的共有特征峰与共有模式图Fig.5 common characteristic peaks and common patterns of fingerprint of decoction pieces of Ophiopogon japonicus treated with different doses of irradiation
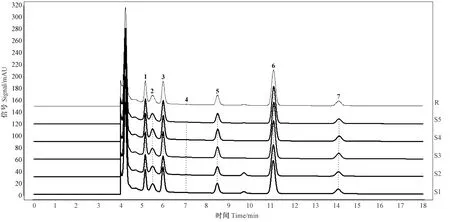
图6 不同剂量辐照处理大黄饮片指纹图谱的共有特征峰与共有模式图Fig.6 Common characteristic peaks and common patterns of fingerprints of decoction pieces of Rheum palmatum L. treated with different doses of irradiation
3 讨论
3.1 不同剂量辐照处理对麦冬、大黄饮片中微生物存活数的影响
中药材由于采收及炮制加工条件粗放,极易感染环境中的微生物,在贮藏过程中出现霉变现象。电离辐射可破坏微生物中的DNA双链、酶、以及蛋白质,从而杀死药材中的微生物[20-23]。本研究结果表明,高能电子束辐照能显著降低麦冬、大黄饮片中微生物含量。2 kGy辐照剂量可使麦冬饮片基本达到无菌水平。然而,2 kGy剂量辐照大黄饮片后,仍能检测出约4个对数级别的需氧菌、霉菌和酵母菌总数,4 kGy辐照才使得大黄饮片微生物数量降至检测限以下,与麦冬饮片存在差异。其原因可能是药材的初始微生物负载越高,适宜的杀菌剂量越大。符国栋[24]用4.5 kGy电子束辐照处理山银花药材,使得微生物数量降至检测限以下。蔡汶莉[25]用电子束辐照百合和山银花药材,结果表明两种药材的D10值不同。Khawory等[26]研究也表明,爪叶洋茱萸、灌状买麻藤、非洲楝的适宜辐照剂量为9 ~ 13 kGy,而其叶提取物的适宜辐照剂量为6 ~ 12 kGy。
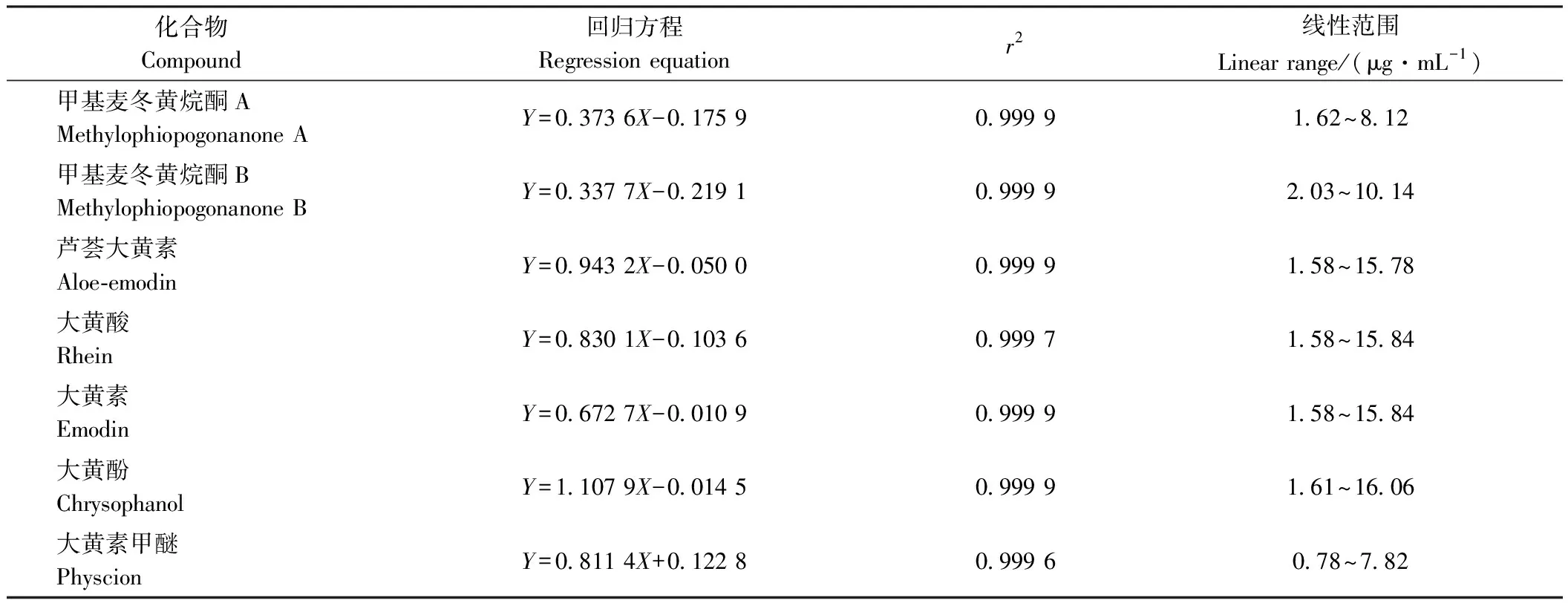
表7 7种化合物线性回归方程Table 7 Linear regression equation of 7 compounds
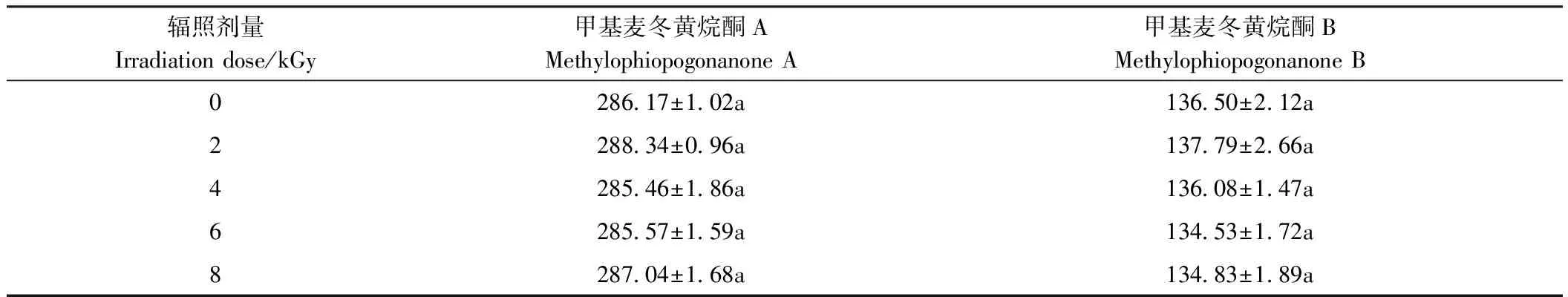
表8 不同剂量辐照处理对麦冬饮片有效成分的影响Table 8 Effects of different doses of irradiation on active components of decoction pieces of Ophiopogon japonicus /(μg·g-1)
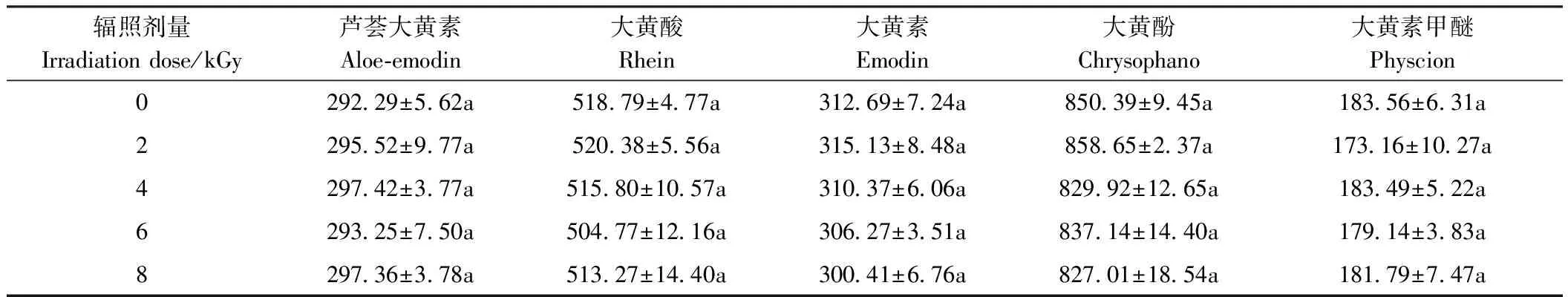
表9 不同剂量辐照处理对大黄饮片有效成分的影响Table 9 Effects of different doses of irradiation on active components of decoction pieces of Rheum palmatum L. /(μg·g-1)
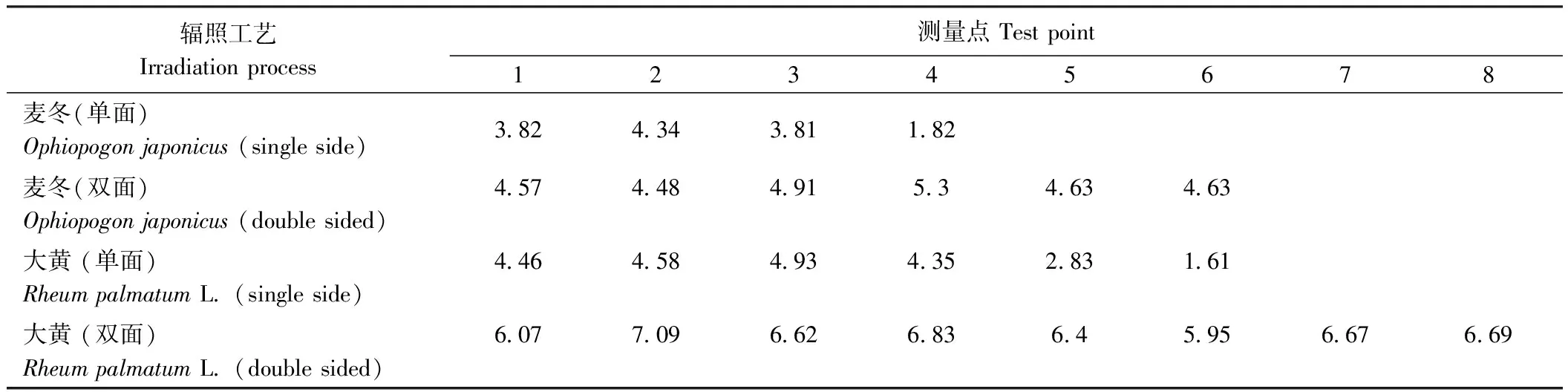
表10 麦冬、大黄饮片辐照吸收剂量分布Table 10 Irradiation absorbed dose distribution of decoction pieces of Ophiopogon japonicus and Rheum palmatum L.
3.2 不同剂量辐照处理对麦冬、大黄饮片理化指标的影响
水分含量是影响中药材贮藏效果的重要因素,水分含量过高或过低都不利于中药材贮藏[27]。高能电子束辐照是一种“冷加工”技术,因此对中药饮片理化指标影响较小。韩振明等[28]研究表明辐照对蜈蚣药粉的水分、总灰分等指标的变化无显著影响。水溶性浸出物也是药材质量控制的重要指标,《中华人民共和国药典》2020版规定大黄水溶性浸出物不得少于25%[15]。本研究表明电子束辐照处理后,大黄水溶性浸出物显著增加。蔡汶莉[25]报道了电子束辐照后,百合药材水溶性浸出物含量显著增加,这与本研究结果一致。水溶性浸出物含量增加的原因可能是蛋白质、盐类等大分子在辐照后发生降解,产生了糖类化合物、有机酸、游离氨基酸等。
3.3 不同剂量辐照处理对麦冬、大黄饮片指纹图谱变化的影响
中药的质量控制一直是个重难点,而中药指纹图谱技术被认为是控制中药品种和质量的最直接、最准确、最有效的手段[29]。近年来利用指纹图谱技术评价60Co-γ辐照灭菌对中药饮片质量的影响已有报道[30-31],但利用指纹图谱技术分析电子束辐照对麦冬、大黄饮片的影响报道较少。本研究采用HPLC指纹图谱技术考察不同电子束辐照剂量对麦冬、大黄饮片指纹图谱的影响,结果显示,经辐照处理后的麦冬、大黄饮片的指纹图谱与未辐照品对比无明显差异,整体稳定性较好。张梦晨等[30]研究发现经过4、6、8、10 kGy剂量辐照后,山药饮片的指纹图谱与未辐照品对比无显著差异。丁伟等[32]研究发现,60Co-γ 辐照灭菌剂量不超过6 kGy时,对虎杖药材指纹图谱无显著影响。由以上研究可知,适宜的辐照剂量对部分中药及饮片的整体质量不会产生影响。
3.4 不同剂量辐照处理对麦冬、大黄饮片有效成分含量变化的影响
高能电子束辐照杀菌的同时,射线的直接作用和诱导产生的自由基也可能会对中药材内部成分产生影响,进而引起有效成分的变化。因此,辐照后饮片有效成分含量的变化也是中药材辐照加工研究中的重要内容。本研究依据《中药辐照灭菌技术指导原则》总体平均辐照剂量不高于10 kGy的原则[9],将最高辐照剂量设置为8 kGy,结果发现在此剂量下未对两种饮片的有效成分含量产生影响。同时,Khattak等[33]研究表明,60Co-γ射线辐照对紫花苜蓿(Nigellastaiva)种子的总酚含量无显著影响,经10 kGy以下剂量辐照处理后,水提物中总酚含量无明显影响,但在12 kGy及以上剂量辐照处理后,酚类物质含量均有所下降,与本研究结果相似。
3.5 不同辐照工艺对麦冬、大黄饮片辐照剂量不均匀度的影响
在辐照过程中,必须了解最大吸收剂量(Dmax)和最小吸收剂量(Dmin)在堆码产品中的位置与大小[34]。且剂量不均匀度(U)控制在2以内才可用于大规模辐照加工[35]。为保证在实际大批量生产应用过程中,药材饮片能达到最低有效灭菌剂量,将本研究剂量不均匀度(U)标准设置为1.2。结果表明,单面辐照时,麦冬、大黄饮片吸收剂量均随辐照深度的增加呈先上升后下降趋势,其最大吸收剂量(Dmax)均在中部。原因可能是电子束照射到药材表面后发生电子累积[36]。麦冬饮片堆码厚度为4 cm,大黄饮片堆码厚度为6 cm时,剂量不均匀度(U)均在1.20以内,超过该厚度时其剂量不均匀度(U)开始急速增加。双面辐照可通过剂量叠加,增加其穿透厚度。实际应用加工中多以双面辐照为主,以降低剂量不均匀度(U)。采用双面辐照,麦冬饮片堆码厚度为10 cm时,大黄饮片堆码厚度约14 cm时,剂量不均匀度(U)可控制在1.20以内,符合产品生产要求。同时,王海宏等[37]对采用电子束辐照速冻芦笋,结果表明双面辐照,辐照深度为14.2 cm时,不均匀度1.15,可以满足生产要求,与本研究结果相似。
4 结论
本研究结果表明,电子束辐照技术适用于麦冬、大黄饮片的贮藏养护。麦冬饮片适宜灭菌剂量可控制在2~8 kGy;大黄饮片可控制在4~8 kGy。单面辐照时,麦冬饮片适宜堆码厚度为4 cm、大黄饮片为4 ~6 cm;双面辐照时,麦冬饮片适宜堆码厚度为10 cm,大黄饮片为14 cm。

