味觉感知的人体肠-脑轴信号传导机制研究进展
赵孟斌,张琦梦,宋明月,刘 果,曹 庸,高向阳,*
(1.华南农业大学食品学院,广东省功能食品活性物重点实验室,广东 广州 510642;2.岭南现代农业科学与技术广东省实验室,广东 广州 510642)
味觉是生物的基本生理感觉之一,对维持体内的营养平衡至关重要。味觉系统可保证对食品中营养物质和能量摄入,同时有效避免摄入有毒有害物质。味觉的产生是呈味物质作用于味觉受体及相关味觉细胞,由味觉受体蛋白介导,通过细胞内信号转导和神经递质释放的途径传递至神经中枢。味觉受体主要分布在口腔和胃肠道感觉系统,参与人和动物对营养物质的传感与控制,具有十分重要的调节功能。舌组织是口腔内最主要的味觉感受器官,味觉受体主要表达于舌组织上皮的轮廓状乳头、叶状乳头和菌状乳头。乳头中味蕾的存在使得哺乳动物能够感受味觉刺激,由味蕾中的味觉细胞上不同的味觉受体通过产生神经电信号,传递至大脑,产生味觉感受。这些味觉受体包括味觉受体第一家族(taste receptor type 1,T1R)、味觉受体第二家族(taste receptor type 2,T2R),它们都属于G蛋白偶联受体(G protein-coupled receptors,GPCRs)家族,其中T1R识别甜味和鲜味,T2R对苦味刺激做出反应。T1R家族的成员通过形成异源二聚体发挥作用,可以对特定的味觉刺激做出相应反应。T1R2-T1R3对甜味刺激有反应,而T1R1-T1R3对鲜味刺激有反应,由于存在多个结合位点,这两个异源二聚体都表现出较低的特异性,使它们能够对多种不同的配体做出反应,如糖、甜味剂、-氨基酸和一些蛋白质都可与T1R2-T1R3结合,从而产生甜味。相比之下,T2R家族由超过25个成员组成,它们能对苦味做出反应,且具有高特异性。
近年来,肠胃感知味觉的机制已经日益引起了学者们的广泛关注。肠胃系统能像舌头一样通过相似的味觉感受器和信号传递来感知营养物质和毒素,Bayliss等首次观察到了肠道的感觉特性和其释放信号分子的能力,证明小肠的酸度变化能引起胰液的分泌,这正是由肠道激素分泌素介导的过程。Sternini等证明胃肠道感觉系统中味觉受体主要分布在肠内分泌细胞(L细胞)、胃饥饿素细胞(P细胞)、肠嗜铬细胞(EC细胞)中,肠内分泌细胞是胃肠道的主要化学感觉细胞。在肠道中,肠内分泌细胞将肠体和组织分开,它们能够感知摄入的营养物质和微生物代谢物。肠内分泌细胞占肠上皮细胞总数不到1%,但是通过分泌多种肽激素如胆囊收缩素(cholecystokinin,CCK)、肽YY(peptide YY,PYY)和胰高血糖样肽(glucagon-like peptide,GLP)-1等,构成人体最大的内分泌器官。这些调节肽作为肠-脑交流的信号分子,通过局部作用于肠神经和迷走神经纤维,或进入体循环通过内分泌机制而发挥作用。
肠-脑轴是肠神经系统和中枢神经系统之间双向的信息交流通路,其能够联系大脑认知、情感中枢与肠道功能。目前肠-脑轴的研究大部分在医学方面,参与多种疾病的发病过程,如肠道炎症性疾病、神经退行性疾病等,关于味觉相关的肠-脑轴神经回路研究较少。本文对近年来味觉在肠-脑轴中的调节机制、胃肠道中味觉感知通路及味觉信号传导机制方面综述如下。
1 胃肠道的脑肠肽激素
近年来研究表明味觉不仅仅在舌组织中被感受,胃肠道也可通过内分泌细胞上与舌组织相似的味觉受体和化学感受信号通路来感受不同的味觉。肠道中的味觉物质可以通过受体的识别、胃肠道激素的分泌和神经系统传入大脑,从而通过肠-脑轴产生一系列的行为。在肠道味觉信号传导分子机制的研究中发现,T2Rs和味导素可以在能够产生PYY和GLP-1的肠道L细胞中表达。
肠-脑轴传导过程涉及脑肠肽激素,与味觉、食欲有关,可分为两类:一类是促食欲肽如Ghrelin;另一类是抑食欲肽如PYY、GLP-1、CCK等,部分脑肠肽激素见表1。这些脑肠肽激素是由胃肠道分泌,并能将信号传递至大脑,从而调节动物的行为。PYY分为PYY和PYY两种形式,其中PYY主要存在血液中。PYY在小肠和大肠中的分布逐渐增多,在回肠和直肠中分布最多。肠道分泌的PYY会降低动物的取食量,减少体质量的增加,也会使大脑的弓状核处表达增加。GLP-1是由30个氨基酸残基组成的肽,最主要的作用是降低饭后的血糖水平,减缓胃排空,增加饱腹感。核磁共振实验表明肠道GLP-1水平的增加会使下丘脑腹内侧核和室旁核神经核内的信号增强。由小肠分泌的CCK与PYY共同存在于肠道L细胞中,Kaelberer等采用质谱实验证实肠内分泌细胞表达CCK和PYY等脑肠肽。故推测,基于肠道中脑肠肽的存在,味觉感应与肠-脑轴应有较大的关联。
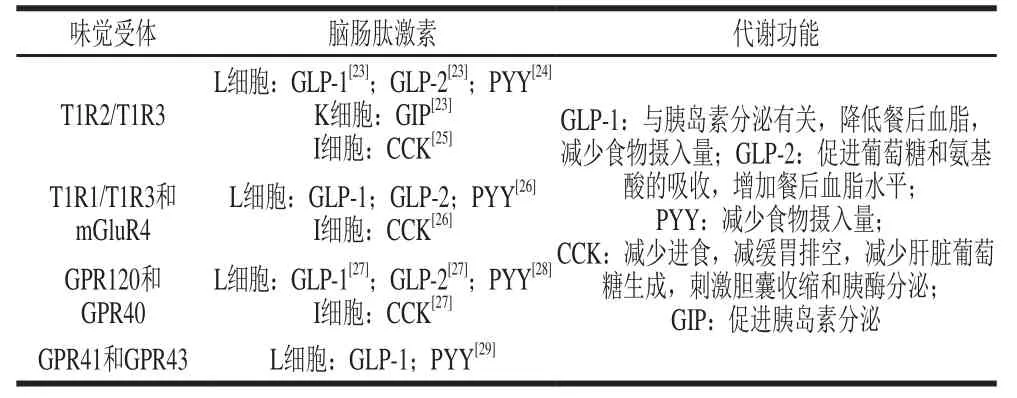
表1 部分肠道味觉受体与脑肠肽激素及其代谢功能Table 1 Metabolic functions of intestinal taste receptors and brain-gut peptide hormones
2 胃肠道中味觉感知通路的发现
一些研究在肠内分泌细胞中鉴定了T1R家族成员和味导素,表明除了口腔,胃肠道中也存在着对甜味和鲜味的感知机制。Stamataki等报道葡萄糖能够激活小鼠胃肠道中的甜味受体T1R2-T1R3,并发现该甜味受体在人肠道内分泌细胞中也有表达。Tan等通过设计T1R2-T1R3缺陷型小鼠证明了小鼠肠道对糖的偏好,表明肠道能够对甜味做出反应。Meyer-Gerspach等通过给予小鼠肠道不同浓度的葡萄糖刺激,发现肠道味觉感受器有不同程度的响应。葡萄糖的吸收也受到胃肠道的控制,Shirazi-Beechey等的研究表明,Na/葡萄糖共转运体1的表达受到T1R2-T1R3调控。除了对葡萄糖,肠道中甜味敏感的T1R2-T1R3受体也被证明对人工甜味剂有反应,Moran等发现,猪小肠的EC细胞表面表达的甜味受体T1R2-T1R3能够感知三氯蔗糖等人工甜味剂,同时还发现了信号转导分子味蛋白。
蛋白质在胃肠道中被消化分解成寡肽和氨基酸等复杂的降解产物,一些游离-型氨基酸、肽及其衍生物等可诱发鲜味。有报道在胃肠道中观察到几种能够感知诱发鲜味的蛋白降解产物和氨基酸的受体,在肠内参与鲜味识别的有Ca传感受体(calcium-sensing receptor,CaSR),属于GPCRs家族。Liou等发现CaSR在十二指肠的L细胞中表达,氨基酸刺激该细胞群导致CCK的分泌,而这些细胞中CaSR的靶向缺失可抑制-苯丙氨酸诱导的CCK释放。同样,在肠内分泌的STC-1细胞中也发现了-苯丙氨酸诱导的CCK分泌,说明CaSR的激活与产生鲜味的氨基酸有关。Mace等在大鼠小肠分离环中发现,-氨基酸可以刺激GLP-1、GIP和PYY的分泌,而CaSR抑制剂可抑制分泌,这些都表明肠道中存在与鲜味氨基酸有关的CaSR受体。
肠道中还存在鲜味受体T1R1-T1R3。免疫组织化学显示小鼠近端肠的同一内分泌细胞共同表达了T1R1-T1R3和CCK,Tian Min等发现CCK和鲜味受体T1R1-T1R3主要在空肠表达,并在功能上相互关联,不仅显示了肠道中鲜味受体T1R1-T1R3的存在,也进一步说明肠道鲜味传感可能与CCK分泌有关。其他的鲜味受体GPR6CA、GPR92/93和mGluRs也被证明在胃肠道中表达,并参与鲜味传感。
T2Rs是存在于舌组织中的苦味受体,T2Rs也存在于胃肠道和STC-1细胞表面,由此可知,胃肠道中亦存在苦味的感应机制。Kaji等证实,T2Rs在肠嗜铬细胞(EC细胞)中选择性表达,当苦味物质进入肠道,STC-1细胞内的Ca浓度增加,促进CCK的分泌。由此推测,肠-脑轴中味觉物质、味觉受体、脑肠肽激素和神经系统相互联系,共同调控着哺乳动物的摄食行为。
除了上述的甜味、鲜味和苦味受体外,对肠道中的咸味、酸味以及被称为第六味觉的脂肪味觉受体的研究鲜见报道。
3 肠-脑轴味觉信号传导机制
最近许多的研究已经涉及到肠-脑轴,肠-脑轴作为一个关键的机制,能够通过迷走神经将信息从肠道传递至大脑。肠-脑轴正在成为传递神经信号的基本通道,向大脑传递身体的代谢和生理状态信息,但人类肠道味觉感受器刺激和大脑活动的确切相互作用还没有完全解释清楚。
3.1 肠道与大脑之间的联系
胃肠道是由中枢神经系统、自主神经系统和肠神经系统共同控制的。肠神经系统来源于神经嵴细胞,分布于2个互相连接的神经丛,即肌间神经丛和黏膜下神经丛。肠神经系统包括感觉神经元、中间神经元、运动神经元和神经胶质细胞,是外周神经系统的一部分,也是控制胃肠道功能的自主神经系统的一个分支,可以自主调控消化系统局部的生理状态。另外,肠神经系统的初级传入神经具有感知肠道激素(如GLP、CCK和PYY)的能力,可以被肠道内的味觉物质激活。
肠道与大脑之间的联系主要有两种方式。一方面,肠神经系统通过交感神经系统和副交感神经系统的运动和感觉神经纤维与大脑中枢神经系统相连,最近的研究表明,迷走神经的神经末梢分布于肠道的黏膜中,胃肠道可通过其感觉纤维将信息投射到孤束核从而传递至大脑;另一方面,肠道中存在着肠内分泌细胞,可与感觉神经纤维形成突触相连,并且肠内分泌细胞释放的激素可作用于下丘脑的弓状核或通过迷走神经作用于脑干的孤束核,来调控大脑的饥饿和饱腹感中枢。
肠道菌群在人体内处于相对平衡的状态,有研究表明肠道菌群影响肠道和大脑的信息传递,且在人体代谢、免疫、神经活动方面均是重要的参与者。肠道菌群影响神经系统发育和功能,发育成熟的肠-脑轴功能亦受肠道菌群的调节,因此越来越多的学者认为肠道与大脑之间存在着某种特殊的关系。
3.2 肠-脑轴的味觉感应
肠-脑轴是一种双向调节通路,即大脑可以影响肠道功能,肠道内环境变化也可以对脑功能产生影响。肠内分泌细胞及其释放的激素可与大脑中枢神经系统进行交流并影响其功能,肠道中的营养物质及其味觉感应与大脑之间存在着怎样的关联,是近年来肠-脑轴味觉研究的切入点。
3.2.1 味觉激活大脑中枢神经系统
Tsurugizawa、Kondoh等利用大鼠模型,通过磁共振功能成像发现胃内的葡萄糖、谷氨酸钠(monosodium glutamate,MSG)和NaCl能导致前脑激活,且切断迷走神经抑制了脑激活,表明迷走神经是在肠-脑轴之间传递信息的主要途径。Otsubo等通过测量Fos蛋白(神经元激活的标志物),进一步明确了大鼠分别经MSG、葡萄糖、NaCl灌胃后的大脑皮层激活位点,大鼠灌胃后,鲜味代表物质MSG激活肠道迷走神经传入纤维,从而显著激活大脑缰核、杏仁核和下丘脑亚核的神经网络,但未鉴定出鲜味物质MSG激活的神经元类型。另外,Otsubo等还指出切断肠道迷走神经可减少肠胃内MSG对大脑的激活,由此推测迷走神经是味觉物质激活大脑区域的重要通路,对肠道中味觉物质和激活大脑皮层区域之间的迷走神经的确切研究,有助于明确肠-脑轴中的味觉感应机制。
Meyer-Gerspach等通过将苦(奎宁)、甜(葡萄糖)、酸(柠檬酸)、咸(NaCl)和鲜味(MSG)5种味觉物质添加至肠道,判断是否能通过肠道味觉感受器感受不同浓度的生理味觉刺激,发现与甜、咸和酸味相比,鲜味和苦味对大脑皮层与神经工作记忆有关区域的影响程度较大,表明与舌组织相似,肠-脑轴对苦味和鲜味的感知较敏感。
3.2.2 肠-脑轴神经回路
Williams等研究了肠-脑轴中对味觉营养物质和肠道蠕动有反应的感觉神经元,并从基因上定义了GPR65、GLP-1受体两种不同类型的肠道到大脑的传入神经元,GPR65神经元密集分布于肠绒毛,用于检测营养物质,而GLP-1受体神经元则形成专门的终端,可用于检测胃肠道的蠕动。它们在不同程度上监控和控制消化系统,是肠-脑轴信号相关的感觉生物学和神经回路的关键分子基础。
同样,Kaelberer等采用小鼠模型确定了将肠道内的营养感知信号传递至大脑的神经回路,发现肠内分泌细胞能与迷走神经细胞形成突触,连接肠道与大脑,并利用谷氨酸盐作为神经递质,快速将感觉信号从肠道传递到大脑皮层。
Tian Min等在体外猪空肠模型采用支链氨基酸(-亮氨酸、-异亮氨酸、-缬氨酸)通过激活鲜味受体T1R1-T1R3来刺激CCK的分泌,发现-亮氨酸和-异亮氨酸在诱导CCK调控方面比-缬氨酸更有效,-亮氨酸还促进了STC-1细胞的分泌。说明氨基酸不仅可以激活肠道鲜味受体,还可以调节受体在胃肠道中的表达,其氨基酸混合物或多肽调控肠道鲜味受体T1R1-T1R3表达的机制还需进一步研究。
3.2.3 味觉感知的人体肠-脑轴信号传导机制假说
小鼠和人的胃肠道均表达T1R1、T1R2和T1R3味觉受体、-味导素及磷脂酶-β2(phospholipase C-β2,PLC-β2),鲜味刺激小鼠肠道能激活鲜味受体T1R1和T1R3,并导致瞬时受体电位M亚型5(transient receptor potential melastatin 5,TRPM5)通道开放,促进肠内分泌细胞产生GLP-1和CCK等激素。Rozengurt等发现胃肠道苦味刺激可激活-味导素,通过活化磷酸二酯酶来降低细胞内3’,5’-环腺苷酸(3’,5’-cyclic adenylic acid,cAMP)的水平,升高细胞内Ca浓度,触发TRPM5通道,进而引起肠内分泌细胞分泌CCK、PYY和GLP-1等激素。Mace等证明甜味受体T1R2、T1R3与-味导素密切相关,曾青山等也发现功能性腹泻患者肠道上味觉受体T1R1、T1R2和T1R3及-味导素在味觉信号传导中发挥重要作用。根据以上研究及前文分析可知,肠-脑轴存在味觉信号转导途径,胃肠道中存在T1R1、T1R2、T1R3、T2Rs等味觉受体和-味导素及PLC-β2等关键味觉信号分子,且肠道味觉物质刺激肠内分泌细胞分泌脑肠肽激素,参与从肠道到大脑的味觉信号传递,肠道中味觉物质还能激活大脑的神经网络,表明肠-脑轴味觉感知是基于胃肠道受体及脑肠肽、神经元和大脑中枢神经系统之间的共同调控,因此本文提出味觉感知的人体肠-脑轴信号传导机制假说。肠-脑轴味觉信号传导途径是味觉刺激作用于肠道与受体结合,引起脑肠肽激素分泌,这些激素被神经元突触识别,将味觉信息传递至大脑中枢神经系统(图1)。进一步地,对于甜味受体T1R2/T1R3和鲜味受体T1R1/T1R3的信号传导通路是味觉物质作用于肠道后,与肠道中相应的味觉受体结合,激活-味导素,从而活化PLC-β2,产生二酯酰甘油(diester acyl glycerol,DAG)和肌醇三磷酸(inositol triphosphate,IP3),IP3与第三类肌醇三磷酸受体结合,导致IP3-门控Ca通道开放,释放Ca,引起细胞质内Ca浓度上升,TRPM5通道开放,Na内流,肠内分泌细胞分泌PYY、CCK等激素,被肠神经元突触特异性识别,将味觉信号传导至大脑神经中枢。而鲜味受体mGluR4和苦味受体T2Rs信号传导通路与上述所不同之处在于引起Ca释放的方式:味觉物质与受体结合,激活-味导素,从而活化磷酸二酯酶(phosphodiesterase,PDE),使细胞质内cAMP浓度降低,从而解除环核苷酸(cyclic nucleotide,cNMP)的抑制作用,释放Ca(图2)。针对该假说,笔者课题组也初步研究了鲜味物质脯氨酸二肽呈鲜特性,建立了小鼠肠道STC-1肠内分泌细胞味觉感知模型,发现脯氨酸二肽的呈味活性越强,其对鲜味受体mRNA表达的促进程度越高,并且T1R1是介导肠道对脯氨酸二肽鲜味感知的重要受体,这为假说的完善提供了理论支撑,对进一步解析肠-脑轴味觉感应机制具有重要意义。
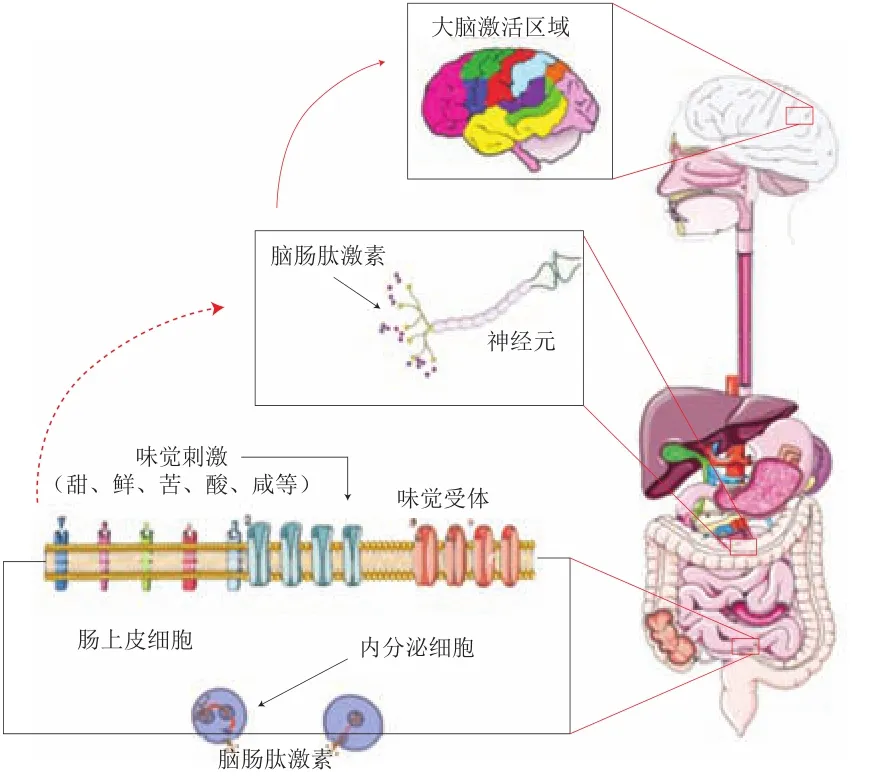
图1 肠-脑轴味觉信号传导途径Fig.1 Taste signal transduction pathway in gut-brain axis
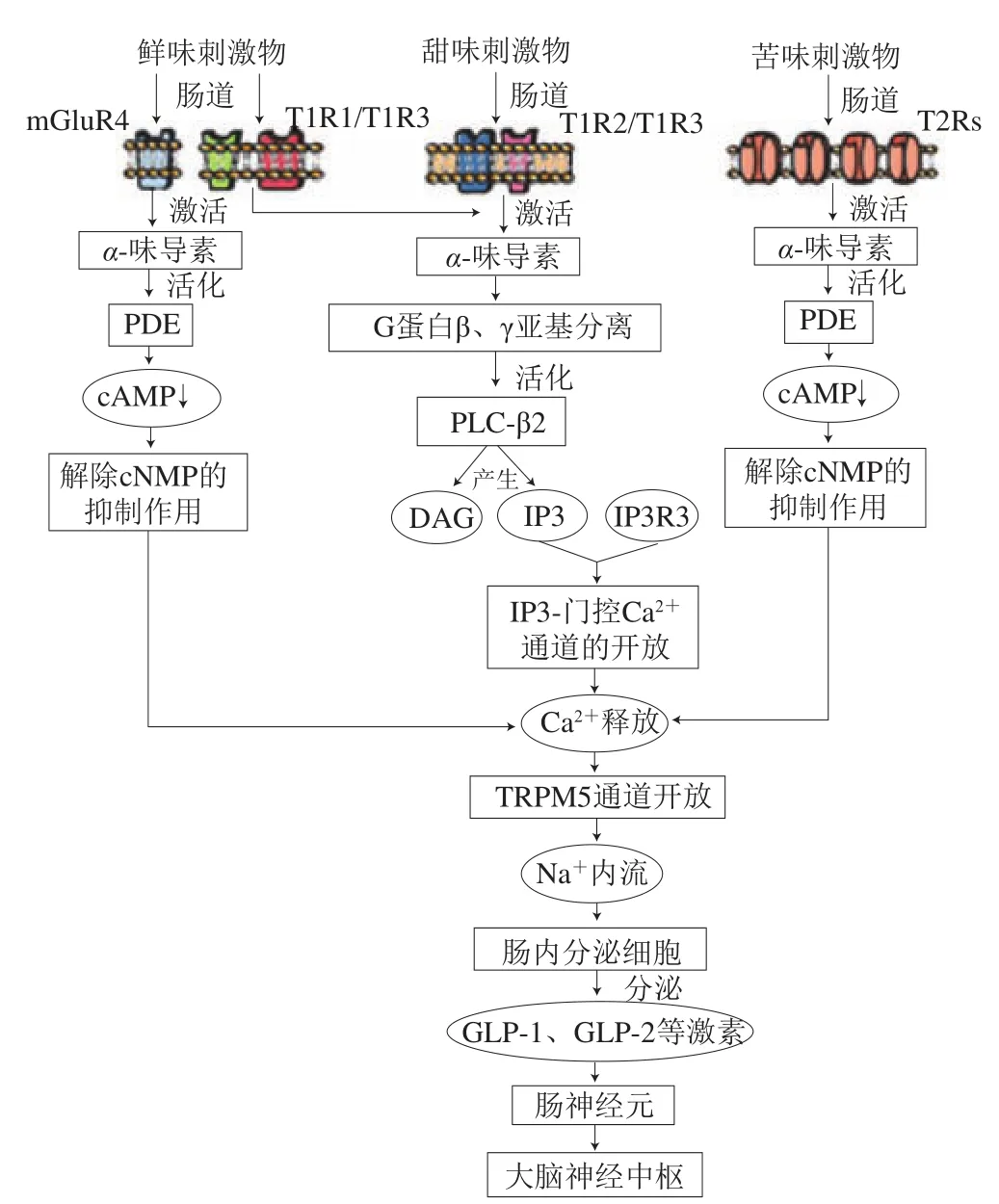
图2 肠-脑轴中鲜味、甜味和苦味的信号传导机制假说Fig.2 Hypothesis about signal transduction mechanism of umami,sweet, and bitter taste in the gut-brain axis
4 味觉偏好的发现
最近,Tan等研究了肠-脑轴对糖偏好的神经基础,并证明迷走神经和脑干中的神经元群通过肠-脑轴被激活,从而产生对糖的偏好。他们利用功能成像技术监测肠-脑轴的活动,发现了肠道葡萄糖激活的迷走神经细胞。但值得注意的是,虽然发现甜味受体在肠内分泌表达,但并不参与糖偏好的过程,说明糖偏好的神经回路与肠-脑轴对甜味识别的神经回路是有区别的,这两种回路相互作用,共同调控营养摄取和味觉识别。糖偏好的发现将促使学者们确定肠-脑轴中是否存在其他的味觉营养物质偏好,有可能揭示舌味觉系统与肠-脑轴味觉系统之间的相互联系。大量的研究表明,癌症患者的味觉变化是一种常见的症状,化疗与味觉改变密切相关,乳腺癌患者化疗后味觉会发生改变,味觉改变在乳腺癌患者化疗引起相关症状中排名前列。肿瘤患者味觉改变的发生率高达71.96%。味觉改变影响患者的营养状态、身体健康以及对药物的有效吸收,因此,肠-脑轴及味觉偏好的发现可能为开发治疗新药物提供新的途径,未来将可能在医药、保健等领域开发出新食品,通过在药物中添加合适的味觉物质来改变某种味觉的偏好,它可以激活舌味觉系统和肠-脑轴味觉系统,通过味觉偏好引导人体对特定物质的吸收,有利于发现新的药物靶点,加强胃肠道对物质的吸收利用,进一步提高药效。如何精准调控味觉偏好是未来应用研究应该重点关注的方面。
5 结 语
胃肠道中味觉感知通路的发现揭开了肠-脑轴味觉感应机制的研究。胃肠道中的脑肠肽激素是肠-脑轴之间信息交流的基础,当肠道中的味觉物质与肠内分泌细胞接触时,肠内分泌细胞上的味觉受体会专门识别味觉物质,并刺激细胞分泌CCK、PYY等脑肠肽激素,而这些激素会被肠-脑轴之间的神经元突触识别,神经元将味觉信息传递至大脑中枢系统,从而特异性地激活相应的如伏隔核、背侧下丘脑等大脑区域,大脑根据传入的味觉信息作出指令,调控人体生理状态。在此肠-脑轴味觉信号传导机制下,目前的研究仅限于一些味觉受体和神经元的识别,大部分为甜味。然而,关于味觉相关的肠-脑轴神经回路研究仍然处于初始阶段,并未对肠-脑轴味觉感应本质及原因进行深入研究。本文提出的味觉感知的人体肠-脑轴信号传导机制假说,还需要开展更深入的研究,进一步丰富完善肠-脑轴味觉感知机制,除了对甜味的研究,应加强对其他味觉如鲜味、酸味、苦味等的深入研究,以建立系统全面的肠-脑轴味觉感应机制,以期阐明多种味觉的肠-脑轴完整的神经回路及调节机制,为味觉物质在肠-脑轴中的摄入、代谢、调节等及开发新的味觉感知途径提供新的理论依据。味觉偏好的发现,可为食品、医药等领域开发治疗新药物、寻找新的药物靶点及开发特医、特膳食品提供新的途径。

