吡啶-2,6-二羧酸处理对梨果采后黑斑病控制作用及其抑菌机理
杨阳阳,刘志恬,李永才*,毕 阳,卢玉慧,谢鹏东
(甘肃农业大学食品科学与工程学院,甘肃 兰州 730070)
早酥梨是中国农业科学院果树研究所将苹果与梨进行杂交得到的一种新的梨品种,该品种皮薄肉多、果肉白细、酥脆爽口、汁多味甜,可溶性固形物质量分数达12.1%~15.1%,可食用率高达95%。除此以外,该品种连续结果能力强,丰产、稳产,所以成为众多梨品种当中的最佳栽培对象之一。早酥梨的采收期为每年的7ü8月,气温较高,这对后续早酥梨的销售非常不利。微生物侵染会严重影响早酥梨的品质,商业价值迅速降低,给果农造成经济损失。其中由互隔交链孢()引起的黑斑病是早酥梨采后主要的病害之一,在室温环境下会快速生长繁殖产生毒素,不仅会使果实腐败,还会对人类和动物健康造成潜在安全风险。目前常用人工合成化学杀菌剂控制梨果采后病害,但因长期使用化学杀菌剂会产生农用残留、造成环境污染,也会使病原物产生抗药性。因此,寻求和开发对全球环境以及人类健康无危害的天然杀菌防腐剂来抑制采后病害成为大势所趋。
枯草芽孢杆菌()是一种有益的生防细菌,具有较强的生防作用,其作用机制包括竞争作用和拮抗作用。竞争作用主要是对空间以及营养物质的争夺,拮抗作用是指微生物自身在正常的生命活动过程中产生的部分代谢产物会作用于致病菌的细胞器,影响致病菌正常生命活动,导致致病菌不能正常生长繁殖。枯草芽孢杆菌属的部分代谢物已被证明具有抗真菌活性,在各种芽孢杆菌中,枯草芽孢杆菌已被彻底开发作为许多植物疾病的生物防治剂。胡陈云等研究发现枯草芽孢杆菌ge25分泌的抑菌脂肽严重影响人参黑斑菌和人参锈腐菌菌丝体的正常生长,导致菌丝体形态异常、发育畸形。Ren Jianjun等研究发现枯草芽孢杆菌代谢产物XB-1对桃褐腐病菌有明显的抑制作用。吡啶-2,6-二羧酸(pyridine-2,6-dipicolinic acid,DPA)是从枯草芽孢杆菌168的分泌物中分离出的一种新的抗真菌化合物,其作为细菌芽孢特有的化合物而成为生物标志物,广泛存在于芽孢中,占芽孢干质量的5%~15%。吡啶二羧酸有5种结构不同代谢产物,其中,吡啶-2,3-二羧酸和DPA是芽孢杆菌分泌物中的常见代谢产物,课题组前期预实验结果表明DPA的抑菌效果最佳。从结构上看,吡啶二羧酸属于吡啶类杂环化合物。这种化合物具有高效、毒性低等优异的生物活性,从而成为绿色抑菌剂研制的新方向。另外,在生产生活中这类化合物应用广泛,农业上可用于杀菌、除草、杀虫;用于医药上,具有抗癌、消炎、降低血糖等优点。Song Xuege等研究发现5 mmol/L的DPA在pH 5.6时,通过抑制几丁质的合成而显著抑制生长,在预防性应用中,DPA可将梨树的溃疡病发病率减少90%。目前吡啶二羧酸的相关研究较少,且DPA在果蔬采后病害控制中的应用鲜有报道。因此本实验使用DPA来处理黑斑病菌,研究DPA对生长的抑制作用,并进一步深入探讨其可能的抑菌机理,同时还用DPA对早酥梨果实进行处理,探究DPA对黑斑病的控制作用,以期拓宽DPA适用范围,为DPA投入市场实际生产应用提供理论依据,同时为控制早酥梨采后病害提供一种新的天然防腐杀菌剂。
1 材料与方法
1.1 菌株、材料与试剂
供试菌株为课题组前期研究分离得到,现保藏于本实验室。
早酥梨采摘于甘肃省景泰县条山农场,挑选大小相近(质量约200~250 g)、无机械损伤、无病虫害的果实,采摘当天运至实验室,静置24 h散去田间热后,于冷库((3f2)℃、相对湿度85%)中贮藏待用。
DPA购于上海麦克林生化科技有限公司。
1.2 仪器与设备
1510型酶标仪 美国赛默飞世尔仪器有限公司;H-1850R型台式高速冷冻离心机 长沙湘仪离心机有限公司;DDS-370微型电导仪 上海仪电科学仪器股份有限公司;BX51型荧光显微镜 日本Olympus公司;CentriVap真空离心浓缩仪 美国Labconco公司;ACQUITY Arc四元梯度超快速液相色谱仪 美国Waters公司。
1.3 方法
1.3.1孢子悬浮液的配制
参照文献[17]的方法并略作修改,在超净工作台中向培养5 d的培养皿中倒入少量含有体积分数0.01% Tween-80的无菌水,用已灭菌的涂布器轻刮菌丝,将所得溶液通过4 层无菌纱布过滤到三角瓶中,并配制成1h10个/mL孢子悬浮液待用。
1.3.2菌丝的收集
取1 mL 1.3.1节孢子悬浮液(浓度为1h10个/mL)接种至100 mL马铃薯葡萄糖肉汤(potato dextrose broth,PDB)液体培养基中,在28 ℃、150 r/min条件下恒温振荡培养36 h后,用布氏漏斗过滤收集菌丝备用,菌丝用无菌水洗涤3 次,以除去培养液。
1.3.3 DPA处理及相关指标的测定
1.3.3.1 DPA处理及菌落生长评价
参照文献[18]的方法并稍作修改。分别称取8.3、16.7、33.4、66.8 mg DPA并溶解于100 mL融化的马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基中,得到含0.5、1.0、2.0、4.0 mmol/L DPA的PDA培养基,以未添加DPA的PDA培养基作为对照组,待培养基凝固后,在培养基中心分别接种2 μL 1.3.1节孢子悬浮液(浓度为1h10个/mL),28 ℃避光培养,分别在培养3、5、7、9 d时观察菌落形态并采用十字交叉法测量菌落直径。
1.3.3.2孢子萌发率和芽管长度的测定
参考文献[19]的方法并稍作修改。取1 mL 1.3.1节孢子悬浮液(浓度为1h10个/mL),8 000 r/min离心2 min,弃去上清液,向沉淀中分别加入1 mL不同浓度(0(对照组)、0.5、1.0、2.0、4.0 mmol/L)的DPA溶液,振荡摇匀。将PDA培养基裁成圆形(=0.5 mm)放置于灭过菌的载玻片上,培养基中央滴加20 μL上述含有不同浓度DPA的孢子悬浮液,分别于28 ℃孵育2、4、6、8 h后,在光学显微镜下观察孢子萌发情况,同时通过IS Capture软件测量芽管长度。每次观察,孢子总数为100个,重复3 次。按式(1)计算孢子萌发率。

1.3.4 DPA处理早酥梨及病斑直径的测定
参照文献[20]的方法并稍作修改。将挑选好的早酥梨果实用2%(体积分数)的NaClO溶液浸泡2 min,然后用蒸馏水冲洗除去果实表面NaClO溶液,果实晾干后用75%(体积分数)乙醇溶液擦拭果实表皮。随后用铁钉在果实赤道部位均匀地打3个孔,每孔接种20 μL 1.3.1节孢子悬浮液(浓度为1h10个/mL),室温晾干后分别向每个孔中加入20 μL浓度为0(即对照组)、5.0、10.0、20.0 mmol/L的DPA溶液,每组9个果实,各组处理好的果实放入分别放入纸箱(60 cmh60 cmh90 cm)中,在每个纸箱中放入一张湿润的滤纸,以提供果实发病所需的湿度,于室温条件下避光贮藏。在贮藏3、5、7、9、11 d观察果实病斑并采用十字交叉法测量果实的病斑直径。
1.3.5细胞膜完整性的测定
测定方法参考文献[21]并稍作修改。将1 mL 1.3.1节孢子悬浮液(浓度为1h10个/mL)置于2 mL无菌离心管中,8 000 r/min离心2 min,弃去上清液,在沉淀中加入1 mL浓度分别为0(即对照组)、0.5、1.0、2.0、4.0 mmol/L的DPA溶液,在28 ℃培养箱温育2 h,8 000 r/min离心2 min,弃去上清液,孢子沉淀中加入1 mL磷酸盐缓冲液(phosphate buffered saline,PBS)(0.01 mol/L、pH 7.0,后同),室温下避光静置30 min,然后8 000 r/min离心2 min,弃去上清液,向孢子沉淀中加入1 mL PBS和10 μL碘化丙啶染液(propidium iodide,PI)(1 mg/mL),避光静置20 min,然后8 000 r/min离心2 min,弃去上清液。最后加入1 mL PBS洗涤(8 000 r/min离心2 min),洗涤3 次后在荧光显微镜下观察细胞膜完整性并按式(2)计算PI染色率。

1.3.6细胞膜通透性的测定
1.3.6.1菌丝电导率的测定
参考文献[22]的方法并进行一定的修改。分别测定浓度为0(即对照组)、0.5、1.0、2.0 mmol/L DPA溶液的电导率;称取1 g 1.3.2节所得的菌丝,分别添加至10 mL上述浓度的DPA溶液中,室温下静置,测定处理0、0.5、1.0、1.5、2.0、2.5、3.0 h时相应的电导率。按式(3)计算菌丝电导率。
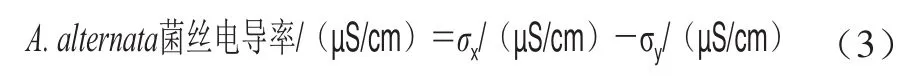
1.3.6.2核酸渗漏量的测定
参考文献[23]的方法并进行一定的修改。分别测定浓度为0(即对照组)、0.5、1.0、2.0、4.0 mmol/L DPA溶液在260 nm波长处的吸光度;称取1 g 1.3.2节所得的菌丝,分别加入到2 mL上述不同浓度的DPA溶液中,分别在室温下放置0、1、2、3、4 h取样,8 000 r/min离心5 min后收集上清液,测定260 nm波长处吸光度。按式(4)计算核酸渗漏量。

1.3.6.3蛋白质渗漏量测定
参考文献[24]的方法并进行一定的修改。分别测定浓度为0(即对照组)、0.5、1.0、2.0、4.0 mmol/L DPA溶液在280 nm波长处的吸光度;称取1 g 1.3.2节所得的菌丝,分别加入到2 mL上述不同浓度的DPA溶液中,分别在室温下放置0、1、2、3、4 h后取样,8 000 r/min离心5 min收集上清液,在280 nm波长处测定吸光度。按式(5)计算蛋白质渗漏量。

1.3.7细胞膜麦角甾醇质量浓度的测定
参照文献[25]的方法并稍作修改。菌丝的培养:分别配制含不同浓度(0(即对照组)、1.0、2.0 mmol/L)DPA的PDA培养基各100 mL,在培养基的中央分别接种2 μL 1.3.1节孢子悬浮液(浓度为1h10个/mL),28 ℃避光培养;培养至第5天,用已灭菌的取样勺轻轻刮取PDA培养基上的菌丝(尽量不要刮到培养基),将菌丝置于研钵中,加液氮研磨得到菌粉。麦角甾醇的提取:称取0.1 g研磨后的菌粉,加入3 mL 25%(质量分数)氢氧化钾-醇溶液(甲醇与乙醇体积比为3∶2),涡旋振荡1 min,然后85 ℃水浴1 h;室温冷却后加入1 mL无菌水和3 mL正戊烷涡旋振荡3 min,室温静置10 min,待其分层后吸取上清液,在真空离心浓缩仪中干燥,将干燥后的产物溶于1 mL甲醇(色谱纯)中,用0.45 μm孔径的滤膜过滤后置于1.5 mL进样瓶中,-20 ℃保存。采用高效液相色谱法测定麦角甾醇质量浓度,色谱柱为C柱(250 mmh4.6 mm,5 μm);流动相为100%甲醇(色谱纯);柱温为30 ℃;进样量为5 μL;流速为1 mL/min;紫外检测器检测;检测波长为282 nm。
1.3.8 丙二醛浓度的测定
参考文献[26]的方法并进行一定修改。称取0.1 g 1.3.2节制得菌丝于2 mL试管中,分别加入1.5 mL浓度为0(即对照组)、1.0、2.0 mmol/L的DPA溶液,分别在室温下处理2、4 h后,8 000 r/min离心5 min。取1 mL上清液,再加入1 mL硫代巴比妥酸试剂,沸水浴15 min,待冷却至室温后8 000 r/min离心5 min,分别测定上清液在450、532、600 nm波长处的吸光度、、。按式(6)计算丙二醛浓度。

1.4 数据统计与分析
数据采用Excel 2016软件处理,实验设置3个平行,结果以平均值±标准差表示,采用OriginPro 8.5软件作图,采用SPSS 26.0软件进行单因素方差分析。采用Duncan’s事后检验进行显著性分析,<0.05表示差异显著。
2 结果与分析
2.1 DPA处理对A.alternata生长的影响
2.1.1 DPA处理对菌落生长的影响
如图1所示,DPA处理能显著抑制菌落的生长(<0.05),且抑制效果随处理浓度的增加而增强。同时DPA处理使菌丝的颜色变浅(图1A)。2.0 mmol/L的DPA处理9 d后菌落直径仅为对照组的51.76%,当DPA浓度为4.0 mmol/L时,菌落生长完全受到抑制(图1B)。
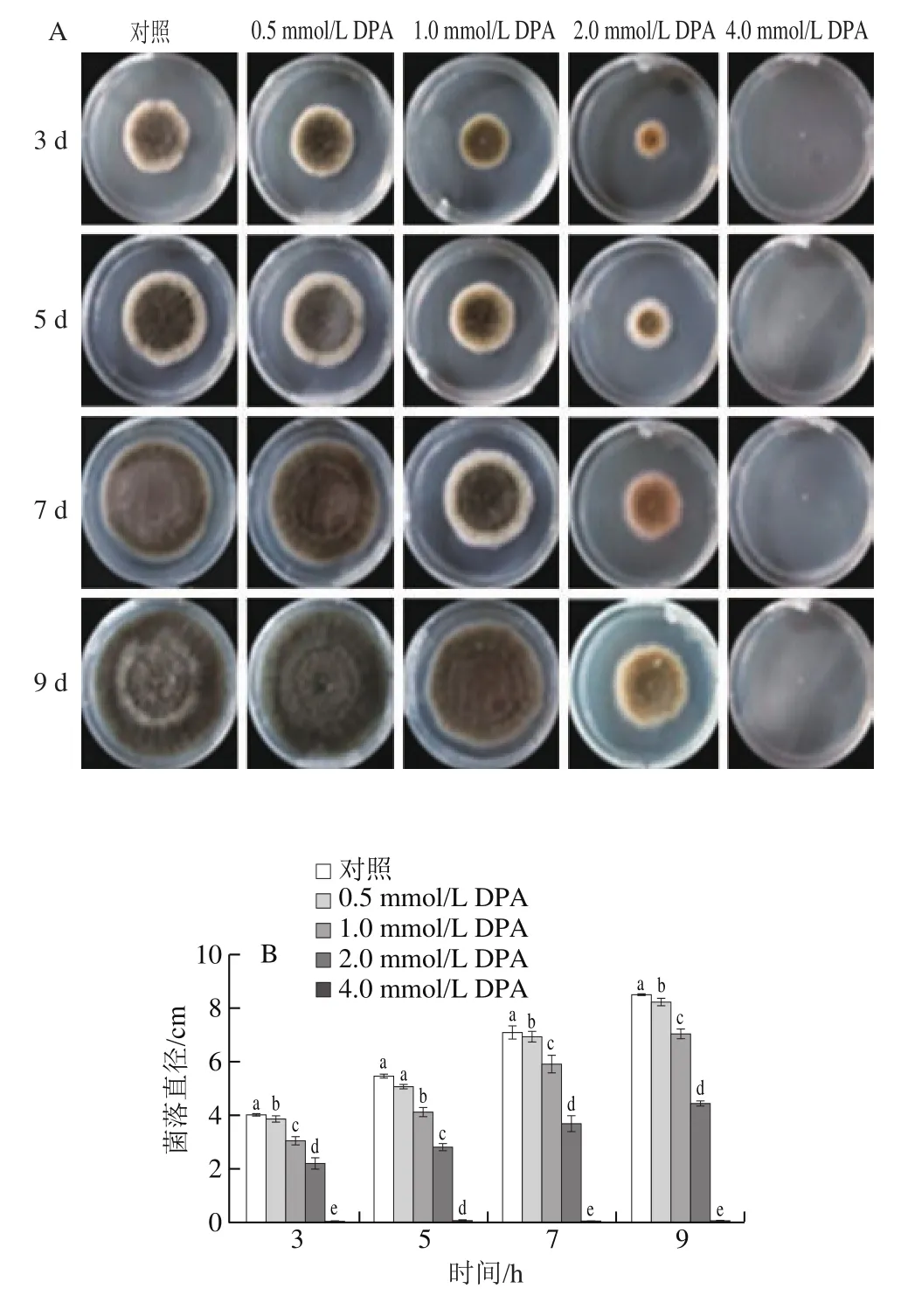
图1 DPA处理对A.alternata菌落形态(A)和菌落直径(B)的影响Fig.1 Effect of DPA treatment on mycelium morphology (A) and colony diameter (B) of A.alternata
2.1.2 DPA处理对孢子萌发、芽管伸长的影响
DPA处理能有效抑制的孢子萌发和芽管伸长(图2),且其抑制效果随处理浓度的增加而增强。培养6 h,对照组孢子萌发率达90%,芽管长度已达494.278 μm。而4.0 mmol/L DPA处理6 h后仅有27.67%的孢子萌发,芽管长度仅为121.657 μm。


图2 DPA处理对A.alternata孢子萌发率(A)和芽管长度(B)的影响Fig.2 Effect of DPA treatment on spore germination rate (A) and germ tube elongation (B) of A.alternata
2.2 DPA处理对早酥梨黑斑病的控制效果
DPA处理对早酥梨黑斑的扩展有抑制作用,且处理浓度越大抑制效果越佳(图3A)。但与在PDA平板上所用浓度不同,体内实验发现20.0 mmol/L DPA处理才能有效地控制早酥梨的黑斑病。处理前期(第3、5天),5.0 mmol/L DPA处理组与对照组病斑直径差异不显著。贮存至第11天时,对照组早酥梨病斑直径为4.06 cm,而20.0 mmol/L DPA处理组早酥梨病斑直径(2.24 cm)仅为对照组的55.17%(图3B)。

图3 DPA处理对早酥梨病斑外观(A)和病斑直径(B)的影响Fig.3 Effect of DPA treatment on the development of black spot disease (A) and lesion diameter (B) on Zaosu pear fruit
2.3 DPA处理对A.alternata细胞膜完整性的影响
为了进一步探索DPA潜在的抗真菌机理,用PI染液检测细胞膜完整性,PI是一种膜不可渗透的荧光染料,在荧光显微镜下,PI染料将失去膜完整性的细胞染为红色。对照组中仅有个别孢子细胞膜被破坏,发出微弱红光,而DPA处理组孢子随DPA浓度的增大红光逐渐增强(图4A)。4.0 mmol/L DPA处理组孢子PI染色率是对照组的8.78 倍(图4B)。
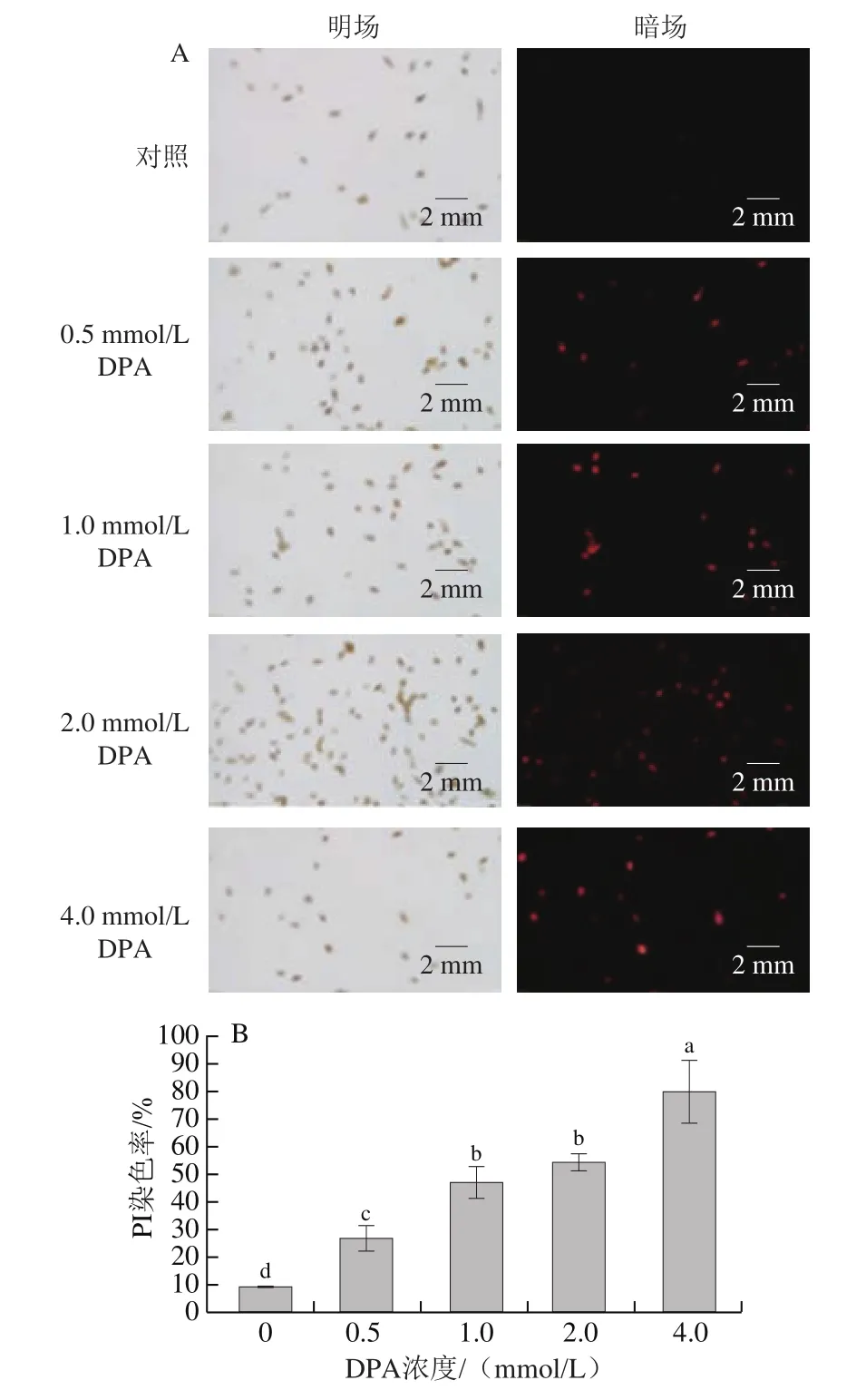
图4 DPA处理后PI染色检测A.alternata细胞膜完整性(A)和PI染色率(B)Fig.4 Cell membrane integrity (A) and propidium iodide (PI) staining percentage (B) of A.alternata after DPA treatment
2.4 DPA处理对A.alternata细胞膜透性的影响
2.4.1 对菌丝电导率的影响
如图5所示,电导率代表溶液中离子强度的大小,所以电导率的改变可以在一定程度上反映细胞膜透性的改变。DPA处理组菌丝电导率显著高于对照组(<0.05),且DPA处理浓度越大,菌丝电导率越大。在处理0.5 h内各处理组菌丝电导率均迅速上升,随后变化趋于平稳。处理3 h后,2.0 mmol/L DPA处理组菌丝体电导率为对照组的6.84 倍。

图5 DPA处理对A.alternata菌丝电导率的影响Fig.5 Effect of DPA treatment on membrane conductivity of A.alternata mycelia
2.4.2 对核酸渗漏量的影响
如图6所示,DPA处理组菌丝核酸渗漏量显著高于对照组(<0.05),且随着处理浓度增加以及处理时间的延长而增大。处理前1 h内,各处理组核酸渗漏量均迅速升高且差异显著,4.0 mmol/L DPA处理组菌丝核酸渗漏量为对照组的6.23 倍。1 h后各处理组核酸渗漏量缓慢上升,处理4 h时,4.0 mmol/L DPA处理组菌丝的核酸渗漏量为对照组的2.67 倍。
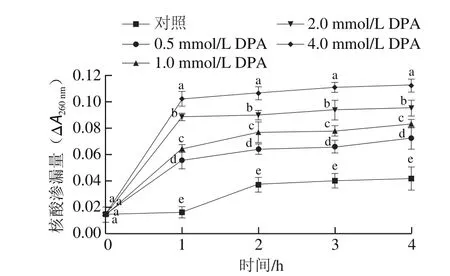
图6 DPA处理对A.alternata核酸渗漏量的影响Fig.6 Effect of DPA treatment on nucleic acid leakage from A.alternata
2.4.3 对蛋白质渗漏量的影响
如图7所示,DPA处理组菌丝蛋白质渗漏量显著高于对照组(<0.05),且DPA处理浓度越大蛋白质渗漏量越大。处理前1 h内,各处理组蛋白质渗漏量均迅速升高且差异显著,4.0 mmol/L DPA处理菌丝蛋白质渗漏量为对照组的32.06 倍。1 h后各处理组变化趋于平稳,处理4 h时,4.0 mmol/L DPA处理菌丝蛋白质渗漏量为对照组的8.99 倍。
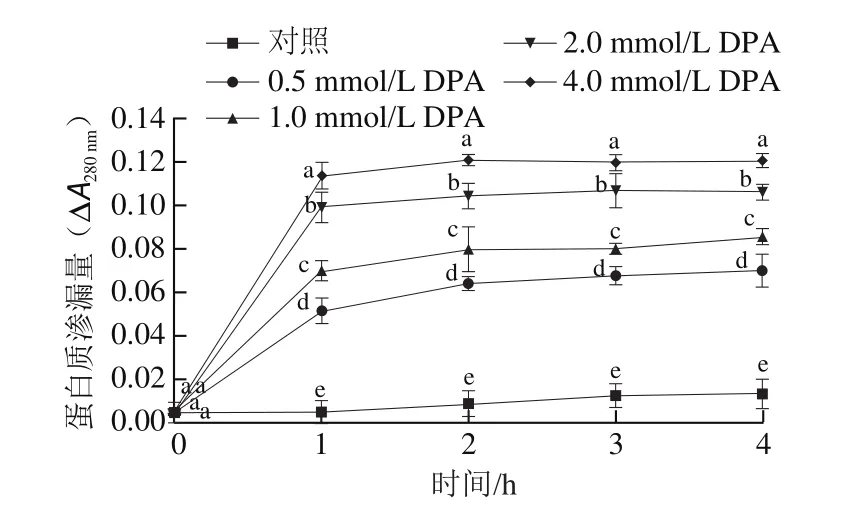
图7 DPA处理对A.alternata蛋白质渗漏量的影响Fig.7 Effect of DPA treatment on protein leakage from A.alternata
2.5 DPA处理对A.alternata细胞膜麦角甾醇质量浓度的影响
在真菌细胞膜中,麦角甾醇是必不可少的一种成分,其不仅确保了细胞膜结构完整性,而且在营养物质运输、保证细胞膜正常流动以及确保完成细胞内正常生理代谢活动等方面均有重要作用。一旦麦角甾醇不能正常合成,细胞膜结构和功能都会受到一定影响,从而会直接导致菌体死亡。如图8所示,随DPA处理浓度增加,菌丝的细胞膜麦角甾醇质量浓度显著降低。对照组菌丝细胞膜麦角甾醇质量浓度为39.90 μg/mL,而1.0、2.0 mmol/L的DPA处理组菌丝细胞膜麦角甾醇质量浓度显著降低(<0.05),分别为32.56、19.51 μg/mL。
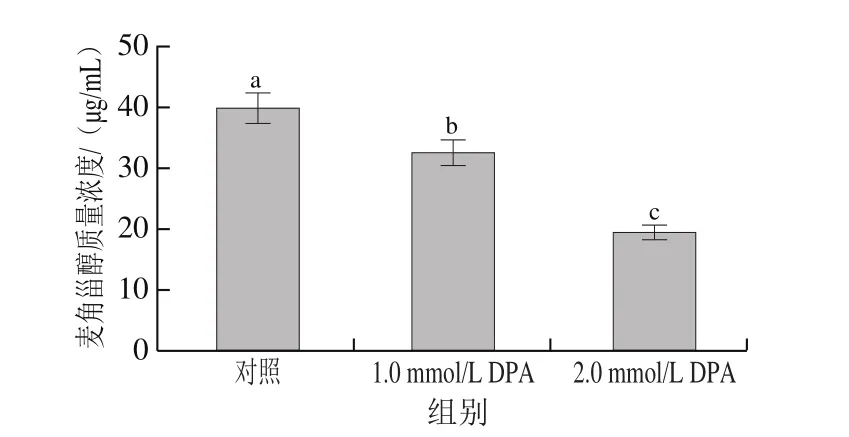
图8 DPA处理对A.alternata细胞膜麦角甾醇质量浓度的影响Fig.8 Effect of DPA treatment on ergosterol content in A.alternata cell membrane
2.6 DPA处理对A.alternata丙二醛浓度的影响
丙二醛浓度是反映膜脂过氧化程度的指标之一。DPA处理可以使丙二醛浓度增加(图9),并且随处理浓度增加以及处理时间的延长而增加。处理4 h时,2.0 mmol/L DPA处理组丙二醛浓度为对照组的1.32 倍。

图9 DPA处理对A.alternata丙二醛浓度的影响Fig.9 Effect of DPA treatment on malondialdehyde content in A.alternata
3 讨 论
生防菌枯草芽孢杆菌的许多代谢产物已被证实具有抗真菌活性。Wang Nana等在枯草芽孢杆菌E1R-J发酵液中发现代谢产物EP-2。EP-2作为一种抗真菌肽,在100 ℃高温30 min、pH 1.0~8.0范围内,或在金属离子(如Cu、Zn、Mg)存在条件下表现出稳定的抗真菌活性,同时还发现EP-2可通过引起菌丝肿胀、扭曲、异常及原生质体外渗来抑制的生长,从而有效控制苹果的腐烂病。刘刚等在枯草芽孢杆菌Loq18的代谢产物中纯化出一种新型抗菌蛋白,该抗菌蛋白会使灰葡萄孢菌丝断裂或畸形,同时抑制孢子萌发。体内实验表明当对照组果实腐烂率达到100%时,经抗菌蛋白处理组草莓和葡萄果实的腐烂率分别为60.33%和45.33%。刘双等将草莓根腐病菌C16-4用枯草芽孢杆菌T4-4、S-30和S-11菌株和代谢产物进行相应处理,结果表明处理组病菌分生孢子的产生与萌发受到了抑制。另外,通过扫描电子显微镜还观察到处理组菌丝细胞壁表面粗糙,出现细胞膨大、扭曲等畸形现象。DPA是枯草芽孢杆菌菌株中168的分泌物,为探究DPA抑菌效果及机理,Song Xuege等通过扫描电子显微镜观察发现,在没有DPA的情况下,细胞呈圆形形态;而当经5 mmol/L DPA处理24 h后,细胞膜上产生孔,说明DPA通过破坏真菌细胞膜从而导致细胞凋亡。另外,实验研究发现3.0 mmol/L DPA处理减少了分生孢子的数量,但仍有部分孢子萌发,而5.0 mmol/L的DPA在pH 5.6的环境下时,可完全抑制的菌落生长和孢子萌发。同样本实验发现4.0 mmol/L DPA处理完全抑制了的菌落生长,且抑制了孢子萌发和芽管伸长,表明不同病原真菌对DPA的敏感性存在差异,但体内实验发现20.0 mmol/L DPA处理才能有效地控制早酥梨的黑斑病,这可能是果实表皮组织对药物作用的影响,因此需进一步优化和规范DPA的采后处理方法,提高药物的作用效果。
为进一步探讨DPA对的抑菌机制,本实验用PI染液测定了细胞膜的完整性,PI染液可以通过受损的细胞膜进入细胞内部,与胞内核酸等物质结合,使其发出红光。PI染色结果表明DPA处理组PI染色率远高于对照组,说明DPA破坏了细胞膜的完整性。一些吡啶类环状化合物也有类似破坏细胞膜的抑菌机理,如氟啶酰菌胺能够与病原菌的细胞膜和细胞骨架间特异性蛋白结合,导致细胞结构被破坏,进而表现出杀菌活性。同时DPA处理组菌丝电导率、核酸和蛋白质的外渗量均显著增加,表明DPA处理提高了细胞膜的通透性,造成细胞膜跨膜电势紊乱,导致离子外流,致使电导率提高。这与枯草芽孢杆菌21代谢物引起大豆茄镰孢菌菌液电导率升高,显示出膜透性改变这一相似结果。同时胞内一些物质如核酸、蛋白质等也因细胞膜通透性增加而外流,使一定波长处的吸光度增大。麦角甾醇是真菌细胞膜重要组成部分,其能保证细胞膜流动性、细胞活力以及营养物质的正常运输,结果表明,DPA处理导致细胞膜麦角甾醇质量浓度显著降低,这也是其导致细胞膜通透性增加的原因。DPA抑制细胞膜上麦角甾醇合成可能是因其具有杂环结构。赵圣印等研究发现杂环上的氮原子可通过形成配位键与甾醇14-脱甲基酶P450的血红素-铁活性中心连接,酶的活性受到抑制。而该酶又正是合成麦角甾醇的关键酶,当它活性受到抑制后,麦角甾醇将不能正常地合成,病原菌细胞膜完整性遭到破坏,不能进行正常生命活动,从而导致病原菌死亡。同时本研究还发现DPA处理可促使膜脂发生过氧化,丙二醛浓度增加,引起细胞膜氧化损伤,从而抑制了病原菌的生长。另外Song Xuege等研究还发现3.0 mmol/L的DPA处理3 d后会抑制细胞壁中几丁质的合成,表明DPA对真菌细胞壁也具有一定的影响,可见DPA的抑菌机理具有复杂性和多样性,具体作用机理有待进一步揭示。
综上,DPA处理可以有效抑制的菌落生长、孢子萌发和芽管伸长,且能有效控制早酥梨黑斑病的扩展,其作用效果存在浓度依赖性。进一步研究表明DPA可通过破坏细胞膜的完整性、提高膜通透性、抑制膜组分麦角甾醇的合成和促使膜质氧化进而显著抑制的生长。

