枸杞粉及其多糖对环磷酰胺致免疫低下小鼠免疫及肠道菌群的调节作用
罗 青,禄 璐,*,闫亚美,米 佳,李晓莺,曹有龙,曾晓雄*
(1.国家枸杞工程技术研究中心,宁夏 银川 750002;2.南京农业大学食品科学技术学院,江苏 南京 210018)
枸杞(L.)系茄科枸杞属落叶灌木,是我国传统的药食两用资源,富含多糖、类胡萝卜素、酚胺类物质及多种微量元素,在抗氧化、抑制肿瘤细胞增殖、提高免疫力、预防神经损伤等方面均有较好效果。目前研究表明,枸杞在调节肠道菌群方面也具有积极作用。枸杞子粉对双歧杆菌和乳酸杆菌等益生菌株有促进作用,且益生元效应与枸杞多糖(L.polysaccharides,LBP)、多酚含量密切相关。LBP能够促进细胞因子上调,修护肝损伤,同时促进小鼠与免疫相关的有益菌群相对丰度增加,从而调节小鼠肠道菌群。
近年来,肠道菌群对宿主免疫系统的重要贡献已经引起了广泛的关注。肠道菌群失衡与炎症反应密切相关,并通过刺激免疫反应和保持上皮屏障来维持体内平衡,因此,肠道菌群稳态对免疫系统和肠道的发育和维持有重要作用。植物多糖可改善B和T巨噬细胞、淋巴细胞和树突状细胞的增殖功能,提高白细胞吞噬能力,抑制脾组织细胞凋亡,促进脾组织白细胞介素(interleukin-1β,IL-1β)基因表达,从而增强机体非特异性免疫功能,同时促进消化酶活性,调节肠道菌群组成、维护肠道微生态健康。但枸杞喷雾干燥粉作为普通食品单一食用或与LBP复配作为功能性食品对机体免疫系统及肠道菌群的调节作用研究鲜有报道。
环磷酰胺(cyclophosphamide,CTX)作为目前世界范围内应用最为广泛的抗肿瘤药物及免疫抑制剂,在杀伤肿瘤细胞的同时也会破坏机体正常的免疫细胞,启动炎症与抗炎反应,同时常伴有胃肠道不良反应。研究表明,CTX可以改变肠道菌群的组成,多糖则可调节被CTX影响的肠道菌群的组成,从而调节宿主免疫。
本研究以CTX致免疫低下的小鼠为模型,探寻枸杞粉(L.powder,LB)、LBP及其复配物对小鼠免疫力及肠道菌群稳态的影响,为枸杞喷雾干燥粉、LBP及其复配物作为功能性食品等多用途的开发利用提供理论依据。
1 材料与方法
1.1 动物、材料与试剂
实验动物均为BALB/c雄性小鼠,4 周龄,体质量(20.0f0.5)g,购自南京青龙山动物设施公司。实验动物均符合南京动物护理和使用委员会的指导方针,小鼠饲养于SPF级的动物房内(温度24~25℃、相对湿度70%~75%,照明方案为12 h/12 h光暗循环),由高压灭菌处理的饮用水和饲料进行喂养。
LB由国家枸杞工程技术研究中心自制(中国银川),利用枸杞鲜果经清洗、打浆、均质、喷雾干燥获得,经检测多糖质量分数为24.3%;LBP(食品级)购自宁夏沃福百瑞枸杞产业股份有限公司,经检测多糖质量分数为47.8%;根据前期实验,LB与LBP复配按照2∶1(/)混合均匀,获得复配物(LB+LBP)。
盐酸左旋咪唑(levamisole hydrochloride,LH)、CTX 上海瑞恩生物技术有限公司;血清中肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)试剂盒、IL-1β ELISA试剂盒、干扰素γ(interferon-γ,IFN-γ)ELISA试剂盒、免疫球蛋白A(immunoglobulin A,IgA)ELISA试剂盒 深圳欣博盛科技有限公司;TIANamp Stool DNA提取试剂盒 北京天根生物科技有限公司;MiniBEST universal RNA提取试剂盒、PrimeScript RT master mix反转录试剂盒 TaKaRa生物工程有限公司;其他分析纯试剂购自上海阿拉丁化学试剂有限公司。
1.2 仪器与设备
6890N气相色谱仪、火焰离子化检测器、HP-INNOWAX毛细管柱(30 mh0.25 mmh0.25 μm) 美国Agilent公司;QuantStudio 6荧光定量聚合酶链反应(polymerase chain reaction,PCR)仪、NanoDrop 2000超微量分光光度计 美国Thermo Fisher公司。
1.3 方法
1.3.1 小鼠处理与分组
将60只小鼠随机分为6 组(=10),自由饮水饮食适应性饲养一周。除了正常对照(NC)组的10只小鼠不作处理,其他组小鼠在第8、9、10天腹腔内注射80 mg/(kggd)的CTX,建立CTX诱导的免疫抑制模型,枸杞喷雾干燥粉组(LB)、LBP组、LB与LBP复配(LB+LBP)组及LH组(作为阳性对照)第11~20天按表1每日进行灌胃处理。实验期间每日观察干预后小鼠的神志、精神、食欲、活动等体征,每2 d测定一次体质量以及食物消耗量(即采食量),计算体质量增长比和采食量,并于第21天早上股动脉采血,收集血样后,用颈椎脱位法处死小鼠,血液经3 000 r/min离心15 min(4 ℃)后收集血清于4 ℃冰箱存放。收集肝脏、盲肠内容物、结肠和粪便在无菌离心管中,并在-80 ℃下保存备用。实验期间小鼠饲养采取自由摄食、饮水的原则,并保持自然光照和笼内卫生清洁。
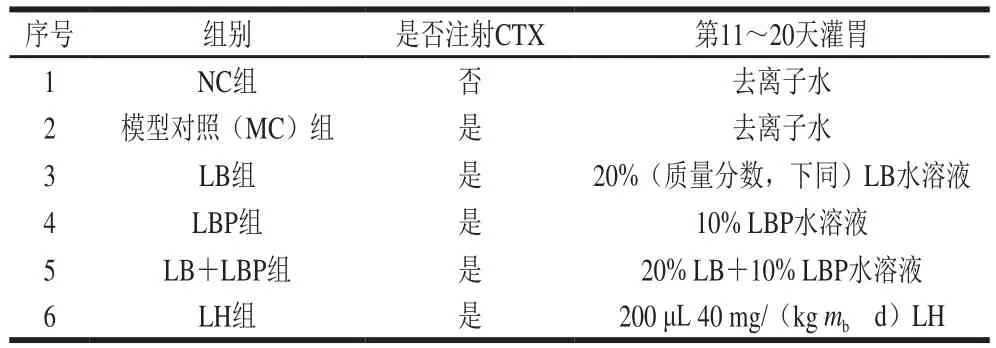
表1 实验分组及灌胃处理Table 1 Experimental grouping and intragastrical administration
1.3.2 体质量增长比的测定
体质量增长比通过式(1)计算。

式中:为上次体质量/g;为本次所测体质量/g。
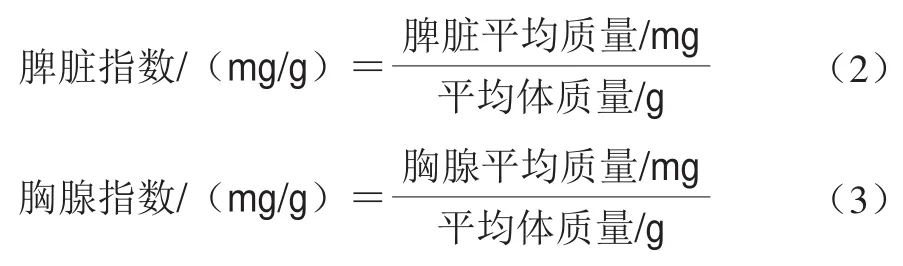
1.3.3 脏器指数的测定
胸腺和脾脏采集后称质量,按以下公式(2)~(3)计算小鼠脾脏指数与胸腺指数。
1.3.4 血清细胞因子质量浓度测定
股动脉采血,3 000 r/min离心15 min(4 ℃)制备血清,即获得淋巴细胞悬液,每孔加7.5h10个/mL的淋巴细胞悬液1 mL和刺激原质量浓度4 μg/mL刀豆蛋白A(concanavalin A,Con A)稀释液1 mL,置于37 ℃、5% CO细胞培养箱内培养72 h,2 500 r/min离心5 min,收集细胞上清液(血清)。按试剂盒说明书操作,采用ELISA法测定小鼠血清IL-1β、TNF-α、IFN-γ及IgA质量浓度。
1.3.5 结肠组织形态学分析
将结肠用10%福尔马林溶液固定,石蜡包埋。石蜡切片(厚度5 μm)用苏木精-伊红(hematoxylin-eosin,HE)染色。结肠组织经脱水、包埋、切片及HE染色处理后,在光学显微镜下观察组织病理情况,并采集图像。
1.3.6 结肠组织RNA提取及实时定量PCR分析
采用MiniBEST universal RNA提取试剂盒,从20 mg结肠样本中提取总RNA,检测RNA的浓度和纯度。随后,使用反转录试剂将500 ng的RNA通过反转录合成cDNA(37 ℃反转录反应15 min后,85 ℃反应5 s使反转录酶失活),-80 ℃储存。准备10 μL的反应体系(1 μL引物、4 μL的cDNA和5 μL的SYBR Green Fast Mix试剂),使用QuantStudio 6荧光定量PCR仪进行扩增,以甘油醛-3-磷酸脱氢酶基因作为内参,目标基因(、、、、、、、和)的相对表达量采用2计算。
1.3.7 盲肠内容物和粪便中短链脂肪酸含量的测定
取50 mg盲肠内容物或粪便与250 μL去离子水混合,以0.2 mol/L盐酸配制浓度为25 mmol/L的2-乙基丁酸溶液作为内标,将150 μL的盲肠内容物浆液与150 μL的内标溶液混合后,8 000 r/min离心5 min,取上清过膜备用。参照Ding Yu等方法,利用气相色谱法测定短链脂肪酸(short-chain fatty acids,SCFAs)的含量。
1.3.8 肠道菌群分析
采用高通量测序技术分析LB及LBP对小鼠肠道菌群的影响。根据DNA提取试剂盒说明书提取小鼠粪便样品的基因组DNA,所有DNA样品干冰储存并运送到杭州联川生物科技有限公司进行测序工作。使用的引物扩增引物序列为Primer F:341F(5’-CCTACGGGNGGCWGCAG-3’)及Primer R:805R(5’-GACTACHVGGGTATCTAATCC-3’),对16S rDNA(V3+V4)可变区进行PCR。根据双端序列的重叠区,将R1、R2序列拼接成长的标签序列,并使用cutadapter软件去除小段序列以及引物序列。然后过滤低质量序列,采用Vsearch(v2.3.4)软件过滤嵌合体。使用DADA2算法进行降噪后,得到特征表和特征序列,分析肠道菌群多样性、多样性及组成。
1.4 数据处理与分析
采用IBM SPSS Statistics 25软件进行统计分析,实验结果表示为平均值±标准差表示。采用单因素方差分析(ANOVA)和邓肯检验进行显著性差异分析,<0.05表示差异显著。在肠道菌群分析中,多样性和多样性通过抽平(将所有样本的序列数抽取至最少序列样本的序列数)的方式来进行归一化,物种注释使用相对丰度来进行归一化处理,由R(v3.5.2)软件包绘制图形。物种注释采用QIIME2ruNJINO的插件featureclassifier进行序列比对,比对数据库为SILVA和NT-16S数据库,以SILVA数据库注释结果为准。采用Tukey HSD检验计算两组间相对丰度的差异(<0.05)。利用PICRUSt软件分析来解释京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)代谢通路,采用STAMP(v2.1.3)软件通过Welsh’s检验(<0.05)对差异KEGG代谢通路进行统计分析。
2 结果与分析
2.1 不同处理对小鼠体质量和采食量的影响
如图1所示,MC组小鼠在用CTX处理后,体质量和日采食量均明显下降,说明造模成功。第9天后,MC组的小鼠体质量和日采食量呈现逐渐恢复的趋势,但增长缓慢,而LB、LBP及LB+LBP组,小鼠体质量和采食量逐渐趋于NC组和LH组,说明LB、LBP及复配物均可较好地恢复小鼠体质量和采食量,LBP和LB+LBP干预,比LB干预更能有效地恢复小鼠的体质量。Xia Hui等研究表明服用LBP对健康成年男性的体质量及体质量指数并无显著影响,但可显著降低血清甘油三酯和高密度脂蛋白指数。因此,推测可能是通过LBP提高机体免疫力从而恢复采食量和体质量。
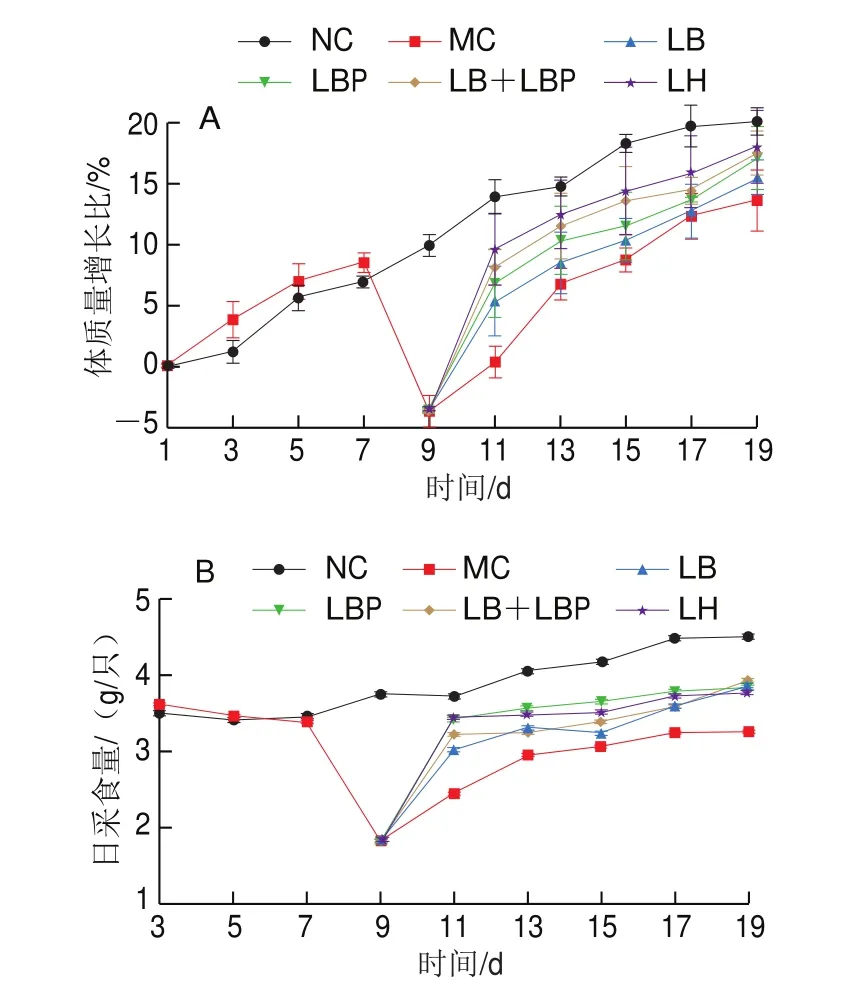
图1 LB、LBP和LB+LBP处理对小鼠体质量(A)和日采食量(B)的影响Fig.1 Effects of LB, LBP and LB + LBP on body mass (A) and feed intake (B) of mice
2.2 不同处理对小鼠免疫器官指数的影响
胸腺和脾脏是机体的主要免疫器官,其质量的改变可以反映受试药物对免疫系统的刺激作用,因此,胸腺和脾脏指数被认为是反映免疫功能的重要指标。由图2可知,与NC组相比,MC组的胸腺指数和脾脏指数均显著下降(<0.05),说明CTX可以诱导小鼠免疫低下。与MC组比较,LB、LBP和LB+LBP组的小鼠脾脏指数和胸腺指数显著升高(<0.05),说明LB、LBP和LB+LBP混合干预均对CTX所致的小鼠脾脏、胸腺损伤有一定的改善作用。与LB干预相比,LBP和LB+LBP混合干预能更有效地改善小鼠脾脏和胸腺损伤,且与NC组相比无显著性差异(>0.05)。其中LB+LBP组对小鼠脾脏损伤的恢复效果比LBP组好,但对于胸腺指数,LB组和LB+LBP组之间没有显著差异(>0.05)。
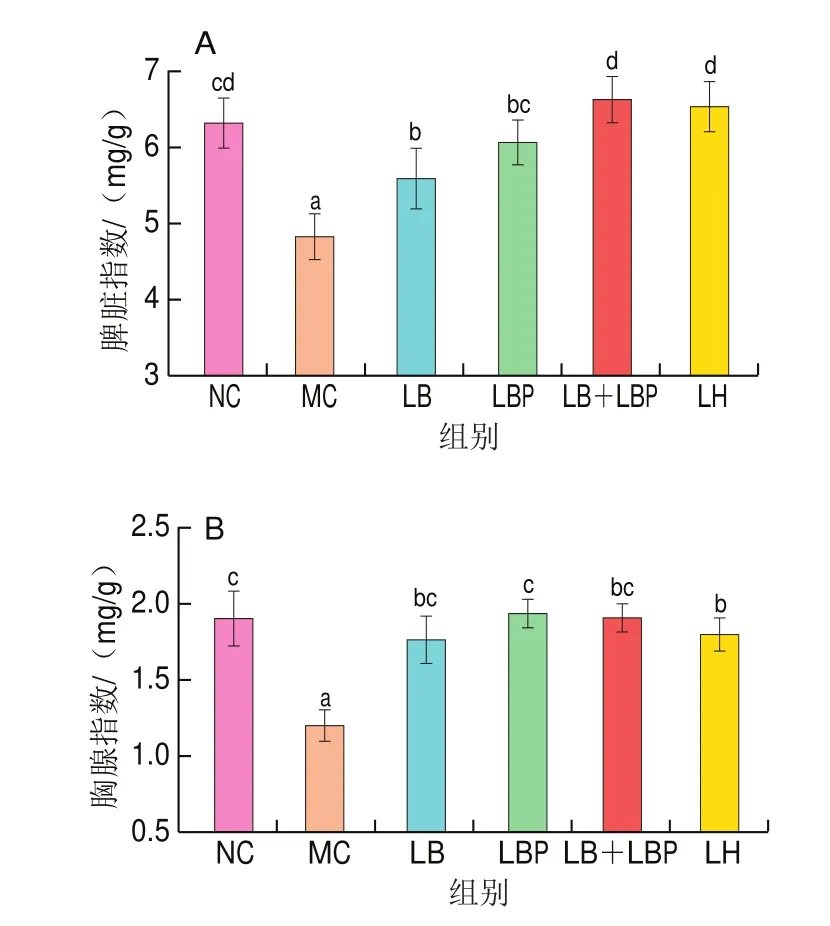
图2 LB、LBP和LBLBP处理对小鼠脾脏指数(A)和胸腺指数(B)的影响Fig.2 Effects of LB, LBP and LB + LBP on spleen index (A) and thymus index (B) of mice
2.3 不同处理对小鼠血清中细胞因子和IgA产生量的影响
细胞因子大多是一些小分子可溶性蛋白质,通过刺激免疫细胞及某些非免疫细胞合成释放,可以直接参与多种免疫功能。此外,研究表明巨噬细胞可通过各种受体与多糖或糖蛋白结合,从而分泌细胞因子如IL-1β和TNF-α以杀死肿瘤细胞。通常CTX的诱导可导致小鼠体内白细胞比例失衡,增加中性粒细胞、单核细胞及嗜酸性粒细胞比例,减少淋巴细胞比例。如图3所示,与NC组相比,MC组小鼠血清中细胞因子TNF-α、IL-1β、IFN-γ和免疫球蛋白IgA的质量浓度显著下降(<0.05);与MC组比较,LB、LBP、LB+LBP组小鼠血清中TNF-α、IFN-γ、IL-1β和IgA质量浓度均显著上调(<0.05),与Ding Yu等发现利用LBP可促进免疫低下小鼠细胞因子分泌的结果一致。本实验结果表明,LB、LBP及LB+LBP均可促进CTX致免疫抑制型小鼠分泌细胞因子,从而增强小鼠非特异性免疫应答。还有学者通过将枸杞与脱脂乳均质添加在小鼠的日常饮食中来促进小鼠T细胞增殖,从而提高小鼠免疫应答,降低流感感染率。
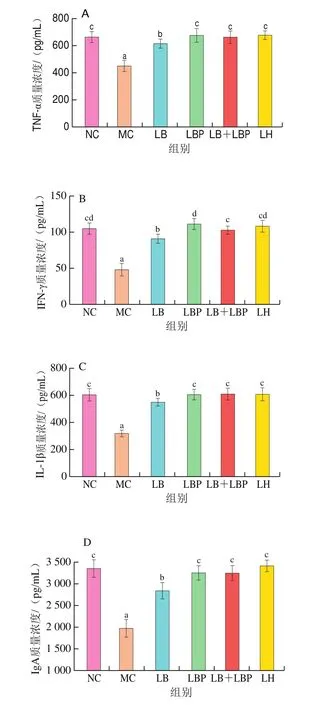
图3 LB、LBP和LBLBP处理对血清中细胞因子TNF-α(A)、IFN-γ(B)、IL-1β(C)和IgA(D)质量浓度的影响Fig.3 Effects of LB, LBP and LB + LBP on serum levels of TNF-α(A),IFN-γ (B), IL-1β (C) and IgA (D)
2.4 不同处理对小鼠结肠组织的影响
光学显微镜下小鼠结肠组织形态如图4所示。NC组小鼠结肠组织具有完整的结肠黏膜、隐窝、皱褶,且结构整齐,排列紧密。而MC组结肠黏膜损伤较严重,伴有隐窝增生、上皮细胞损伤和基底淋巴聚集现象。而通过LB、LBP、LB+LBP和LH的干预,结肠组织形态恢复较好,几乎接近NC组,且LBP和LB+LBP组杯状细胞数量明显增加,杯状细胞可促进分泌黏蛋白,形成黏膜屏障。因此,LB、LBP和LB+LBP干预可明显改善CTX诱导的结肠组织损伤,进而改善肠道屏障功能。
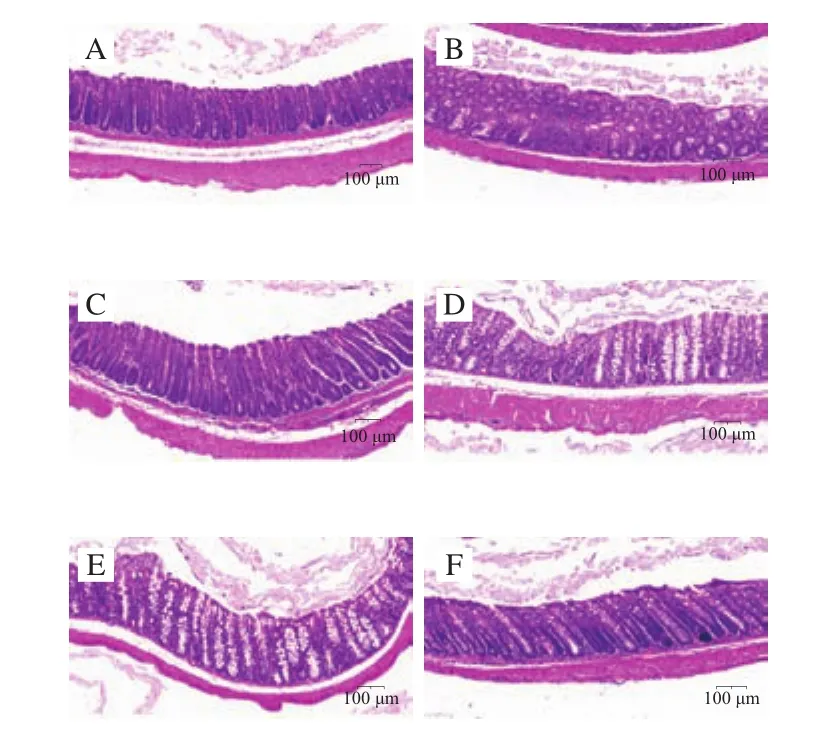
图4 LB、LBP和LBLBP处理组小鼠结肠组织病理学观察(×20)Fig.4 Histopathological observation of colon sections of mice treated with LB, LBP and LB + LBP (× 20)
2.5 不同处理对小鼠结肠相关基因表达的影响
如图5所示,与NC组相比,CTX可显著降低结肠中、、、、、、和的表达水平(<0.05)。与MC组相比,LB干预显著提高了结肠中细胞因子的表达量(<0.05),LBP干预显著提高了、及SCFAs受体的表达量(<0.05);LB+LBP干预显著提高了、、和的表达量;LH干预显著提高了、、、、的表达量。紧密连接蛋白和表达水平的降低与屏障功能障碍和肠上皮细胞旁通透性的增加密切相关,对维持肠道屏障功能具有重要作用。MUC2是一种黏蛋白,由结肠杯状细胞产生,在细菌攻击时可保护宿主组织免于暴露。以上结果表明,LBP作为枸杞中的重要的活性成分比LB更有效提高结肠中上述基因的表达,且LB+LBP混合干预对、、和的提高作用优于单独LBP干预,推测LB和LBP在提高结肠相关基因表达方面可能存在协同效应。
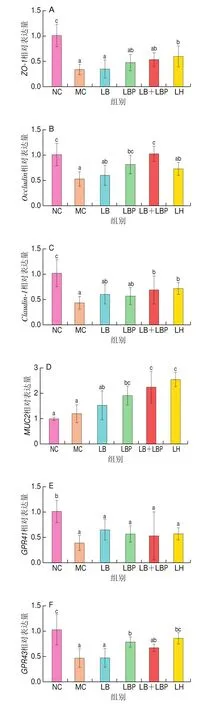

图5 LB、LBP和LBLBP处理对小鼠结肠中基因ZO-1(A)、Occludin(B)、Claudin-1(C)、MUC2(D)、GPR41(E)、GPR43(F)、TNF-α(G)、IFN-γ(H)和IL-6(I)相对表达量的影响Fig.5 Effects of LB, LBP and LB + LBP on relative expression levels of ZO-1 (A), Occludin (B), Claudin-1 (C), MUC2 (D), GPR41 (E), GPR43 (F),TNF-α (G), IFN-γ (H) and IL-6 (I) in the colon of mice
2.6 不同处理对小鼠盲肠内容物和粪便中SCFAs的影响
SCFAs是肠道菌群的主要代谢产物,在维持肠道正常功能和结肠上皮细胞的形态和功能方面发挥着重要的作用。如表2所示,与NC组相比,MC组的盲肠内容物和粪便中SCFAs的含量均明显下降。与MC组相比,LB、LBP、LB+LBP和LH干预后,小鼠盲肠内容物和粪便中SCFAs含量得到了不同程度的提高。与MC组相比,LB干预整体上显著提高了盲肠内容物和粪便中各SCFAs和总SCFAs含量(<0.05);LBP干预显著提高了盲肠内容物中丙酸、正丁酸、正戊酸和异戊酸的含量以及粪便中乙酸、丙酸、正丁酸、正戊酸、异戊酸和总SCFAs的含量(<0.05);LB+LBP干预显著提高了盲肠内容物中丙酸、正丁酸、正戊酸和异戊酸的含量以及粪便中丙酸、正戊酸、异戊酸和总SCFAs的含量(<0.05),因此,LB对促进小鼠肠道菌群代谢具有显著的积极作用。研究表明,SCFAs可以在各种细胞途径中充当信号分子,乙酸、丙酸和丁酸与SCFAs受体GPR41、GPR43和GPR109A密切相关,GPR41和GPR43可激活上皮细胞的细胞外信号调节激酶1/2和p38促分裂原活化蛋白激酶信号通路,促进趋化因子和细胞因子的产生。因此,LB、LBP、LB+LBP可能通过激活免疫相关途径从而促进肠道菌群产生SCFAs。
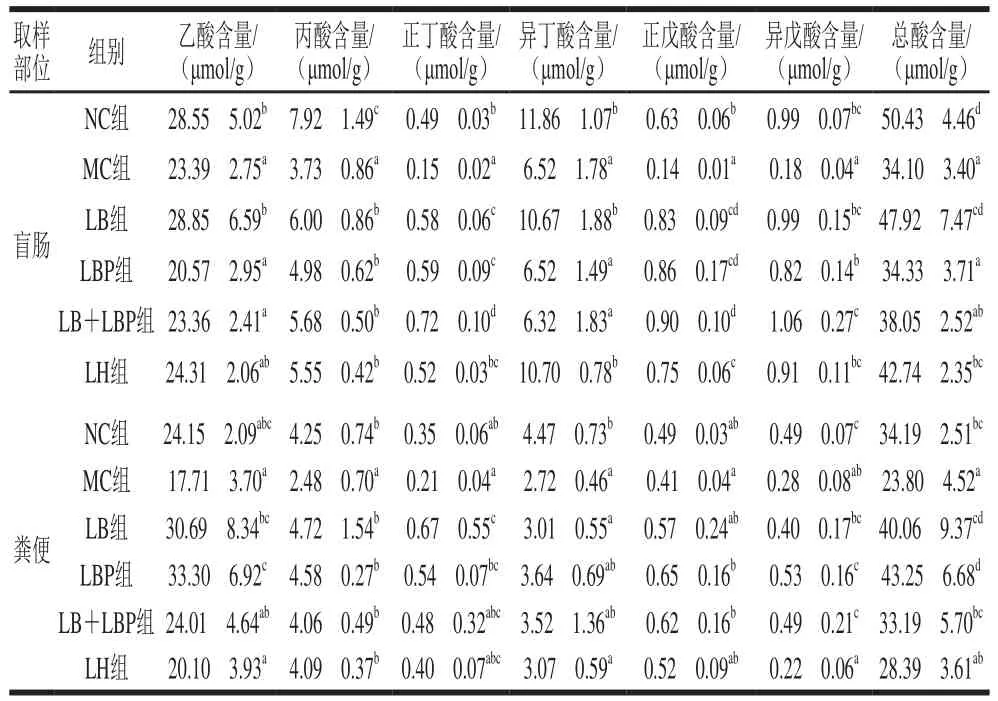
表2 小鼠盲肠和粪便中SCFAs含量Table 2 Effects of LB, LBP and LB + LBP on contents of SCFAs in cecum and feces of mice
2.7 不同处理对CTX诱导小鼠肠道菌群的调节作用
2.7.1 肠道菌群多样性分析
多样性指数可评估肠道菌群的丰富性和多样性。如图6A~C所示,与NC组相比,MC组中Chao1指数显著降低(<0.05),而与MC组相比,除了LB组的Simpson指数不存在显著差异外,LB、LBP组和LB+LBP组的Chao1、Shannon指数和Simpson指数均显著升高(<0.05),说明LB、LBP和LB+LBP处理均可提高肠道菌群多样性。多样性可度量不同样本间菌群组成的相似度。如图6D、E所示,MC组肠道菌群组成与其他各组存在明显差异,说明CTX诱导免疫抑制小鼠,其肠道菌群组成发生了明显变化,NC、LB、LBP、LB+LBP和LH组样本间的距离相近,表明通过LB、LBP和LB+LBP干预可促进免疫抑制小鼠肠道菌群恢复正常。
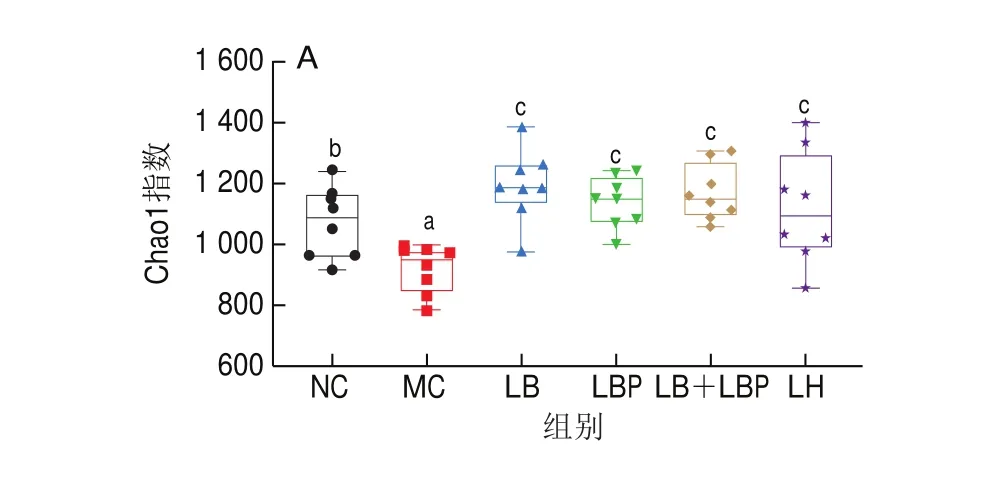
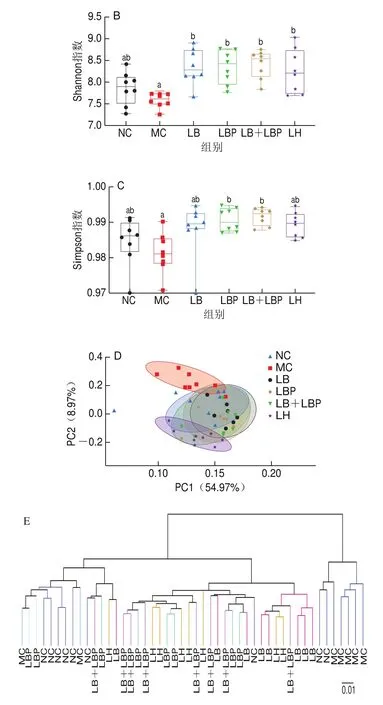
图6 小鼠肠道菌群α多样性和β多样性分析Fig.6 Alpha-diversity index and β-diversity index analysis of gut microbiota
2.7.2 小鼠肠道菌群组成分析
如图7所示,所有组的小鼠肠道菌群主要由拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)组成,占菌落总数的90%以上,其次是-变形菌门(Epsilonbacteraeota)和变形菌门(Proteobacteria)。与MC组相比,LB、LBP和LB+LBP干预能够显著增加Bacteroidetes相对丰度(<0.05),同时显著减少Firmicutes、Epsilonbacteraeota和Proteobacteria的相对丰度(<0.05),与Ding Yu、聂启兴、Tian Baoming、Huang Kaiyin等的研究结果一致,表明LB、LBP、LB+LBP干预可显著降低Firmicutes/Bacteroidetes(F/B)比例。LBP可能是降低F/B比例的主要功效成分。
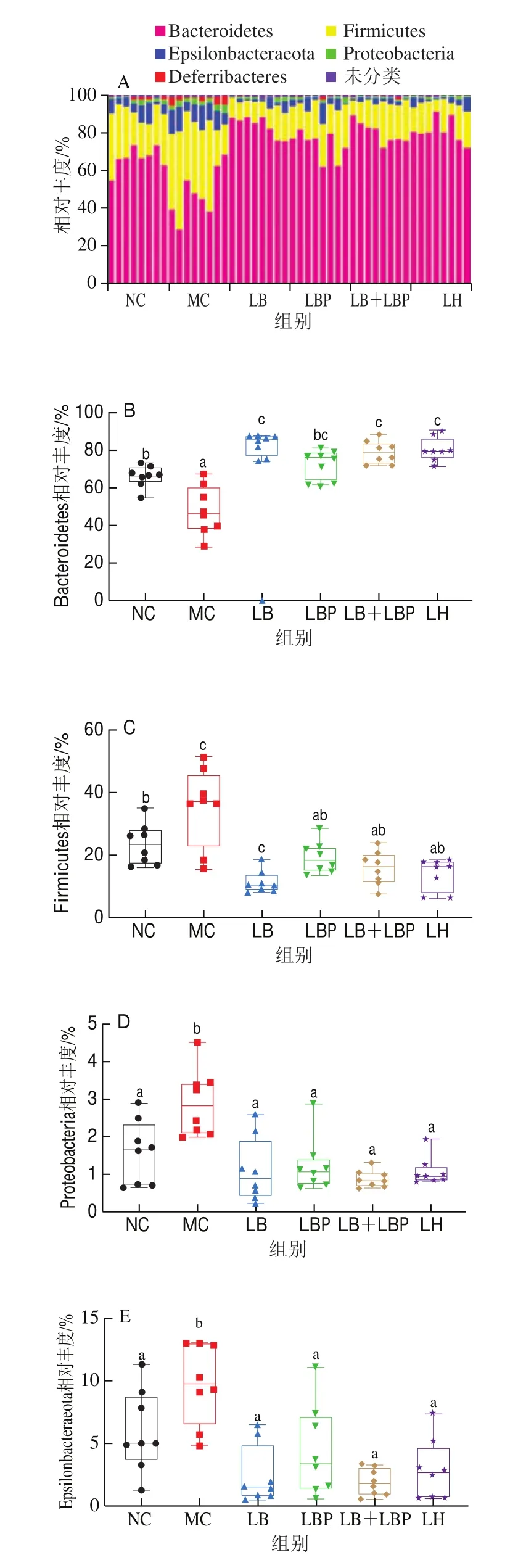
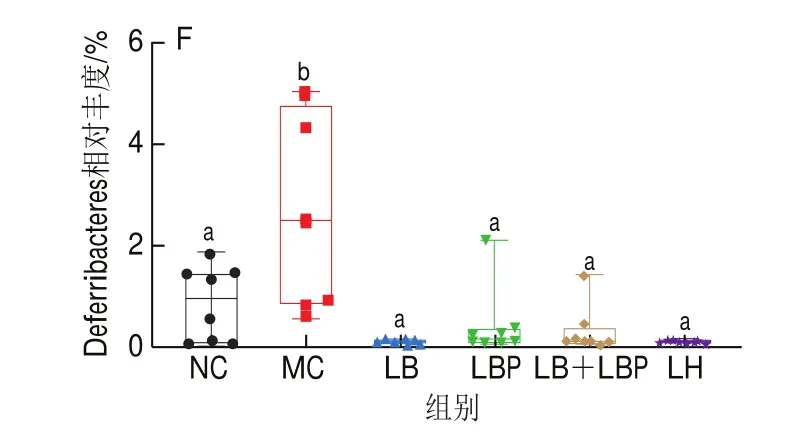
图7 小鼠肠道菌群门水平上的相对丰度分布和主要门的相对丰度Fig.7 Relative abundance of gut microbiota at phylum level and relative abundance of major phyla
在科水平上,检测出小鼠的肠道菌群主要由12个菌科组成,如图8A所示,其中Muribaculaceae的相对丰度最高。与NC组相比,MC组小鼠肠道菌群中Muribaculaceae和Prevotellaceae的相对丰度显著降低(<0.05),Lachnospiraceae、Helicobacteraceae、Ruminococcaceae、Clostridiales_unclaasified、Desulfovibrionaceae、Deferribacteraceae的相对丰度显著增加(<0.05)。与MC组相比,LB、LBP、LB+LBP及LH干预后可显著增加Muribaculaceae的相对丰度(<0.05),略增加Prevotellaceae的相对丰度,同时显著抑制Lachnospiraceae、Helicobacteraceae、Ruminococcaceae、Clostridiales_unclaasified(除LBP组)、Desulfovibrionaceae、Deferribacteraceae相对丰度(<0.05)(图8B~I)。目前研究认为,Prevotellaceae是肠道内促SCFAs产生的菌属,也是肠道微生物水解膳食纤维的关键成员,其相对丰度与TGF-β3有关,而TGF-β3是一种能调节肠道屏障功能的细胞因子,对于肠道菌群的健康恢复具有重要作用。Desulfovibrionaceae可产生细胞毒性化合物硫化氢,破坏肠上皮细胞并诱导黏膜启动炎症反应。Huang Kaiyin等采用CTX诱导小鼠结肠炎模型致使小鼠结肠内Muribaculaceae、Saccharimonadaceae、Peptococcaceae相对丰度下调,而Rikenellaceae、Lactobacillaceae、Helicobacteraceae、Bacteroidaceae、Marinifilaceae、Deferribacteraceae、Tannerellaceae、Enterobacteriaceae、Streptococcaceae的相对丰度均上调;Ding Yu等通过LBP的干预也可显著提高CTX诱导的小鼠肠道中Lachnospiraceae、Ruminococcaceae、Deferribacteraceae、Desulfovibrionaceae、Anaeroplasmataceae的相对丰度,与本实验结果相近。
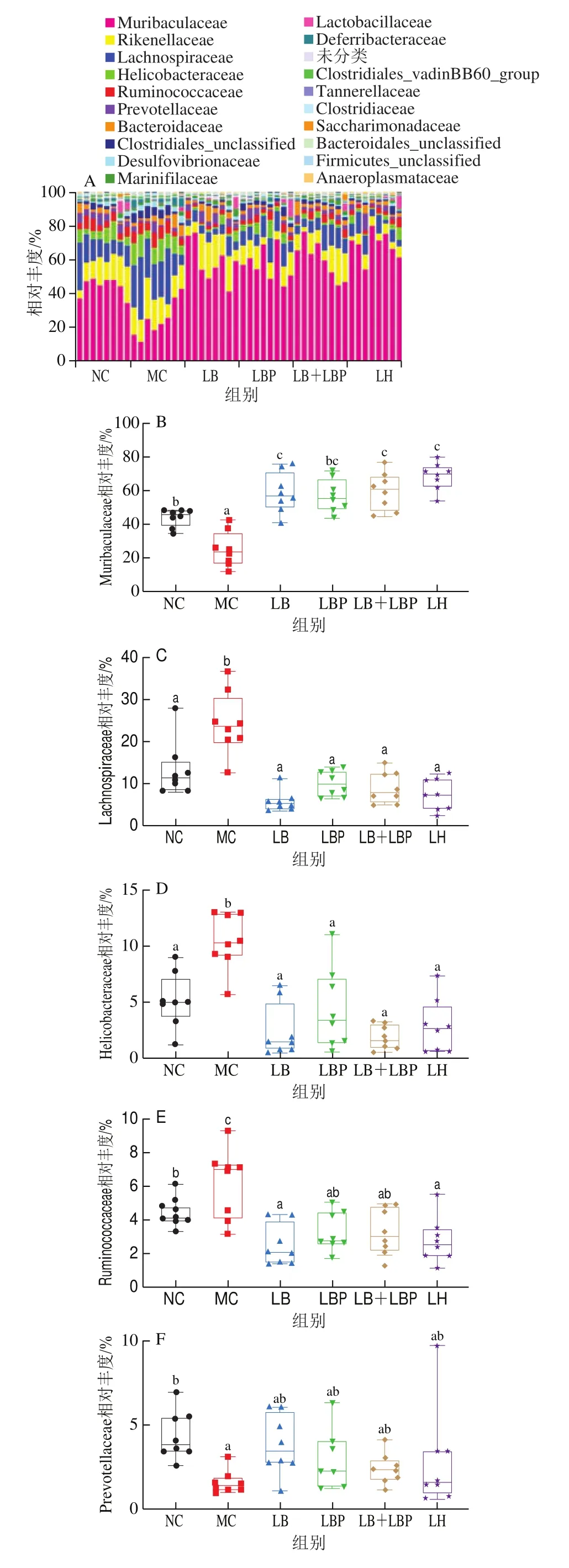
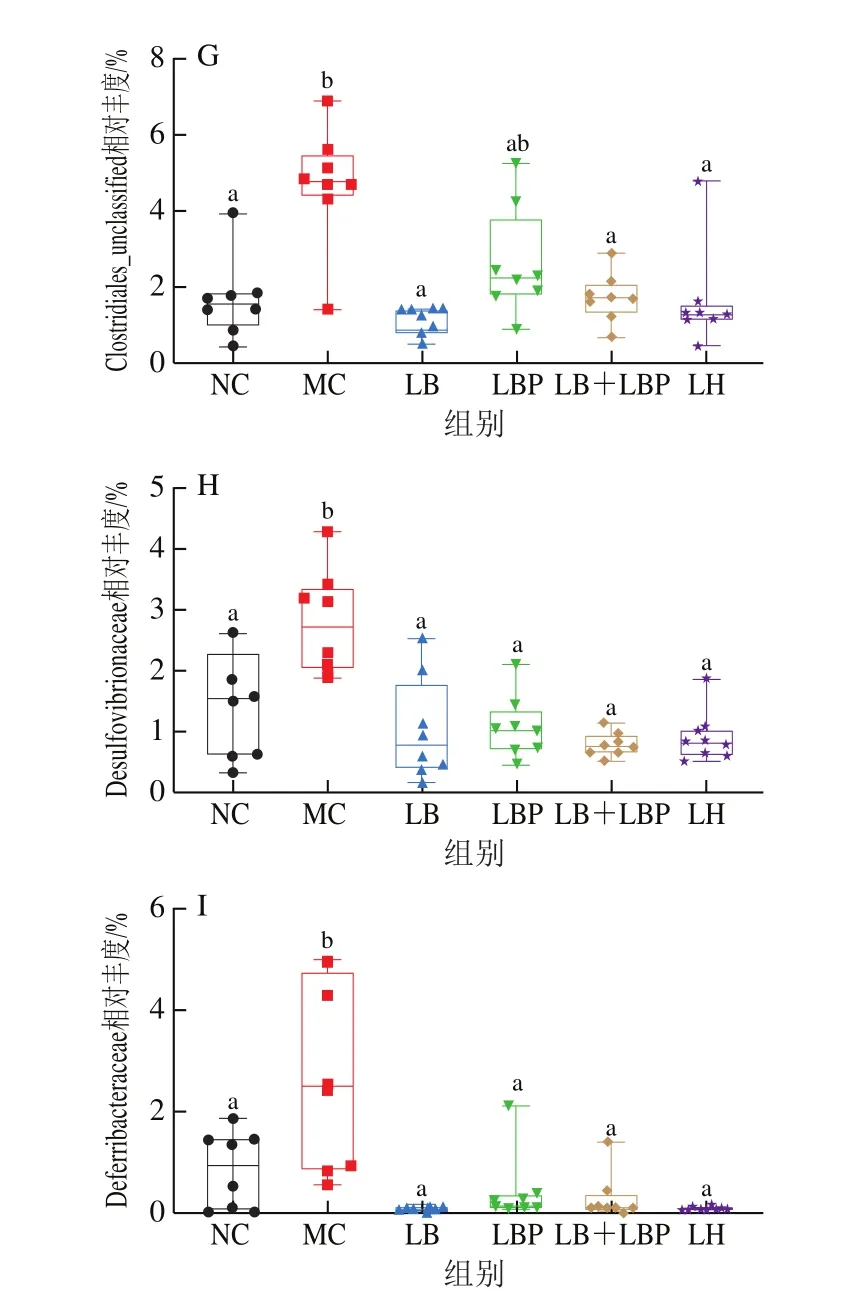
图8 科水平上肠道微生物相对丰度与主要科水平的比较分析Fig.8 Relative abundance of gut microbiota at family level and comparative analysis of relative abundance of major families
如图9所示,在由CTX诱导改变小鼠肠道菌群组成中,可被LB、LBP、LB+LBP调节的菌属包括11种_unclassified、7种、2种、1种、1种、2种_unclassified,其中18种菌属相对丰度增加(_unclassified、),6种菌属相对丰度减少(、、、_unclassified)。本实验从小鼠粪便中检测出众多可被LB、LBP、LB+LBP调节的Muribaculaceae细菌群,研究表明,Muribaculaceae属于拟杆菌门(Bacteroidetes),在小鼠肠道菌群中占主导地位,由于它们的培养时间较晚,家族分类还不明确,其相对丰度与丙酸含量有很强的相关性,是Spalax鼠长寿相关的主要细菌类群。此外,相较于LBP干预,LB、LB+LBP干预能够降低产毒素Clostridiales相对丰度,增加有益菌的相对丰度,LB+LBP干预则可降低厌氧菌的相对丰度。Clostridiales的分布、表达与腹泻型胃肠疾病患者的肠道菌组成、SCFAs水平密切相关,是肠易激综合征潜在的生物标志物。、在正常小鼠体内碳水化合物代谢的表达较高,在高膳食胆固醇导致小鼠脂肪变性、脂肪性肝炎、肝纤维化的实验中,肠道、和在不同阶段明显聚集,且相对丰度依次增加。因此,LB、LB+LBP还调节了与糖脂代谢相关菌群的相对丰度。

图9 小鼠肠道菌群组成Fig.9 Composition of gut microbiota
采用PICRUSt软件进行KEGG代谢通路富集分析,与NC组相比,MC组小鼠由于CTX诱导共有29 条通路(22 条富集,7 条缺失)发生改变。CTX处理导致富集的通路经过LB、LBP、LB+LBP干预后明显减少,如信号转导、环境适应、细胞运动、膜转运、转录、异种生物降解和代谢等,CTX处理导致缺失的通路经过LB、LBP、LB+LBP干预后富集,如免疫系统、消化系统、能量代谢、氨基酸代谢等,此外,碳水化合物代谢和脂代谢也都富集。因此,通过LB、LBP、LB+LBP干预不仅逆转了由CTX处理改变的肠道菌群代谢功能异常,并使其趋于NC组,还调节了碳水化合物代谢和脂代谢,表明LB、LBP及LB+LBP在调节糖脂代谢菌群具有潜在功效。
3 结 论
LB、LBP及其复配物(LB+LBP)均可不同程度地恢复免疫抑制小鼠的体质量和采食量,改善小鼠的脾脏和胸腺损伤,有效促进免疫抑制小鼠细胞因子TNF-α、IL-1β、IFN-γ和IgA的分泌,调节结肠中免疫相关基因的表达,促进SCFAs的产生,显著调节_unclassified、、、、、等菌的相对丰度(<0.05),逆转肠道菌群代谢功能异常,并使其趋于正常。但相较于LBP,LB、LB+LBP还可降低产毒素Clostridiales相对丰度,增加有益菌的相对丰度,LB+LBP还可降低厌氧菌的相对丰度,是潜在益生元的良好来源。本研究结果将为开拓多元化枸杞产品及研发功效针对性的枸杞健康产品和提供理论依据。

