基于乙酰胆碱酯酶和氧化应激研究海胆酮对阿尔茨海默症的作用机制
张 涛,陈艳红,2,3,4,*,常高萍,杨远帆,2,3,4,杜希萍,2,3,4,*,姜泽东,2,3,4,倪 辉,2,3,4,李清彪,2,3,4
(1.集美大学海洋食品与生物工程学院,福建 厦门 361021;2.福建省食品微生物与酶工程重点实验室,福建 厦门 361021;3.厦门市食品与生物工程技术研究中心,福建 厦门 361021;4.厦门南方海洋研究中心海藻资源化利用与深加工重点实验室,福建 厦门 361021)
阿尔茨海默症(Alzheimer’s disease,AD)是一种以记忆力丧失、认知能力下降为主要特征,并伴有不可逆转的神经元丧失的神经退行性疾病,多发于65岁以上老人。2020年全球AD患者5 200万以上,预计2050年AD患者将增至1.52亿。因此,AD已经是全球严重的公共卫生问题,不仅给患者及其家庭带来巨大精神负担,也给社会造成巨大的经济压力。乙酰胆碱酯酶(acetylcholinesterase,AChE)作为生物神经传导中的关键酶,能催化神经递质乙酰胆碱水解为胆碱和乙酸,从而阻断神经信号的传递。所以AChE活力升高会导致乙酰胆碱水平降低,而乙酰胆碱水平降低是AD的关键病因,因此抑制AChE活力、提高乙酰胆碱水平是治疗AD的重要方法。目前美国食品药品监督管理局批准用于治疗AD的乙酰胆碱酯酶抑制剂(acetylcholinesterase inhibitor,AChEI)主要有他克林、多奈哌齐、利凡斯的明、加兰他敏。除加兰他敏外,大多数为合成药物,虽然有一定的治疗效果,但具有头晕、失眠、恶心、轻度腹泻等不同程度的副作用,不适于患者长期使用。因此,寻求高效低毒、适宜患者长期使用的天然来源AChEI对治疗AD具有重要的意义。
研究表明,氧化应激是AD病理机理的一个组成部分,减轻氧化应激对预防AD至关重要,因此具有抗氧化和AChE抑制活性的天然化合物对于预防和治疗AD起着举足轻重的作用。海胆酮(-胡萝卜素-4-酮)是一种酮式类胡萝卜素,由4个异戊二烯单元以共轭双键的形式连接,首尾两端则各连接一个紫罗兰酮环,其中一个紫罗兰酮环上的氢被酮基取代,主要从海胆及藻类等海洋生物中提取。Miller等报道海胆酮具有很强的抗氧化能力,对2,2’-联氮双(3-乙基苯并噻唑啉-6-磺酸)阳离子自由基的清除能力强于角黄素和虾青素。课题组前期从法夫酵母中提取得到海胆酮,本实验应用Ellman法研究海胆酮对AChE的抑制作用,并进一步通过抑制动力学分析其对AChE的抑制类型,利用荧光光谱和圆二色光谱研究其对AChE构象变化的影响,采用分子对接分析其结合位点,初步阐明海胆酮对AChE的抑制机理,并应用淀粉样β蛋白片段25~35(amyloid beta-peptide 25-35,Aβ)诱导大鼠肾上腺嗜铬细胞瘤细胞(PC12细胞)损伤,以不同质量浓度海胆酮干预,研究海胆酮对AD细胞模型氧化应激的影响,阐明海胆酮对AD的潜在作用机制,为海胆酮在功能食品、生物医药等领域的应用提供理论依据。
1 材料与方法
1.1 材料与试剂
海胆酮 实验室自制;AChE(E.C.3.1.1.7,来源于电鳗鱼,500 U/mg)、碘代硫代乙酰胆碱(acetylthiocholine iodide,ATCI)、5,5’-二硫代双(2-硝基苯甲酸)(5,5’-dithiobis-(2-nitrobenzoic acid),DTNB)(纯度98%)、甲醇(色谱级)、100×双抗(100 IU/mL青霉素及100 μg/mL链霉素)溶液、二甲基亚砜(dimethyl sulfoxide,DMSO) 美国Sigma-Aldrich公司;加兰他敏(纯度≥98%)、Aβ上海源叶生物科技有限公司;PC12细胞、马血清(horse serum,HS)、噻唑蓝(3-(4,5-dimethyl-2-thiazolyl)-2,5- diphenyl-2-tetrazolium bromide,MTT) 北京索莱宝科技有限公司;胎牛血清(fetal bovine serum,FBS) 美国Thermo Fisher Scientific公司;R/MINI 1640培养基美国Gibco公司;二喹啉甲酸(bicinchonininc acid,BCA)总蛋白含量测定试剂盒、AChE、丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)测定试剂盒 南京建城生物工程研究所。
1.2 仪器与设备
Mettler Toledo电子天平 顺迪嘉奥有限公司;SPECTROstar Omega全波长自动多功能酶标仪微孔板检测仪德国BMG Labtech公司;7200可见分光光度计 美国Unico公司;CALR2y Ecliose荧光光谱仪 美国Varian公司;JASCO J-810圆二色光谱仪 日本Jasco公司;Avanti J26XP高速冷冻离心机 美国贝克曼公司;DL-CJ-2NDI型超净工作台 中国北京东联哈尔仪器制造有限公司;Galaxy 170R型CO培养箱 中国上海百赛生物技术有限公司;Cytation-5细胞成像多功能酶标仪美国伯腾仪器有限公司;JY92-IIN超声波细胞粉碎机宁波新芝生物科技股份有限公司。
1.3 方法
1.3.1 乙酰胆碱酯酶抑制率测定
参照文献[10]的方法测定海胆酮的AChE抑制率。在96 孔酶标板中依次加入80 μL buffer D(含0.1%(质量分数)牛血清白蛋白的pH 8.0、50 mmol/L Tris-HCl)、20 μL AChE(0.4 U/mL)、20 μL不同质量浓度(5、10、30、40、50 μg/mL)海胆酮溶液(溶剂为甲醇,后同),分别37 ℃温育15 min,加入40 μL底物(0.6 mmol/L ATCI)和40 μL显色剂(0.6 mmol/L DTNB),37 ℃温育15 min后测定405 nm波长处吸光度。以等体积不同质量浓度(5、10、30、40、50 μg/mL)加兰他敏作为阳性对照,3 次平行实验,根据公式(1)计算AChE抑制率。
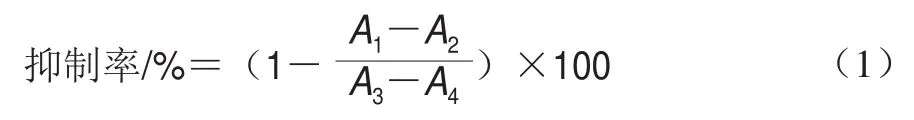
式中:为添加海胆酮、AChE时的吸光度;为添加海胆酮、用等体积buffer D代替AChE时的吸光度;为用等体积甲醇替代海胆酮、加入AChE时的吸光度;为用等体积buffer D代替AChE、等体积甲醇替代海胆酮时的吸光度。
1.3.2 乙酰胆碱酯酶抑制类型的测定
参照文献[11]的方法,固定底物ATCI浓度为0.6 mmol/L,加入量为40 μL,分别添加20 μL不同质量浓度(0、5、10、20 μg/mL)海胆酮溶液,测定不同AChE浓度(0.2、0.4、0.6、0.8、1.0 U/mL)下的酶促反应速率(以每分钟吸光度的变化(Δ)表示,下同)(),以AChE浓度为横坐标,以反应酶促反应速率为纵坐标作图,根据所得线性拟合曲线是否通过坐标原点判断AChE的抑制类型。
如果上述抑制类型为可逆抑制,固定AChE浓度为0.4 U/mL,在不同底物ATCI浓度(0.5、1、2、4、8 mmol/L)下测定不同质量浓度(0、5、10、20 μg/mL)海胆酮的酶促反应速率,以底物浓度的倒数(1/[])为横坐标、酶促反应速率的倒数(1/)为纵坐标绘制Lineweaver-Burk双倒数曲线。根据米氏常数()和最大反应速率()的变化判断抑制类型,以海胆酮质量浓度为横坐标,双倒数曲线各质量浓度直线的斜率为纵坐标作二级曲线图,曲线与横轴的截距为抑制常数。
1.3.3 荧光光谱分析
将50 μL AChE溶液(50 U/mL)和25 μL不同质量浓度(0、5、10、20、30 μg/mL)海胆酮溶液混合均匀后加入1 cm石英试管中用荧光光谱仪记录荧光强度变化。扫描条件:温度为25 ℃,波长为290~490 nm,激发波长为280 nm,激发和发射狭缝宽度为5 nm。
1.3.4 圆二色光谱分析
利用圆二色光谱研究海胆酮对AChE二级构象的影响。将0.2 mL AChE溶液(50 U/mL)与20 μL不同质量浓度(0、10、20 μg/mL)海胆酮溶液混合均匀后加入到1 cm的石英样品池中用JASCO J-810圆二色光谱仪进行测定。扫描条件:波长范围190~290 nm;扫描速率100 nm/s;分辨时间0.5 s;响应时间1 s;带宽2 nm。
1.3.5 分子对接分析
从蛋白质数据库(http://www.rcsb.org)下载AChE和多奈哌齐复合物(PDB ID:1EVE)的晶体结构。从PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/)获得底物ATCI和抑制剂海胆酮的2D结构,并使用Discovery Studio 2.5软件转换为3D结构,应用Discovery Studio 2.5软件进行分子对接。用Autodock 4.2软件测定抑制剂海胆酮、底物ATCI与AChE相互作用的结合能。
1.3.6 细胞培养
PC12细胞复苏后,用含5% FBS、10% HS、1%双抗(青霉素、链霉素)的R/MINI 1640培养基,于37 ℃、5% CO的细胞培养箱中培养,取对数生长期PC12细胞,用R/MINI 1640培养基制成单细胞悬液(浓度为1h10个/mL)进行后续细胞实验。
1.3.7 海胆酮对PC12细胞活性的影响
参考文献[15]的方法应用MTT比色法检测PC12细胞活力。将100 μL PC12细胞(1h10个/mL)接种于96 孔板中,37 ℃下孵育24 h。孵育结束后,吸弃培养液,加入100 μL含不同质量浓度(0(即对照组)、1、5、10、20 μg/mL)海胆酮的R/MINI 1640培养基,于37 ℃继续孵育24 h。吸弃培养液,每孔中加入100 μL质量浓度5 mg/mL的MTT溶液(溶于磷酸盐缓冲液(pH 7.4、0.01 mol/L,后同)),37 ℃继续孵育30 min。之后用磷酸盐缓冲液轻轻洗涤细胞2 次,每孔加入100 μL DMSO,振荡20 min,于570 nm处用酶标仪测量其吸光度,以100 μL DMSO为空白组。根据公式(2)计算细胞活力。

式中:、和分别表示为样品处理组、对照组和空白组的吸光度。
1.3.8 海胆酮对Aβ诱导PC12细胞活性的影响
将100 μL PC12细胞(1h10个/mL)接种到96 孔板中培养24 h。待其贴壁后分为3 组:空白组:不作任何处理,用培养基孵育48 h;模型组:用培养基孵育24 h后,吸弃培养液,用含20 μmol/L Aβ培养基继续孵育24 h;实验组:用含不同质量浓度(5、10、20 μg/mL)海胆酮的培养基孵育24 h,吸弃培养液,用含20 μmol/L Aβ培养基继续孵育24 h。3 组细胞孵育结束后,用磷酸盐缓冲液轻轻洗涤细胞2 次,加入100 μL质量浓度5 mg/mL的MTT,继续孵育4 h,吸弃培养液,加入150 μL DMSO,振荡20 min,用酶标仪于570 nm波长处测定其光密度值OD。Aβ孵育的模型组与海胆酮孵育的实验组统称为处理组,根据公式(3)计算细胞活力。
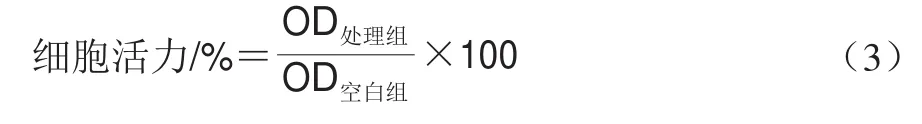
1.3.9 PC12细胞中MDA含量及AChE、SOD、CAT和GSH-Px活力测定
PC12细胞培养及分组加样参照1.3.8节,孵育结束后,利用细胞刮刀收集细胞,冰浴中用超声细胞破碎仪破碎细胞(80 W、20 kHz),2 min后4 ℃下1 200 r/min离心10 min,收集上清液。上清液中的MDA含量及酶活力的测定分别按照MDA、SOD、CAT和GSH-Px试剂盒说明书进行操作。
1.4 数据处理与分析
实验设置3个平行,实验数据以平均值±标准差表示。采用Excel 2016软件处理数据后作图,采用SPSS 2017软件进行单因素方差分析,采用Tukey’s检验进行显著性分析,<0.05表示差异显著。
2 结果与分析
2.1 海胆酮对乙酰胆碱酯酶的抑制作用
由图1可知,在实验质量浓度范围内,随着海胆酮质量浓度的升高,对AChE的抑制作用显著增强(<0.05),表现出明显的剂量依赖性。通过线性拟合计算海胆酮、加兰他敏的半抑制质量浓度(half-maximal inhibitory concentration,IC)分别为(16.29f0.97)、(23.20f1.08)μg/mL,由此可知,海胆酮对AChE的抑制作用强于加兰他敏。此外,据报道海胆酮是一种可食用的橙色素,抗氧化剂和VA原,具有较强的自由基清除能力。因此,海胆酮具有抗氧化和抑制AChE的双重功效,且食用安全性高,有望用于预防和治疗AD。
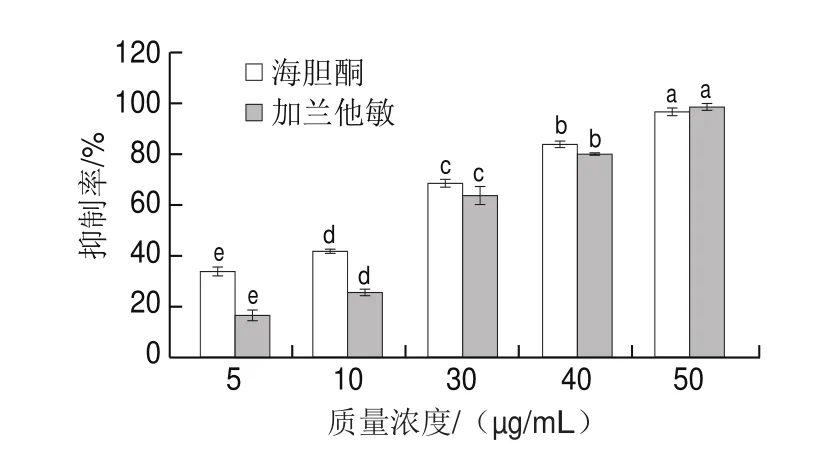
图1 海胆酮和加兰他敏对AChE的抑制作用Fig.1 AChE inhibitory effects of echinenone and galanthamine
2.2 海胆酮对乙酰胆碱酯酶抑制类型分析结果
由图2A可知,不同质量浓度海胆酮作用下的酶浓度-酶促反应速率的线性拟合曲线均通过原点,且线性拟合曲线的斜率随着海胆酮质量浓度的增加而降低,说明加入海胆酮抑制酶促反应速率,表明海胆酮可逆抑制AChE,海胆酮与AChE通过非共价键结合,从而导致AChE活力降低或丧失,并未引起AChE分子构象的永久变化,可通过物理方法使AChE活力恢复。

图2 海胆酮对AChE抑制类型分析结果Fig.2 Analysis of the type of inhibition of echinenone on AChE
固定AChE浓度为0.4 U/mL,由图2B可知,不同质量浓度海胆酮作用下的拟合曲线相交于纵轴一点,纵轴截距为1/,说明添加不同质量浓度的海胆酮,1/不变。随着海胆酮质量浓度的增大,拟合直线的斜率增大,说明米氏常数随着抑制剂浓度的增大而增大。以图2B的直线斜率为纵坐标、AChE浓度为横坐标作图2C,计算得到AChE的为3.82 μg/mL。由以上分析可知,海胆酮对AChE的抑制类型为竞争性抑制,说明海胆酮与底物ATCI竞争AChE的催化位点,降低底物与酶的亲和力从而抑制酶的活力。该抑制类型与二氢小檗碱和黄芩苷对AChE的抑制类型一致。
2.3 海胆酮对AChE荧光光谱的影响
由图3可知,随着海胆酮质量浓度的增加,AChE的荧光强度降低,表明海胆酮对AChE有荧光猝灭作用;但AChE最大发射波长334 nm没有改变,表明AChE色氨酸微环境没有改变。推测AChE与海胆酮通过次级键(如氢键和疏水作用)结合,该结合并未改变色氨酸所处的溶剂环境,而改变AChE内除色氨酸外其他荧光性质氨基酸的微环境产生荧光猝灭,导致酶活力降低。Tang Hongjin等报道丹酚酸C与AChE结合形成新的丹酚酸C-AChE复合物,诱导酶的三级结构发生变化,导致荧光猝灭。
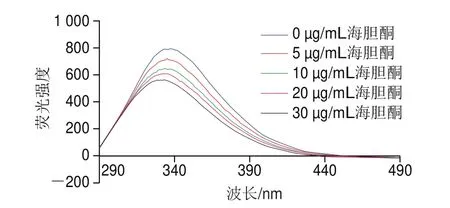
图3 海胆酮对AChE荧光光谱的影响Fig.3 Fluorescence spectra of AChE in the presence of echinenone
2.4 海胆酮对AChE圆二色光谱的影响
圆二色光谱技术广泛用于分析酶二级结构的变化,蛋白质的圆二色光谱中-螺旋在208、222 nm处呈负峰,在192 nm附近有一个正峰。-折叠在215 nm处呈现负峰,在198 nm处有一个正峰。由图4可知,随着加入海胆酮质量浓度的增加,-螺旋相对含量从15.7%下降到7.6%,-折叠相对含量从25.3%下降到16.3%,无规卷曲相对含量从32.2%下降到20.6%,而-转角相对含量从31.2%上升到55.5%。表明海胆酮与AChE结合引起AChE二级结构发生改变,破坏酶的氢键网络,从而导致AChE活力下降。
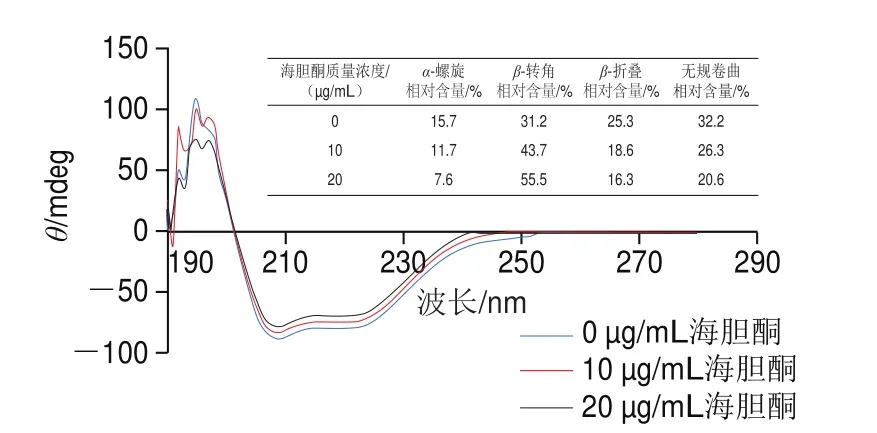
图4 海胆酮对AChE圆二色光谱的影响Fig.4 Circular dichroism spectra of AChE in the presence of echinenone
2.5 分子对接分析海胆酮与AChE的相互作用
采用分子对接技术进一步阐明海胆酮、底物ATCI与AChE的结合方式(图5)。AChE在球形分子结构的表面有一向内凹陷的又深又窄的活性中心“峡谷”,中间狭窄,两端开阔,由3个主要区域组成:位于峡谷底部由Ser200、Glu327和His440组成的催化三联体,催化底物乙酰胆碱的乙酰基水解;位于峡谷中部由Trp84、Phe330、Tyr442和Glul99组成的阴离子活性位点,此位点氨基酸主要通过阳离子-π或π-π电子的堆积与底物结合;位于峡谷入口以Trp279为中心的外周阴离子位点,为变构调节剂和抑制剂提供结合位点。从图5B可以看出,海胆酮和底物ATCI均可与AChE的活性中心结合。底物ATCI与AChE的催化三联体位点Ser200形成氢键,与His440通过范德华力相互作用;与阴离子活性位点Trp84、Phe330以阳离子-π键相互作用;与外周阴离子Tyr121形成碳氢键(图5A)。当加入海胆酮时结合的氨基酸和作用力发生改变(图5 B)。海胆酮与AChE的催化三联体位点Ser200形成碳氢键,与His440形成疏水作用力;与阴离子活性位点Trp84形成π-σ键;与外周阴离子位点Tyr121以范德华力相互作用,与Tyr334、Trp279以疏水作用力相互作用。可见,海胆酮和底物ATCI与AChE有共同的活性中心氨基酸作用位点:Ser200、His440、Trp84和Tyr121。通过分子对接计算可知海胆酮、ATCI与AChE的结合能分别为-10.9 kcal/mol和-4.9 kcal/mol。结合能越低,表明与受体蛋白的亲和力越高。由于海胆酮与AChE的结合能更低,更容易与AChE结合且结合状态更稳定,因而阻碍底物ATCI与活性中心氨基酸结合,从而引起酶活力降低,抑制乙酰胆碱水解,使患者脑内ACh水平提高。海胆酮对AChE有更强的抑制作用可能与海胆酮的化学结构有关。海胆酮的长碳链一端可以作用于AChE活性中心峡谷底部的催化位点,另一端可作用于活性中心峡谷入口处外周阴离子位点。中间碳链可以满足两个位点之间的距离,使海胆酮很好的契合在AChE的整个活性中心峡谷,与底物竞争AChE的活性中心,从而降低酶活力。此结果也与抑制动力学结果一致,进一步表明海胆酮是一种竞争性抑制剂。
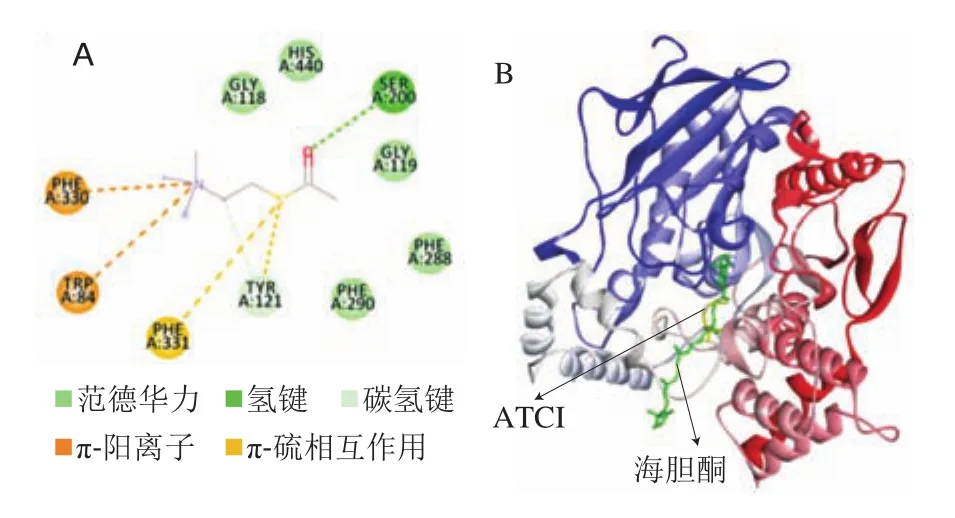

图5 ATCI、海胆酮与AChE的分子对接Fig.5 Molecular docking interaction of echinenone and ATCI with AChE
此外,AChE的外周阴离子结构域在诱发Aβ聚集中发挥重要作用,促进寡聚体及斑块形成。海胆酮与AChE的催化三联体和外周阴离子活性位点同时作用,不仅可以抑制AChE活力而且可以干扰Aβ聚集,从而发挥双重治疗AD的作用。
2.6 海胆酮对PC12细胞活力的影响
由图6可知,在质量浓度0~20 μg/mL范围内,海胆酮对PC12细胞活力均无显著影响(>0.05),细胞活力均接近100%,表明海胆酮在质量浓度0~20 μg/mL范围内对PC12细胞没有毒性作用。因此,后续实验采用20 μg/mL海胆酮作为实验上限质量浓度。
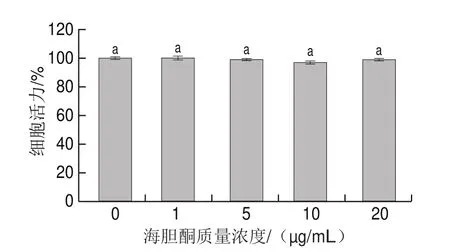
图6 海胆酮对PC12细胞活力的影响Fig.6 Effects of echinenone on the viability of PC12 cells
2.7 海胆酮对Aβ25-35诱导PC12细胞活力的影响
由图7可知,模型组的PC12细胞在Aβ诱导后细胞活力为(65.19f2.58)%,显著低于空白组,说明Aβ成功诱导PC12细胞损伤。经5、10、20 μg/mL海胆酮处理的Aβ诱导PC12细胞的活力分别为(75.61f2.54)%、(79.12%f2.11)%、(84.50f2.44)%;与模型组相比,海胆酮显著提高PC12细胞的活力(<0.05),并呈剂量依赖性,对Aβ诱导的PC12细胞损伤具有保护作用。
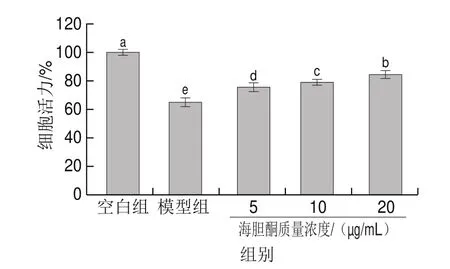
图7 海胆酮对Aβ25-35诱导PC12细胞活力的影响Fig.7 Effect of echinenone on the viability of PC12 cells induced by Aβ25-35
2.8 海胆酮对Aβ25-35诱导PC12细胞中AChE活力的影响
由图8可知,与空白组相比,模型组中AChE的活力显著升高(<0.05),表明Aβ成功诱导PC12细胞胆碱能系统损伤。与模型组相比,不同质量浓度的海胆酮预处理PC12细胞后,Aβ诱导的PC12细胞中AChE的活力随着海胆酮质量浓度的增加显著降低(<0.05),具有剂量依赖性,表明海胆酮能有效抑制PC12细胞中AChE的活力。

图8 海胆酮对PC12细胞AChE活力的影响Fig.8 Effect of echinenone on the activity of AChE in PC12 cells
2.9 海胆酮对Aβ25-35诱导PC12细胞中MDA含量及SOD、CAT、GSH-Px活力的影响
由表1可知,与空白组相比,模型组脂质过氧化终产物MDA含量显著增多(<0.05),抗氧化酶SOD、CAT和GSH-Px活力显著下降(<0.05)。表明Aβ诱导PC12细胞产生氧化应激。与模型组相比,实验组的MDA含量显著减少(<0.05),并且当海胆酮质量浓度为20 μg/mL时,MDA含量与空白组无显著差异(>0.05)。表明经海胆酮处理的Aβ诱导PC12细胞可以降低氧化应激。当海胆酮质量浓度为5 μg/mL时,SOD活力与模型组无显著差异(>0.05),随着加入海胆酮质量浓度的增大,SOD活力显著升高(<0.05),并且当海胆酮质量浓度为20 μg/mL时,SOD活力为(77.44f7.92)U/mg,显著高于空白组(<0.05)。随着海胆酮质量浓度的增加,CAT活力和GSH-Px活力均显著升高(<0.05),呈明显的剂量依赖性;并且当海胆酮质量浓度为10 μg/mL时,CAT活力已显著高于空白组(<0.05)。综上所述,添加海胆酮可以引起MDA含量显著减少,SOD、CAT和GSH-Px活力显著升高,表明给予海胆酮预保护可以明显减轻Aβ诱导AD细胞模型的氧化应激损伤。
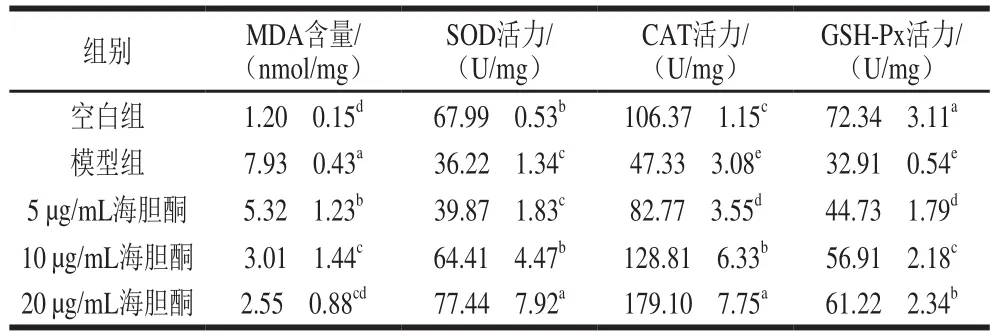
表1 海胆酮对Aβ25-35诱导PC12细胞中MDA含量和抗氧化酶系活力的影响Table 1 Effect of echinenone on MDA content and antioxidant enzyme activity in PC12 cells induced by Aβ25-35
3 讨 论
AD是多因素复杂疾病,胆碱能系统损伤和氧化应激反应是导致AD的两大重要机制。胆碱能损伤的主要表现为AChE活力升高,乙酰胆碱缺失。氧化应激是过氧化物和抗氧化剂之间的动态不稳定状态。其特征是机体内活性氧类、活性氮类等自由基含量显著增加,超过机体本身的清除能力,造成氧化系统和抗氧化系统失衡,导致氧化损伤的产生,最终影响细胞中蛋白质表达和DNA/RNA的翻译后修饰,造成细胞损伤或凋亡。脂质过氧化物MDA含量增加、抗氧化物酶如SOD、CAT和GSH-Px等活性下降是AD氧化应激反应的重要表现。PC12细胞来源于大鼠肾上腺嗜铬细胞瘤,是常用的神经元细胞模型。Aβ具有神经毒性作用,会损伤胆碱能神经元,引起神经细胞凋亡,产生氧化应激反应,进而导致AD,Aβ的主要毒性片段为Aβ。本实验研究海胆酮对AChE的抑制机理,并通过Aβ诱导PC12细胞建立AD细胞模型,进一步研究海胆酮对Aβ诱导AD细胞模型氧化应激的影响。结果表明,海胆酮对AChE具有很强的抑制作用,可引起AChE二级结构的改变,与底物竞争AChE的结合位点,从而降低酶活力。Aβ诱导AD细胞模型结果显示,细胞活性降低,MDA水平显著升高,SOD、CAT和GSH-Px活力显著降低,表明Aβ诱导PC12细胞氧化系统与抗氧化系统失衡,产生了氧化应激。海胆酮处理后细胞活性升高,MDA含量降低,SOD、CAT和GSH-Px活力升高;表明海胆酮通过提高SOD、CAT和GSH-Px的活力,以及防止脂质过氧化作用,从而减少脂质过氧化终产物MDA的产生,减轻Aβ诱导细胞的氧化应激损伤。综上,海胆酮通过抑制AChE活力减轻胆碱能损伤;海胆酮通过提高细胞抗氧化酶SOD、CAT和GSHPx的活力,降低脂质过氧化终产物MDA的含量,从而减轻细胞氧化应激损伤,具有潜在的预防和辅助治疗AD的功效。
4 结 论
本研究基于AChE活力和氧化应激研究了海胆酮对AD的作用机制,结果表明,海胆酮可通过竞争性抑制降低AChE活力减轻胆碱能损伤,降低乙酰胆碱的水解速率,维持乙酰胆碱水平,保证神经信号的正常传递;此外,海胆酮可通过提高抗氧化酶的活力降低脂质过氧化终产物MDA含量,对细胞氧化应激损伤起到保护作用。本实验为海胆酮用于预防和治疗AD提供了参考,同时为海胆酮在功能食品、生物医药等领域的应用提供了理论支持和科学依据。

