超声波辅助没食子酸改善海鲈鱼肌原纤维蛋白的凝胶性能
李颖畅,师丹华,张馨元,李笑涵,邹 倩,仪淑敏*
(渤海大学食品科学与工程学院,生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁 锦州 121013)
海鲈鱼又称咸水鲈鱼,属硬骨鱼纲、鲈形目、鲈鱼种,在海洋中的分布比较广,是产量较高的海洋经济鱼类之一,其蛋白质、不饱和脂肪酸含量丰富。海鲈鱼可以鲜食,也可以制成鱼糜制品。其盐溶性肌原纤维蛋白含量较高,对鱼糜制品品质有着关键作用,直接影响鱼糜制品质构特性与风味特性。
没食子酸即3,4,5-三羟基苯甲酸,是一种酚类化合物,不仅能延缓脂肪蛋白氧化,同时能与蛋白、多糖通过氢键、疏水作用力等方式进行非共价结合,也能与蛋白质中的巯基和氨基发生加成反应,共价结合形成巯基-醌、氨基-醌,引起蛋白质二级、三级结构的改变。据报道,没食子酸可以改变鱼肌原纤维蛋白的表面疏水性,使蛋白质二级、三级结构发生变化,并且这种变化与没食子酸的添加量具有相关性。贾娜等发现没食子酸可以增加猪肉糜肌原纤维蛋白表面疏水性和溶解度,提高蛋白质的凝胶性能。胡熠等研究表明没食子酸能够使肌原纤维蛋白的-螺旋、-折叠含量增加,凝胶结构更加致密和光滑。von Staszewski等发现蛋白质-多酚复合物可促进-乳球蛋白和酪蛋白糖肽的凝胶化反应。
超声波作为一种常用的加工技术,在食品保鲜、辅助工艺优化、辅助解冻以及辅助热处理等方面应用广泛。超声波可以产生空化气泡和微流,导致高温、高压、高剪切力和湍流的形成,从而改变蛋白质的结构和功能特性。Zhao Chengbin等发现超声预处理可以使大豆分离蛋白偶联物的二级结构更加有序。Madadlou等发现超声处理的酪蛋白可以推迟凝胶形成时间并增加酪蛋白凝胶的硬度。Li Fangfei等指出,用超声波强度500 W解冻猪肉可以最大程度地减少对蛋白质构象的损伤和促进肌原纤维蛋白凝胶形成。Zhang Ziye等研究表明,使用不大于600 W的高强度超声处理肌原纤维蛋白后,肌原纤维蛋白具有更致密和均匀的凝胶微观结构,提高了凝胶的持水能力。曲文娟等利用没食子酸改性、超声波辅助制备的胶原蛋白-壳聚糖复合涂膜包裹猪肉,发现可以延缓猪肉腐败变质,延长保质期。
目前,关于超声波辅助没食子酸对肌原纤维蛋白凝胶性能的影响鲜有报道。本实验通过测定凝胶强度、质构特性、水分分布状态、色差、持水性与蒸煮损失率、化学作用力等,并采用原子力显微镜(atom force microscope,AFM)观察凝胶微观结构,探究超声波辅助没食子酸对海鲈鱼肌原纤维蛋白凝胶特性的影响,为凝胶类肉制品的加工提供技术参考和理论支持。
1 材料与方法
1.1 材料与试剂
海鲈鱼平均体长(30±1)cm、体质量(1 000±50)g,购自辽宁省锦州市科技路水产批发市场。
磷酸氢二钾、磷酸二氢钾、盐酸、氯化钠、氯化钾、乙二胺四乙酸二钠、尿素、2-硝基苯甲酸、氯化钙、钼酸铵、亚硫酸钠、2,4-二硝基苯肼、乙醇、冰乙酸、溴酚蓝、25%戊二醛(均为分析纯) 天津市风船化学试剂科技有限公司;Tris、ATP、三氯乙酸、没食子酸、对苯二酚、盐酸胍、-巯基乙醇、电泳Marker蛋白北京索莱宝科技有限公司。
1.2 仪器与设备
KQ-400KDE超声波 昆山市超声仪器有限公司;UV-2550紫外-可见光分光光度计 岛津仪器(苏州)有限公司;SORVALL Stratos冷冻高速离心机 美国Thermo公司;MS105DU分析天平 梅特勒-托利多仪器(上海)有限公司;970 CRT荧光分光光度计 上海精密科学仪器有限公司;HH-4数显恒温水浴锅 常州国华电器有限公司;CR-400色差计 日本Konica-Minolta公司;XE-70 AFM 韩国Park Systems公司;S-4800冷场发射扫描电子显微镜 日本日立公司;PQ001低场核磁共振分析仪 上海纽迈电子科技有限公司;TA.XT-Plus质构仪 英国Stable Micro Systems公司;Free Zone2.5真空冷冻干燥机 美国Labconco公司。
1.3 方法
1.3.1 肌原纤维蛋白的提取
肌原纤维蛋白的提取参考李学鹏等的方法。
1.3.2 没食子酸-肌原纤维蛋白混合体系的制备及超声处理
没食子酸-肌原纤维蛋白混合体系的制备方法参考张慧芸等的方法。每组取肌原纤维蛋白均100 g,用0.6 mol/L NaCl的缓冲溶液(pH 7.2,含20 mmol/L Tris-HCl)稀释,使得体系中蛋白终质量浓度为130 mg/mL,向提取的肌原纤维蛋白溶液中添加0、1、2、4 mg/g和6 mg/g没食子酸。分为400 W超声波处理组(400 W超声处理20 min)和未超声组(0 W)。处理后的样品于4 ℃冰箱储存备用,用于后续指标测定。
1.3.3 肌原纤维蛋白凝胶的制备
将1.3.2节不同处理组肌原纤维蛋白溶液放入直径25 mm柱形小瓶,85 ℃恒温水浴锅加热30 min,冰水冷却20 min,制备肌原纤维蛋白凝胶。样品在4 ℃的冰箱中过夜。测定前蛋白凝胶在室温下放置20 min。
1.3.4 凝胶强度测定
采用质构仪凝胶强度测定模式分析凝胶破断力和凹陷距离。测定条件:探头为P/5S球形金属探头;测前速率为2.0 mm/s,测中速率为1.0 mm/s,测后速率为1.0 mm/s;测试距离为15.0 mm;触发力为10.0 g。凝胶强度按照公式(1)计算。

1.3.5 凝胶质构特性测定
采用TA.XT-Plus型质构仪对凝胶质构特性进行测定,探头为P/50,测试前速率2.0 mm/s,测试中速率1.5 mm/s,测试后速率1.5 mm/s,压缩比40%,下压力5.0 g。
1.3.6 凝胶水分分布状态测定
将凝胶切成直径为5 mmh5 mmh20 mm凝胶块。采用CPMG脉冲序列测定自旋-自旋弛豫时间。参数设定:SFI=22 MHz、P90=14 μs、SW=100 kHz、TR=2 000 ms、NS=8、=150 μs、Echocnt=4 000。
1.3.7 凝胶色泽测定
参考文献[23],采用CR-400色差计测定蛋白凝胶的*(亮度)、*(红绿度)、*(黄蓝度)值和白度。
1.3.8 凝胶持水性和蒸煮损失率测定
通过Han Minyi等的离心法测定持水性,并略作修改。将蛋白凝胶样品装入50 mL离心管(/g),称质量(/g),再5 000h离心15 min,弃去水分,再次称质量(/g)。按式(2)计算持水性。

参考Ma Xingsheng等的方法测定蒸煮损失率,并稍作修改,将凝胶样品切成5.0 mm的薄片(5 g),封于蒸煮袋,称质量(/g)。于90 ℃水浴20 min,取出,擦干表面液体再次称质量(/g)。按式(3)计算蒸煮损失率。
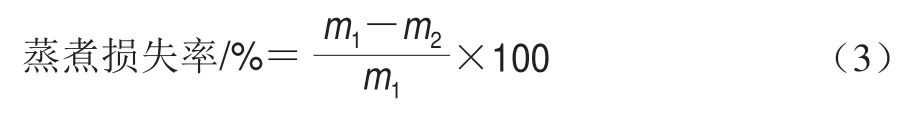
1.3.9 凝胶化学作用力测定
凝胶化学作用力通过蛋白质溶解度表示。参考Gómez-Guillén等方法:取2.0 g蛋白凝胶样品5 份,分别加入0.05 mol/L NaCl(A液)、0.6 mol/L NaCl(B液)、0.6 mol/L NaCl+1.5 mol/L尿素(C液)、0.6 mol/L NaCl+8.0 mol/L尿素(D液)、0.6 mol/L NaCl+8.0 mol/L尿素+0.05 mol/L-巯基乙醇(E液)5种溶液各10 mL,均质混匀,4 ℃放置60 min,10 000 r/min离心15 min,取上清液并用双缩脲法测定其中蛋白质量浓度。按式(4)~(7)分别计算离子键含量、氢键含量、疏水相互作用和二硫键含量,结果以每升溶液所含的溶出蛋白质量表示(g/L)。

1.3.10 凝胶微观结构观察
参考王艳敏等的方法并略作修改,将1.3.2节蛋白溶液样品稀释至20 μg/mL,准确吸取6 μL蛋白溶液,均匀的涂在载玻片上,室温下于超净台中干燥。纯净水(30 ℃、35 μL)冲洗3 次。放置于AFM载物台进行观察。采用轻敲模式。使用Gwyddion软件分析AFM图片。
1.4 数据处理与分析
采用Excel软件对数据进行统计,结果以平均值±标准差表示,采用SPSS 19.0软件通过Duncan法进行显著性分析,以<0.05表示差异显著,采用Origin 8.5软件作图。
2 结果与分析
2.1 没食子酸添加量和超声处理对肌原纤维蛋白凝胶强度的影响
凝胶强度能够体现肌原纤维蛋白形成凝胶的能力。如图1所示,未超声处理条件下,未添加没食子酸的肌原纤维蛋白和添加没食子酸组的肌原纤维蛋白凝胶强度差异显著(<0.05),没食子酸的添加量小于2 mg/g时,凝胶强度随着没食子酸添加量的增加而增加,而没食子酸的添加量大于2 mg/g时,各组凝胶强度又出现下降趋势;没食子酸添加量为2 mg/g时,肌原纤维蛋白凝胶强度最大,这是因为适度的多酚氧化会使蛋白中巯基向二硫键转化,促进肌原纤维蛋白发生交联;而当没食子酸的添加量为6 mg/g时,凝胶强度从612.07 ggmm(添加量为2 mg/g时)下降至496.92 ggmm,可能是由于没食子酸过度氧化形成醌类物质,也有可能是因为其过度氧化产生的自由基使凝胶结构遭到破坏。由此可知,添加没食子酸一定程度上能提高肌原纤维蛋白的凝胶强度,但当没食子酸的添加量过高时,反而会导致凝胶强度下降,这与Pan Jinfeng等研究鱼肌原纤维蛋白凝胶强度对没食子酸的添加量具有剂量依赖性的结论一致。超声波400 W处理组凝胶强度高于未超声组的凝胶强度,不同没食子酸添加量处理组差异显著(<0.05)。说明超声波处理后,蛋白质分子展开,溶解度增加,粒度减小,促进肌原纤维蛋白形成致密均匀的凝胶网络结构,凝胶强度增强。Amiri等研究发现300 W超声波处理牛肉肌原纤维蛋白30 min,凝胶强度最大。说明超声波处理具有促进肌原纤维蛋白形成凝胶的能力。

图1 超声波处理下没食子酸对肌原纤维蛋白凝胶强度的影响Fig.1 Effect of gallic acid on gel strength of myofibrillar protein under ultrasonic treatment
2.2 没食子酸添加量和超声处理对肌原纤维蛋白质构特性的影响
质构是决定凝胶感官品质的一个重要特性。由表1可知,随着没食子酸添加量在0~2 mg/g范围内的增加,凝胶硬度和咀嚼度不断增大,当没食子酸添加量为2 mg/g时,凝胶硬度、咀嚼度达到最大值,且此时硬度与其他添加量没食子酸处理组差异显著(<0.05)。这是因为适量的没食子酸可以促使蛋白质的巯基与酚发生加成反应,形成稳定构象,与张典等研究多酚协同磷酸化处理对蛋白凝胶特性的影响结果一致。而没食子酸的添加量继续增加时,硬度、咀嚼度呈下降趋势,可能是因为没食子酸被氧化成醌类物质,醌类物质可以与蛋白质巯基发生加成反应生成硫代醌加合物。有研究表明,随着茶多酚含量的增加,羊肉肌原纤维蛋白的硬度、咀嚼度一直呈上升趋势,与本研究结果不同,这可能是茶多酚和没食子酸的结构不同以及添加量的不同造成的。不同添加量没食子酸处理对肌原纤维蛋白的弹性没有显著影响。400 W超声波辅助处理后的肌原纤维蛋白凝胶质构特性变化结果如表2所示,相对于未超声组,400 W超声处理后凝胶硬度、弹性与咀嚼度均有所提高。这是因为超声处理有利于蛋白质结构的展开,埋藏在内部的氨基酸残基更多地暴露出来,氨基酸与氨基酸及氨基酸与酚羟基间的相互作用增强。Zhao Yingying等发现超声波处理可以提高鸡胸肉肌原纤维蛋白-大豆油复合溶胶的凝胶强度、硬度、咀嚼度,本实验结果与其一致。

表1 没食子酸对肌原纤维蛋白凝胶质构特性的影响Table 1 Effect of gallic acid on texture of myofibrillar protein gels
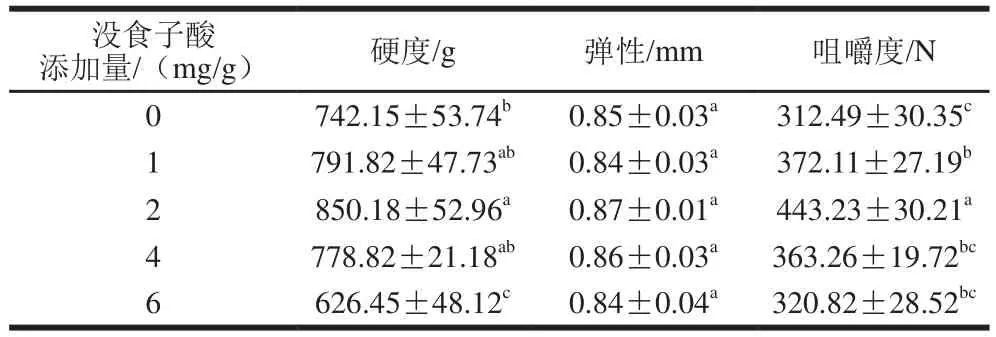
表2 400 W超声波辅助下没食子酸对纤维蛋白凝胶质构特性的影响Table 2 Effect of gallic acid combined with 400 W ultrasonic treatment on texture of myofibrillar protein gels
2.3 没食子酸添加量和超声处理对肌原纤维蛋白水分分布状态的影响
水分分布状态与凝胶性能密切相关,低场核磁共振技术常用于评估水分移动与分布情况。如图2所示,在弛豫时间0~1 000 ms分布4个峰,依次为0~1 ms强结合水峰、1~10 ms弱结合水峰、10~100 ms不易流动水峰、100~1 000 ms自由水峰。其中不易流动水所占比例最大,结合水和自由水比例较小。
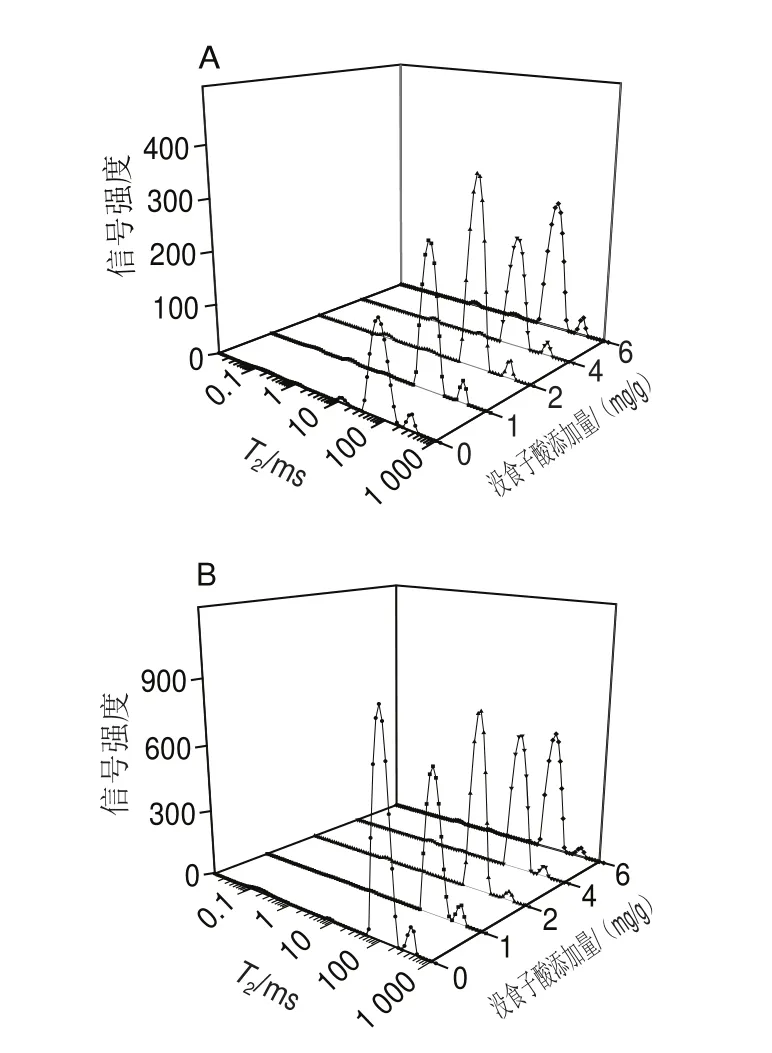
图2 肌原纤维蛋白凝胶横向弛豫时间(T2)图谱Fig.2 Transverse relaxation time (T2) of myofibrillar protein gels
强结合水、弱结合水、不易流动水和自由水峰面积比例分别用、、、表示,本实验主要就不易流动水和自由水的峰面积比例进行分析。由表3可以看出,各处理组中未添加没食子酸组最小,而最大,未添加没食子酸组和添加组差异显著(<0.05)。随着没食子酸添加量的增加,先升高后降低。当添加量为2 mg/g时,最大,最小,这是因为适量的没食子酸羟基可与蛋白质分子相互作用,形成致密的肌原纤维蛋白凝胶网络,使一部分自由水转化为不易流动水,结合在蛋白质周围或被固定在凝胶结构中。李玲等通过研究氧化条件下茶多酚对猪肉肌原纤维蛋白凝胶特性的影响,发现随着茶多酚含量的增加,凝胶中不易流动水含量显著增加,而自由水含量显著下降(<0.05)。由表4可知,超声波处理后,与未经超声处理组相比,明显提高,而总体呈下降趋势。这是因为超声诱导的空化作用以及样品中肌纤维结构的变化可以减少不易流动水的损失,对水分分布状态产生积极的影响。Zhang Ziye等研究不同功率高强度超声处理对肌原纤维蛋白的影响,结果表明结合水具有较低的水迁移率,而不易流动水和自由水的比例在600 W条件下分别具有最大值和最小值,本实验研究结果与之相似。

表3 没食子酸添加量对肌原纤维蛋白凝胶峰面积比例的影响Table 3 Effect of gallic acid on percentage peak area of myofibrillar protein gels
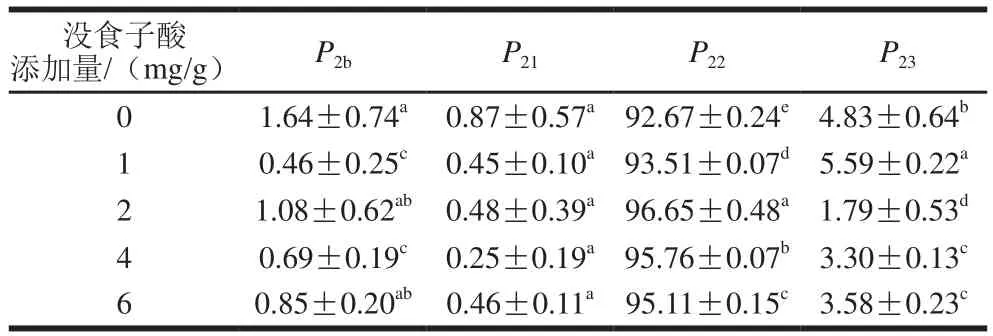
表4 400 W超声波辅助下没食子酸添加量对肌原纤维蛋白凝胶峰面积比例的影响Table 4 Effect of gallic acid combined with 400 W ultrasonic treatment on percentage peak area of myofibrillar protein gels
2.4 没食子酸添加量和超声处理对肌原纤维蛋白色泽的影响
色泽与肉制品食用品质及消费者偏好和可接受程度相关。未超声和超声波辅助下没食子酸对蛋白凝胶色泽的影响分别如表5、6所示,随着没食子酸添加量的增加,蛋白凝胶的*值、白度呈下降趋势,*值变化不显著,而*值增加,表明没食子酸的添加会干扰凝胶色泽的形成,添加量越大,颜色变化越明显。孙科等通过向鲅鱼鱼糜中添加苹果多酚,发现苹果多酚含量的增加会使鱼糜颜色偏红,对白度产生一定的影响。400 W超声波辅助处理后,与未经超声处理组相比,*值、白度总体呈下降趋势,这是因为超声处理后,凝胶进一步交联,持水力和光吸收程度增加,所以白度下降。没食子酸会对凝胶色泽产生影响,但是色泽变化整体可接受。

表5 没食子酸对肌原纤维蛋白凝胶L*、a*、b*值和白度的影响Table 5 Effect of gallic acid on color parameters L*, a* and b* and whiteness of myofibrillar protein gels
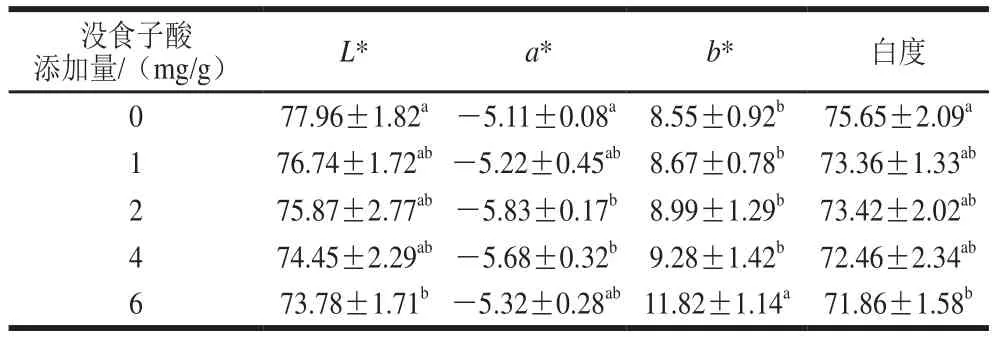
表6 400 W超声波辅助下没食子酸对肌原纤维蛋白凝胶L*、a*、b*值和白度的影响Table 6 Effect of gallic acid combined with 400 W ultrasonic treatment on color parameters L*, a* and b* and whiteness of myofibrillar protein gels
2.5 没食子酸添加量和超声处理对肌原纤维蛋白凝胶持水性和蒸煮损失率的影响
持水性和蒸煮损失率是评价蛋白凝胶优劣的重要指标,持水性高、蒸煮损失率低,表明凝胶保持内部水分的能力强,间接证明凝胶网络结构致密。如图3所示,随着没食子酸添加量增加,凝胶持水性先上升后下降,蒸煮损失率变化趋势相反。未超声处理组中未添加没食子酸的肌原纤维蛋白持水性最低,而蒸煮损失率最高;其次是没食子酸添加量为6 mg/g的肌原纤维蛋白;当没食子酸添加量为1、4 mg/g时两者的持水性、蒸煮损失率差异都不显著(>0.05);而添加量为2 mg/g时,持水性最高,约达到70%,蒸煮损失率仅约为5%。这是由于没食子酸能与蛋白质氨基酸的-或-NH产生共价交联作用,在较大范围内形成了酚-蛋白复合物,使蛋白和水分结合更牢固。胡熠等向海鳗肌原纤维蛋白凝胶中加入没食子酸,发现在一定范围内,持水性随没食子酸含量的增加而增加,但是进一步增加没食子酸的含量时会使蛋白质聚集从而导致持水性下降,本研究结果与之一致。超声波400 W处理肌原纤维蛋白后,与未经超声处理组相比持水性增加,蒸煮损失率降低,因为经过超声处理后蛋白质的结构发生改变,暴露出更多的带电基团,使蛋白质与水之间的相互作用增强。Liu Ru等研究表明超声波可使鲢鱼肌球蛋白持水性增加、蒸煮损失降低。尹艺霖等发现超声400 W处理可以降低鲢鱼肌原纤维蛋白蒸煮损失率,本实验结果与之一致。
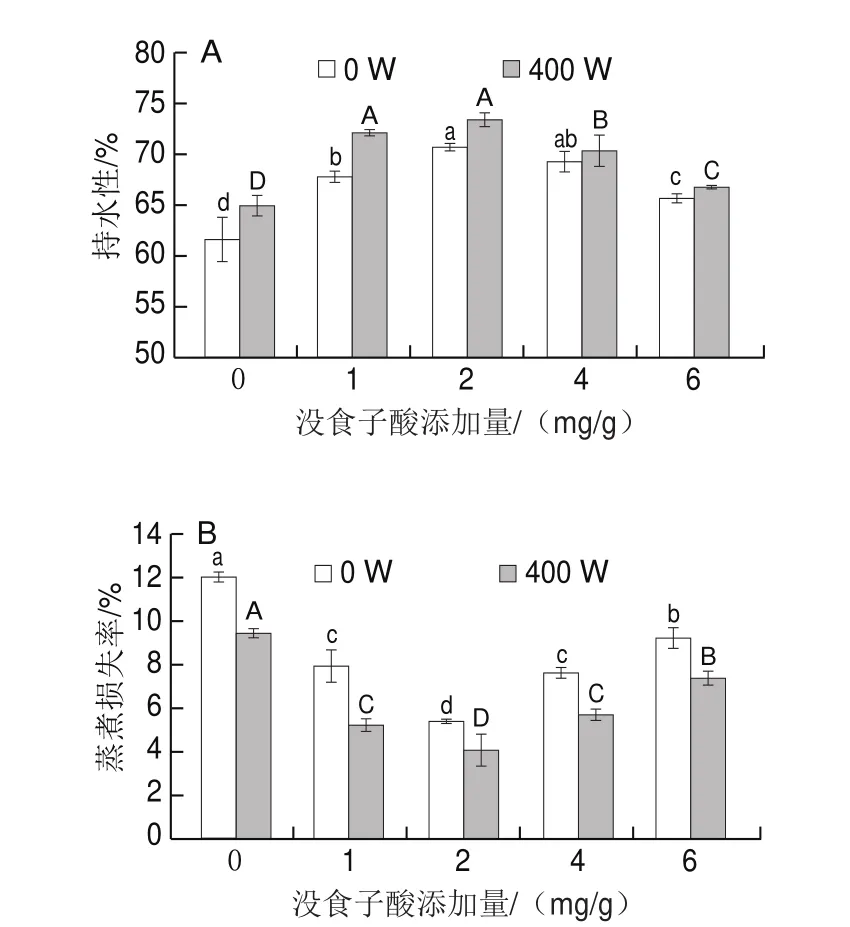
图3 超声波处理下没食子酸添加量对肌原纤维蛋白凝胶持水性和蒸煮损失率的影响Fig.3 Effect of gallic acid combined with ultrasonic treatment on water-holding capacity and cooking loss rate of myofibrillar proteins
2.6 没食子酸添加量和超声处理对肌原纤维蛋白化学作用力的影响
决定蛋白质凝胶结构稳定性的化学作用力有离子键、氢键、二硫键、疏水相互作用等。氢键主要用于稳定蛋白质的二级结构。疏水相互作用是蛋白质发生折叠时的主要动力,影响大部分蛋白质的结构和性质。由图4A可知,随着没食子酸添加量的增加,离子键含量呈下降趋势,氢键和二硫键含量呈上升趋势,且二硫键的含量随没食子酸添加量的增加变化显著(<0.05)。这是由于没食子酸含有3个酚羟基,亲水基团数量多,可与蛋白结合形成氢键;同时在凝胶形成过程中,添加的没食子酸可以改变蛋白质内部结构,与暴露出的基团相互结合,更容易发生蛋白质交联,形成二硫键,使蛋白结构更加紧密。而疏水相互作用随没食子酸添加量的增加呈先升高后下降的趋势,当没食子酸的添加量为2 mg/g时疏水相互作用最强,因为适量的没食子酸会促进蛋白质的展开,而没食子酸的含量过高时,导致蛋白质聚集,甚至变性,进一步折叠使疏水性氨基酸埋藏在内部。其他一些酚类物质,如儿茶素、茶多酚等也均会对疏水作用产生影响。由图4B可知,经400 W超声波处理后,随着没食子酸添加量的增加,氢键含量逐渐增加,二硫键含量显著增加(<0.05),但是离子键含量变化不明显。这是因为超声处理后的空化效应会加速蛋白质的展开,同时暴露出更多的巯基和氨基,使蛋白质交联进一步加强。400 W超声波可以产生高反应性自由基,与没食子酸反应生成没食子酸醌类物质,形成蛋白质-硫-没食子酸-硫-蛋白质聚合物,使二硫键含量上升。Pan Jinfeng等研究发现超声波处理后会增加蛋白质二硫键含量,本实验结果与其一致。
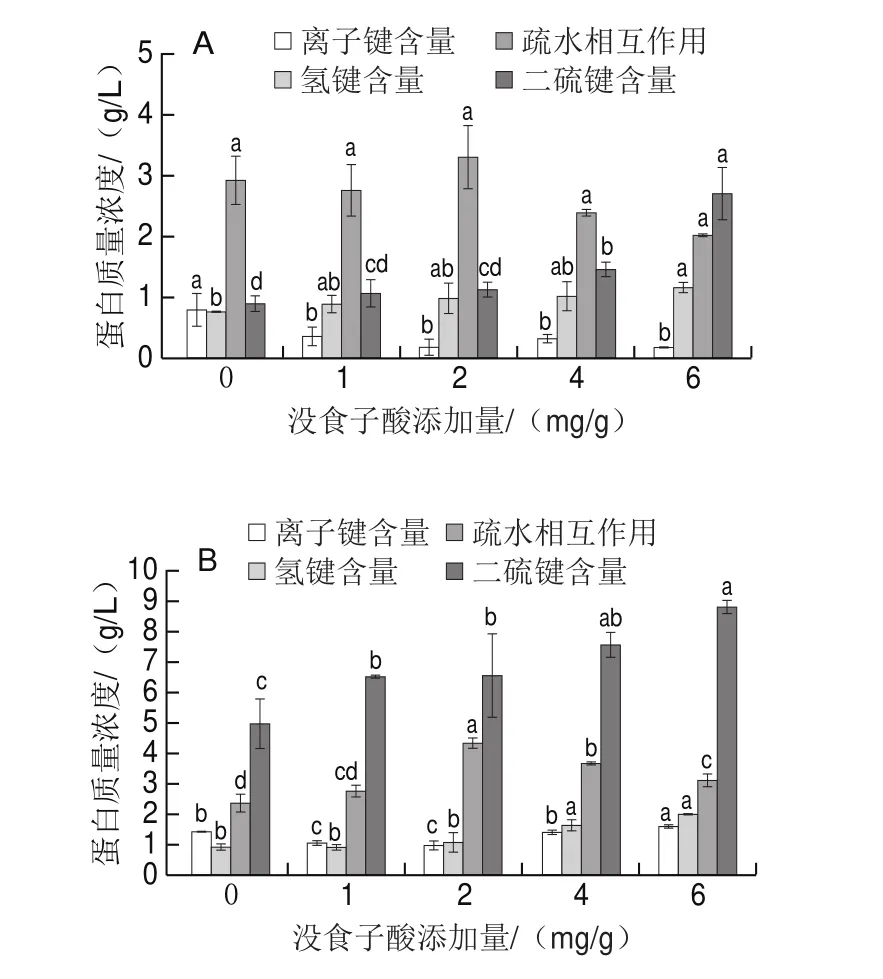
图4 未超声与超声波处理下没食子酸添加量对肌原纤维蛋白凝胶化学作用力的影响Fig.4 Effect of gallic acid alone or in combination with ultrasonictreatment on the chemical forces of myofibrillar protein gels
2.7 没食子酸添加量和超声处理对肌原纤维蛋白凝胶微观结构的影响
AFM是表征蛋白质表面形貌特征的常用方法,可表征样品表面不同维度的形貌,且空间分辨率高。图5、6分别为超声波辅助下肌原纤维蛋白二维、三维成像图。如图5A、图6A所示,未添加没食子酸时,肌球蛋白无序聚集,形成不规则的簇状聚集体。当添加1 mg/g的没食子酸时,凝胶分布相对均匀,存在轻微的交联现象(图5B、图6B)。添加2、4 mg/g没食子酸时,凝胶聚集体更小,分布更均匀,且交联有序,此时形成的凝胶结构最好(图5C、图6C和图5D、图6D)。说明随着没食子酸添加量的增加,凝胶微观结构由不规则、不均匀向更加规则均匀致密转化,这是因为适量的没食子酸可以改变蛋白的结构,使埋藏在内部的基团暴露,更易形成二硫键,同时,本实验中凝胶强度、二硫键含量、持水性的增加以及蒸煮损失率的降低进一步表明了凝胶性能的增强。然而,当没食子酸的添加量为6 mg/g时,此时凝胶分布虽然均匀,但形成了较密集的聚集(图5E、图6E)。因为添加过量的没食子酸后,肌球蛋白构象改变,两者进一步发生加成反应,形成醌类物质,产生较大的蛋白质聚集体。400 W超声处理后,凝胶微观结构整体增强,且更加均匀。观察发现未添加没食子酸凝胶呈现了有序的聚集(图5A、图6A),且有簇状聚集体。没食子酸添加量为1 mg/g和2 mg/g时凝胶聚集行为少,分布更加均匀(图5B、图6B和图5C、图6C),而没食子酸添加量为4 mg/g和6 mg/g凝胶分布呈现密集状态(图5D、图6D和图5E、图6E)。这可能是因为超声波的空化效应等作用使得蛋白分子分布一致有序。因此,超声波辅助下没食子酸可以提高肌原纤维蛋白的凝胶性能。


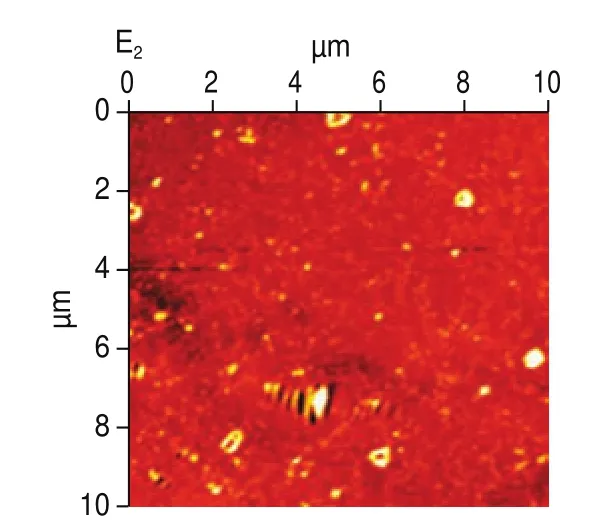
图5 超声波辅助下肌原纤维蛋白AFM二维成像图Fig.5 Two-dimensional AFM images of myofibrillar protein subjected to ultrasonic treatment
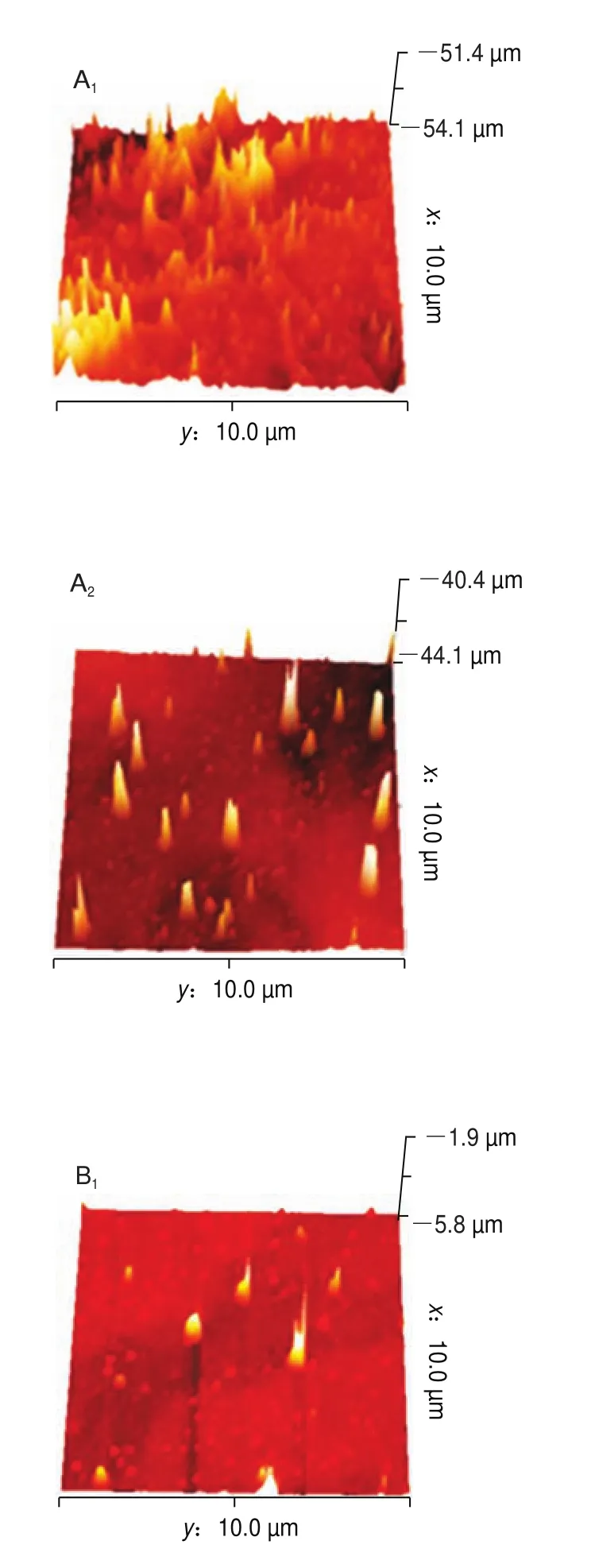
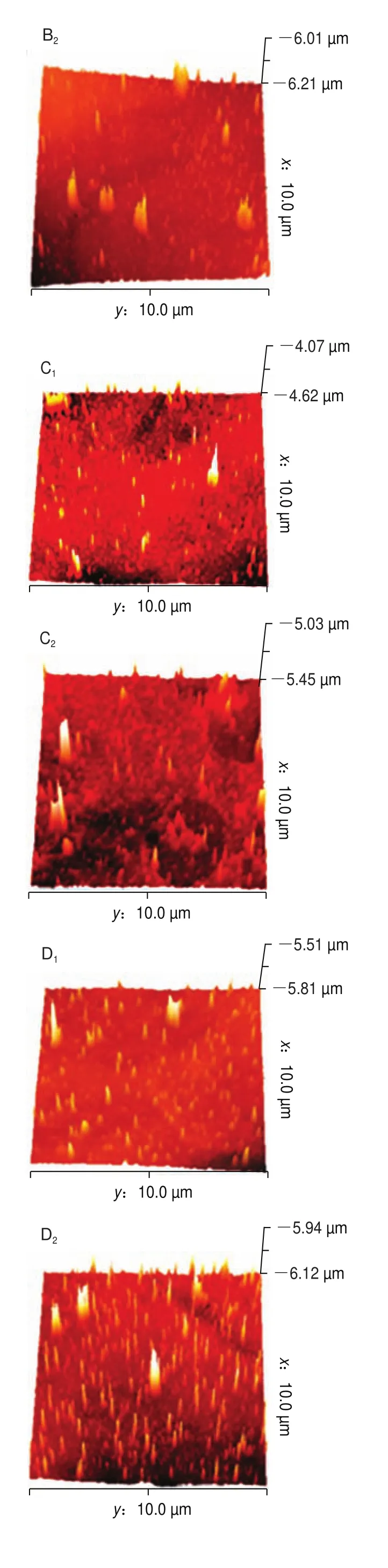
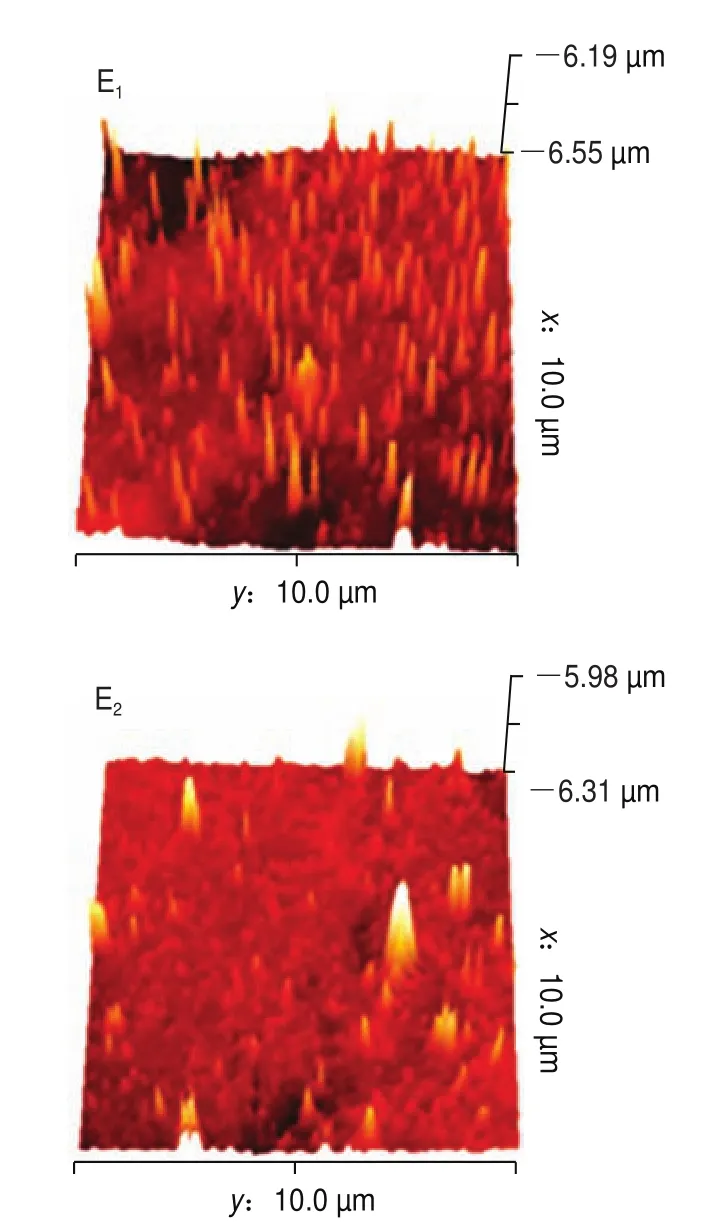
图6 超声波辅助下肌原纤维蛋白AFM三维成像图Fig.6 Three-dimensional AFM images of myofibrillar protein subjected to ultrasonic treatment
3 结 论
超声波辅助处理下,随着没食子酸添加量的增加,肌原纤维蛋白的凝胶强度、硬度、化学作用力、微观结构等得到显著改变。随没食子酸添加量的增加,没食子酸处理的肌原纤维蛋白凝胶强度、硬度、咀嚼性呈先上升后降低的趋势,当没食子酸的添加量为2 mg/g时,凝胶强度、硬度、咀嚼度最大,此时不易流动水峰面积比例最高,自由水峰面积比例最低,持水性最高,蒸煮损失率最低;肌原纤维蛋白二硫键含量随着没食子酸添加量的增加显著上升(<0.05);微观结构随没食子酸添加量的增加变得更加致密,孔隙较小,形成的凝胶性能更好。综上,超声波辅助没食子酸可以提高海鲈鱼肌原纤维蛋白的凝胶性能。同时,需要对没食子酸的添加量进行控制,因为适量的没食子酸可以提高蛋白凝胶性能,但是没食子酸的添加量过高时,会对凝胶产生不利影响,使其品质下降。

