水力空化对大豆分离蛋白谷氨酰胺转氨酶促凝胶行为的影响
李晓惠,任仙娥*,杨 锋,黄永春,黄承都,张昆明,刘纯友
(广西科技大学生物与化学工程学院,广西糖资源绿色加工重点实验室,广西高校糖资源加工重点实验室,广西 柳州 545006)
大豆分离蛋白(soy protein isolate,SPI)是从低温脱脂豆粕中除去碳水化合物和灰分等,得到的蛋白质量分数大于90%(干基)的全价蛋白。具有来源广泛、价格低廉、营养价值高等特点,是一种应用广泛的食品基料。SPI具有良好的凝胶性、乳化性和持水性等功能特性,尤其凝胶性受到广泛关注,利用这一特性可以改善豆腐、豆干和豆腐脑等传统豆制品的感官和质构,将其应用到火腿肠和香肠等肉制品中,能够起到保水和稳定脂肪的重要作用。
谷氨酰胺转氨酶(transglutaminase,TG)是一种细胞外催化转移酶,可催化蛋白质分子间和分子内的谷氨酰胺和赖氨酸残基发生催化酰基转移反应、脱酰胺反应和交联聚合反应。酶促反应可使食品中蛋白质的结构发生变化,改善凝胶性能,提高凝胶强度。酶促反应条件温和,还可以通过诱导含有互补限制性氨基酸结构的异源蛋白间的交联来生产具有更高营养价值的蛋白产品。
空化技术作为新兴的物理改性技术,受到了国内外研究学者的关注,主要方式为超声空化和水力空化两种。相比较于超声空化,水力空化的能量利用率更高,产生的空化场更均匀,更具有工业化优势。在空化过程中空化泡的溃灭产生瞬时的局部高温高压,并伴随着高速剪切力、强冲击波、高速湍流等,可以促进一些化学反应的发生。白银等研究发现随射流空化处理时间的延长,SPI溶解性、乳化性、持油性以及表面疏水性均显著提高。Li等研究发现水力空化处理可以使浓缩乳蛋白的流变性质得到改善,降低浓缩乳蛋白的黏度,提高乳粉喷雾干燥的效率。Meletharayil等研究发现水力空化可改善希腊酸奶的流变特性和微观结构。课题组前期研究结果表明,水力空化处理能改变SPI的理化和结构性质,如溶解性增加、表面疏水性增加,还会改变其二级结构。这些理化和结构性质的改变可能会使其凝胶行为发生改变,但是关于水力空化对蛋白质凝胶行为的影响研究还鲜有报道。基于此,本实验采用基于涡流的水力空化来处理SPI,再在TG的催化作用下制备凝胶,分析SPI经水力空化处理后其酶促凝胶行为的变化规律和机理,为有效调控大豆蛋白凝胶制品的品质提供理论依据,同时为将水力空化应用到食品工业提供参考。
1 材料与方法
1.1 材料与试剂
SPI(蛋白质量分数≥90%) 山东禹王生态食品有限公司;TG(酶活力为100 U/g) 江苏泰兴市东圣生物科技有限公司;其他化学试剂均为分析纯。
1.2 仪器与设备
JXN-26冷冻高速离心机 美国贝克曼库尔特股份有限公司;DF-101S恒温加热磁力搅拌器 河南予华仪器有限公司;MCR 72流变仪 奥地利Anton Paar有限公司;GSL-1010全自动激光颗粒分布测量仪 辽宁仪表研究所有有限责任公司;TA-XT plus质构分析仪 英国Stable Micro System公司;UV-2600紫外-可见分光光度计 岛津仪器(苏州)有限公司;AE2204电子分析天平 湘仪天平仪器设备有限公司;HY-4调速振荡器长沙创满电子科技有限公司;AlpHal-4LDpus真空冷冻干燥机 德国CHRIST公司;Phenom ProX扫描电子显微镜上海复纳科学仪器有限公司;iS10红外光谱仪 美国尼力高仪器公司;水力(涡流)空化装置 实验室自制。
1.3 方法
1.3.1 水力空化处理SPI
用去离子水配制质量浓度分别为60、80、100 g/L的SPI分散液,磁力搅拌2 h使其充分溶解。将不同质量浓度的SPI分散液倒入水力(涡流)空化装置的分散液贮箱中,开启冷凝水,控制整个处理过程中SPI分散液的温度不超过40 ℃,开启涡流泵,调节压力为0.4 MPa,分别处理10、20、30、60 min后取样测定其粒径、黏度并进行酶促凝胶制备。
1.3.2 SPI分散液粒径的测定
参考文献[13]的方法,使用GSL-1010全自动激光颗粒分布测量仪测定SPI样品的粒径。SPI样品的折射率和吸收参数分别为1.450和0.001。将SPI样品加入去离子水中,调整遮光率为20%~25%,测量样品的粒径分布情况和体积平均粒径()。
1.3.3 SPI分散液黏度的测定
参考文献[14]的方法,使用MCR 72流变仪进行SPI黏度的测定,选择直径50 mm的平板进行SPI样品剪切速率扫描。设定剪切速率范围为10~1 000 s,记录黏度随剪切速率的变化情况。
1.3.4 酶促凝胶的制备
参考文献[15]的方法向1.3.1节制得的样品以及未经过水力空化处理的SPI样品中加入TG(添加量为3 g/L),于37 ℃水浴中保温2 h后,取出置于4 ℃冰箱中,静置8~12 h,测定样品的凝胶性质。
1.3.5 凝胶强度的测定
参考文献[16]的方法,使用质构分析仪对1.3.4节制得的凝胶样品进行凝胶强度的测定。使用P/0.5探头,设定测前速度为5 mm/s,穿刺和测后速度为1 mm/s,压缩距离为10 mm,触发力为5.0 g。凝胶强度为下压至10 mm时的最大力。
1.3.6 凝胶持水性的测定
参考文献[17]的测定方法,分别准确称取5 g 1.3.4节制得的凝胶样品于离心管中,记录离心管和凝胶样品的总质量,8 000 r/min离心20 min,取出离心管,将其倒置使水分排干,用滤纸擦干离心管内外的残留液体,记录此时的总质量,按下式计算持水性。

1.3.7 凝胶形成过程的流变学特性测定
参考文献[18]的方法并稍作修改。使用流变仪进行模拟凝胶形成实验,选择直径为50 mm的平板,设置间隙为1 mm,应变为0.5%,角频率为1 Hz。平板间充满样品后刮去多余的样品,为了防止水分蒸发,在样品周围滴2~3 滴植物油。实验中的温度扫描由加热阶段、恒温阶段和降温阶段组成,即由2 ℃/min的速率从25 ℃升温至37 ℃并保温2 h,再以2 ℃/min的速率从37 ℃降温至25 ℃,测定储能模量(′)和损耗模量(″)随温度和时间的变化。
1.3.8 凝胶分子间作用力的测定
参照文献[19-20]的方法,通过不同溶剂破坏SPI凝胶形成过程中的分子作用力,NaCl溶液(0.6 mol/L)可破坏离子键,低浓度(1.5 mol/L)尿素可破坏氢键,高浓度(8 mol/L)尿素可破坏疏水相互作用,而-巯基乙醇(0.5 mol/L)会破坏二硫键。将1.3.4节制得的凝胶样品用大蒜压制器压碎后,采用逐级溶解法测定4种不同溶剂(S1:0.6 mol/L NaCl;S2:1.5 mol/L尿素+0.6 mol/L NaCl;S3:8 mol/L尿素+0.6 mol/L NaCl;S4:0.5 mol/L-巯基乙醇+8 mol/L尿素+0.6 mol/L NaCl)中溶解的凝胶的蛋白质含量,分别以溶解于S1~S4的蛋白质含量占总蛋白质含量的比例来表征凝胶中离子键、氢键、疏水相互作用和二硫键的相对含量,经S4提取后最终所得沉淀的蛋白质含量占总蛋白质含量的比例表示非二硫共价键的相对含量。具体操作步骤和计算方法参考文献[12]。
1.3.9 扫描电子显微镜观察
参考文献[21]的方法,将1.3.4节制得的80 g/L SPI酶促凝胶样品冷冻干燥后进行喷金,电压为10 kV,用Phenom ProX扫描电子显微镜进行微观结构观察。
1.3.10 傅里叶变换红外光谱分析
参考文献[22]的方法,将1.3.4节制得的80 g/L SPI凝胶样品冷冻干燥,与KBr粉末混合研磨,将混合粉末压制成薄片,使用红外光谱仪进行全波段扫描,设置分辨率为4 cm,扫描次数32 次,测量范围为4 000~400 cm。
1.4 数据处理与分析
实验设置3个平行,结果以平均值±标准差表示。使用SPSS 26软件对数据进行统计分析,采用单因素方差分析确定统计学差异,采用Duncan多重比较进行显著性分析,<0.05表示差异显著。
2 结果与分析
2.1 水力空化对SPI粒径的影响
水力空化对不同质量浓度SPI分散液粒径分布的影响如图1所示,未经水力空化处理的SPI样品显示出相对较宽的粒径分布范围,且具有更多更大尺寸的粒子。经过水力空化处理后的SPI粒径分布明显变窄,且分布峰向较小粒径方向移动较大。由图2可知,水力空化处理使SPI的体积平均粒径显著降低(<0.05),并且在处理30 min内,平均粒径随着处理时间的延长而不断降低。这说明空化过程中产生的剪切力或冲击波等空化效应能破坏蛋白分子间的相互作用,使大的聚集体解聚,粒径降低。但是当处理时间延长至60 min后,粒径又有所增加,这可能是因为长时间空化处理促进蛋白发生了聚合。胡昊采用超声波处理SPI时也观察到类似现象。


图1 水力空化对SPI分散液粒径分布的影响Fig.1 Effect of HC on particle size distribution of SPI

图2 水力空化对SPI粒径的影响Fig.2 Effect of HC on particle sizes of SPI
2.2 水力空化对SPI分散液黏度的影响
由图3可知,在10~1 000 s的剪切范围内,所有样品的黏度都随着剪切速率的增加而不断降低,表现出典型剪切变稀的非牛顿流体特征。在相同剪切速率下,经水力空化处理后的SPI黏度均比未处理的低,并且在空化处理30 min内,黏度随着处理时间的延长而降低,这主要是因为空化过程中产生的局部高温、高压、剪切或冲击波等空化效应使SPI中的聚集体解聚,粒径降低,黏度减小。当空化处理时间延长至60 min后,SPI的黏度又有所增加,这可能是因为长时间的空化处理引起了蛋白颗粒的重新聚集,使其粒径增大,黏度增加。刘冉等使用超声波处理SPI分散液时也发现超声波能使SPI粒径减小,黏度降低,但是SPI黏度并没有随着超声功率的增加而一直降低,当使用较大功率(400、600 W)处理时SPI重聚集,黏度反而增大。
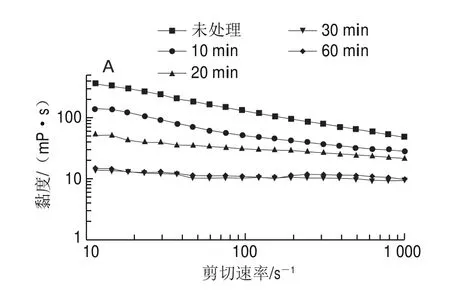

图3 水力空化对SPI分散液黏度的影响Fig.3 Effect of HC on the viscosity of SPI dispersion
2.3 水力空化对SPI酶促凝胶强度的影响
水力空化处理对不同质量浓度SPI酶促凝胶强度的影响如图4所示。在相同处理时间下,凝胶强度随着SPI质量浓度的增加而显著增强(<0.05),这与臧学丽等的研究结果一致。这是因为随着蛋白质量浓度增加,SPI与TG作用的机率增加,更多的SPI分子在TG的作用下发生交联反应,促进了凝胶网络的形成。另外,蛋白质量浓度的增加也促进了蛋白分子之间的相互作用,也有利于凝胶网络的形成。由图4可知,水力空化处理能增加SPI酶促凝胶的强度。这是因为一方面,SPI经水力空化处理后黏度下降,TG能更好地分散到SPI分散液中,有利于TG与蛋白分子的充分接触,促进蛋白分子中赖氨酸残基和谷氨酰胺残基交联反应的发生;另一方面,前期研究结果表明,SPI经水力空化处理后粒径减小,溶解性增大,表面疏水性增加,蛋白分子的结构变得更加松散,这就使得原本埋藏在分子内部的赖氨酸残基和谷氨酰胺残基暴露出来,增加了TG的作用位点,二者在TG的作用下发生交联反应,形成了蛋白质凝胶网络结构。Hu Hao等研究发现SPI经超声处理后,其粒径减小、表面疏水性和游离巯基含量增加,形成的凝胶强度明显增加。另外,当水力空化处理时间延长至60 min时,SPI所形成的凝胶强度相比30 min有所降低,这可能是过长时间的处理使得SPI重聚集,分散液的黏度又开始增大引起的。

图4 水力空化对SPI酶促凝胶强度的影响Fig.4 Effect of HC on gel strength of transglutaminase-catalyzed SPI gel
2.4 水力空化对SPI酶促凝胶持水性的影响
由图5可知,未经水力空化处理的SPI形成的酶促凝胶持水性随SPI质量浓度的增加而增加,当SPI质量浓度分别为60、80、100 g/L时,凝胶的持水性分别为(42.15±0.87)%、(58.49±1.39)%、(70.26±1.21)%,表现为凝胶经离心后均有不同量的水渗出。水力空化处理使SPI酶促凝胶的持水性显著增加(<0.05)。经水力空化处理20 min后的SPI酶促凝胶经离心后基本没有水渗出,持水性接近100%。这可能是因为经过水力空化处理后的SPI形成的酶促凝胶强度增加,空间结构更加致密、均一,能将水分子更好地束缚在凝胶内部。Zhang Peipei等也发现超声空化可以提高SPI酶促凝胶的持水性,超声空化可以有助于形成更均匀、更致密的凝胶网络,可以紧密结合更多的水,因此导致持水性增加。
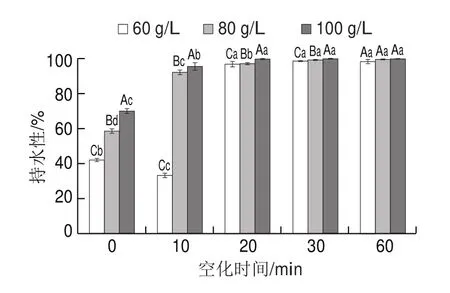
图5 水力空化对SPI酶促凝胶持水性的影响Fig.5 Effect of HC on water-holding capacity of transglutaminasecatalyzed SPI gel
2.5 水力空化对SPI酶促凝胶流变学性质的影响
储能模量(’)又称为弹性模量,代表黏弹行为的弹性部分,描述的是样品的固态特性;损耗模量(”)又称黏性模量,代表黏弹行为的黏性部分,描述的是样品的液态特性。’>G”说明样品表现出黏弹性固体的特性,’<”则说明样品表现黏弹性流体的特性。SPI质量浓度为60 g/L时的凝胶曲线如图6A所示。未经水力空化处理和经水力空化处理10 min的SPI在整个过程中,’一直小于”,表现出黏弹性流体的特性,说明凝胶未形成。经空化处理20、30、60 min的SPI分别在7 603、4 615、4 399 s时’=”,说明凝胶网络开始形成,之后’和”继续增加,表明凝胶网络结构在加强,整个过程结束后,最终形成凝胶的’分别达到2.81、11.52、7.12 Pa。SPI质量浓度为80 g/L和100 g/L的凝胶曲线分别如图6B、C所示,这两个质量浓度下未处理的SPI由于黏度大,一开始’就大于”,表现出黏弹性固体的特性,但是在整个过程中,’和”都没有随着温度的变化和时间的延长而明显增加。80 g/L的SPI经水力空化处理不同时间后,黏度降低,一开始’<”,表现出黏弹性液体的特性,在升温和保温过程中’和”一直随着温度的变化和时间的延长而逐渐增加,经空化处理10、20、30、60 min的SPI分别在6 847、2 383、727.5、871.5 s时’=”,说明凝胶网络结构开始形成,此后’和”继续增加,在整个过程结束后,最终形成的凝胶的’值分别为24.76、82.28、1 384.70、726.23 Pa,其中经水力空化处理30 min的SPI形成凝胶的’值高于未处理的’值。100 g/L的SPI经水力空化处理后凝胶形成过程中的流变学性质与80 g/L的类似,经空化处理10、20、30、60 min的SPI分别在1 592、1 543、205.5、439.5 s时’=”,最终形成的凝胶的’值分别为96.14、128.90、14 304.00、3 394.90 Pa,其中经水力空化处理30 min和60 min的SPI形成凝胶的’值均高于未处理的’值。由此可见,SPI经水力空化处理后的成胶的蛋白质量浓度降低,成胶时间随着蛋白质量浓度的增加而提前,并且各个质量浓度的SPI经水力空化处理30 min后,所形成凝胶的’相比未处理的均明显增加。Shen Xue等研究发现相对未处理样品,超声处理(20 KHz,20 min)的乳清蛋白在流变模拟凝胶形成过程中’和”显著增大。Gregersen等的研究结果表明,超声处理牛奶后导致开始形成酸促凝胶时间显著缩短,还引起最终’的显著增大。


图6 水力空化对SPI酶促凝胶G’和G”的影响Fig.6 Effect of HC on G’ and G” of transglutaminase-catalyzed SPI gel
此外,需要说明的是,流变学测试结果与凝胶强度结果基本一致,但不是一一对应的,如80 g/L的SPI经水力空化处理20 min和60 min后的凝胶强度显著高于未处理组(<0.05),但是其’值却小于未处理组。这可能是在测定流变特性和凝胶强度时施加在样品上的力的类型不同造成的。’值是通过流变仪在保证形变的线性范围内给予蛋白质样品的剪切压力,它对样品的结构没有破坏。而凝胶强度是使用测试仪的探针对样品进行的穿刺破坏性测试,它涉及探针与样品之间的压缩力和剪切力,还与蛋白凝胶网络中的填充物有关,因此’并不总是代表凝胶强度。
2.6 水力空化对SPI酶促凝胶分子间作用力的影响
由于水力空化对60、80、100 g/L SPI形成的酶促凝胶的强度、持水性和流变特性的影响趋势大致相同,因此选取了中间质量浓度80 g/L的SPI酶促凝胶来继续研究凝胶的分子间作用力、微观结构和二级结构的变化,从而探讨水力空化对SPI酶促凝胶行为的影响机制。由表1可知,未经空化处理的SPI形成的酶促凝胶中分子间作用力以非二硫共价键和离子键为主,疏水相互作用和二硫键次之,氢键所占比例较小。经过空化处理后的SPI形成的酶促凝胶中,二硫键和非二硫共价键相对含量显著增加(<0.05),成为凝胶形成的主要分子间作用力,而离子键、氢键和疏水相互作用相对含量均显著降低(<0.05)。前期研究结果表明,SPI经水力空化处理后粒径减小,溶解性增大,表面疏水性增加,蛋白分子的结构变得更加松散,这就使得更多的赖氨酸残基和谷氨酰胺残基暴露出来,二者在TG的作用下交联形成-(-谷氨酰基)-赖氨酸共价结合键,使凝胶中非二硫共价键的相对含量增加,有利于凝胶网络结构的形成。此外,前期研究结果还表明,水力空化处理能使SPI中的二硫键断裂,蛋白分子结构展开,游离巯基含量增多,这就导致在TG诱导蛋白分子交联形成凝胶网络结构的同时,巯基互相靠近再形成二硫键,使凝胶中二硫键的相对含量增加,进一步促进凝胶网络的形成。金杨等研究发现随着凝固温度的升高,填充豆腐的二硫键相对含量增多,与填充豆腐的硬度和弹性显著正相关。Jia Dan等研究发现通过添加TG,鲤鱼肌动球蛋白凝胶中非二硫键含量大大提高,凝胶强度、持水性及’显著增大。结合前面凝胶强度和持水性的结果来看,经水力空化处理后的SPI形成的酶促凝胶强度和持水性增加,这与凝胶中二硫键和非二硫共价键相对含量的增加有关。

表1 水力空化对80 g/L SPI酶促凝胶分子间作用力的影响Table 1 Effect of HC on intermolecular forces of transglutaminasecatalyzed gel from 80 g/L SPI
2.7 水力空化对SPI酶促凝胶微观结构的影响
采用电子扫描显微镜放大300 倍观察80 g/L的SPI在水力空化处理前后所形成的酶促凝胶微观结构的变化。如图7所示,经过水力空化处理后的SPI形成的凝胶微观结构与未处理组有明显差异。未处理的SPI形成了松散、孔洞大小不一、无规则的凝胶网络结构,经水力空化处理20 min后的SPI形成的凝胶网络结构相对紧凑,经水力空化30 min和60 min后形成的SPI凝胶网络,结构变得更加致密、孔洞较小而且均匀。出现这种现象的原因是由于水力空化显著降低了蛋白粒径,增加了暴露于蛋白表面的活性基团,促进TG交联反应形成更加均匀致密的凝胶结构。致密均匀的凝胶网络结构更加有利于水分的截留,提高持水性,这与前面持水性的研究结果一致。Zhang Peipei等发现通过高强度超声空化处理SPI形成的TG酶促凝胶的微观结构变得致密、均匀,并显著提高了SPI酶促凝胶的凝胶强度、保水能力。

图7 水力空化对80 g/L SPI酶促凝胶微观结构的影响Fig.7 Effect of HC on microstructure of transglutaminase-catalyzed gel from 80 g/L SPI
2.8 水力空化对SPI酶促凝胶二级结构的影响
SPI酶促凝胶样品在4 000~400 cm范围内的傅里叶变换红外光谱如图8所示。SPI酶促凝胶的酰胺I带二阶导数光谱图如图9所示。采用Omnic 8.3和 Peakfit 4.12 软件进行分析,包括在酰胺I带(1 700~1 600 cm)范围内进行两点基线校正、平滑处理、去卷积、作二阶导数,同时采用Gaussian法进行多次曲线拟合,最后将拟合出的子峰归属给蛋白的4种二级结构,并通过计算各子峰面积百分比推导蛋白样品的二级结构组成。各子峰与二级结构对应关系:1 600~1 640cm为-折叠,1 650~1 660 cm为-螺旋,1 640~1 650 cm为无规卷曲,1 660~1 700 cm为-转角。不同处理80 g/L SPI酶促凝胶二级结构的相对含量如表2所示。

图8 80 g/L SPI酶促凝胶的傅里叶变换红外光谱Fig.8 Fourier transform infrared spectra of transglutaminasecatalyzed gel from 80 g/L SPI

图9 80 g/L SPI酶促凝胶的酰胺I带二阶导数光谱图Fig.9 Second-derivative amide I spectra of transglutaminase-catalyzed gel from 80 g/L SPI
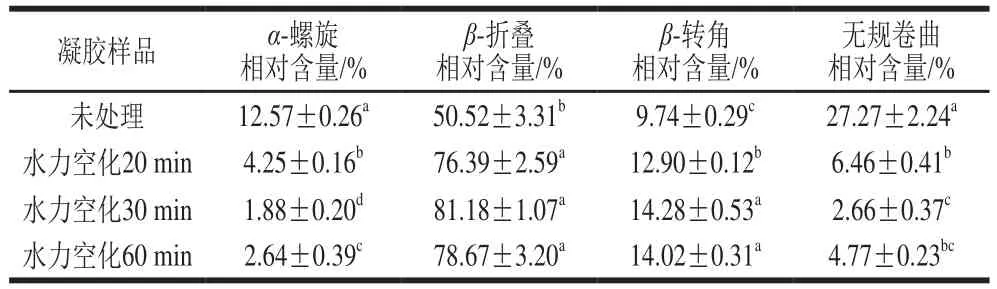
表2 水力空化对80 g/L SPI酶促凝胶二级结构的影响Table 2 Effect of HC on secondary structure of transglutaminasecatalyzed gel from 80 g/L SPI
由表2可知,经过水力空化处理后的SPI酶促凝胶二级结构中的各个组成的含量发生明显变化。与未处理的样品相比,经过水力空化处理后的SPI酶促凝胶-折叠、-转角结构相对含量显著增加,-螺旋、无规卷曲结构相对含量显著降低,表明-螺旋、无规卷曲结构转化成-折叠、-转角结构。-螺旋结构相对含量减少一般伴随着氢键相对含量的降低,-折叠相对含量升高表明蛋白质疏水相互作用降低,这与前文分子间作用力测定结果一致。无规卷曲相对含量的降低,说明凝胶二级结构从无序向有序转变,这与凝胶的微观结构结果相印证。Herrero等研究发现,蛋白质-折叠和-转角的相对含量与形成的凝胶强度显著正相关,可见经水力空化处理后的SPI酶促凝胶强度的增加还与凝胶二级结构中-折叠和-转角相对含量的增加有关。
3 结 论
SPI经水力空化处理后形成的酶促凝胶微观结构更加致密均匀;二级结构中-螺旋、无规卷曲相对含量降低,-折叠、-转角相对含量增加;凝胶形成过程中的分子间作用力也发生变化,二硫键和非二硫共价键的相对含量增加,成为凝胶形成的主要分子间作用力,而离子键、氢键相对含量和疏水相互作用均降低。这些凝胶结构和分子间作用力的变化,使得经水力空化处理后的SPI形成的酶促凝胶持水性、凝胶强度和最终的’增大,其中以处理30 min后形成的酶促凝胶最大。结果表明,一定时间的水力空化处理可以改善SPI酶促凝胶的性能,可为预测和控制大豆蛋白凝胶的性能和工艺优化提供理论指导。

