生物大分子药物无创眼内递送研究进展
熊殷,樊星砚,王亦凡,魏刚,
(1. 复旦大学药学院, 教育部智能化递药重点实验室, 上海 201203;2. 复旦大学中西医结合研究院,上海200040;3. 上海市免疫治疗工程研究中心,上海201203)
眼睛是感知世界最重要的器官。眼部疾病如得不到及时有效的治疗将影响视力,特别是眼内疾病具有导致失明的风险,为患者的生活带来不便和痛苦。据世界卫生组织2019年发布的《世界视觉报告》,全球至少有22亿人视力受损,其中至少有10亿人的视力损伤本可预防或尚可治愈[1]。由于眼睛具有高度的敏感性和复杂的保护机制,眼内药物递送面临着巨大的挑战。但眼睛具有免疫豁免特性,与其他器官相比,多肽、蛋白以及基因一类的生物大分子药物更适合用于眼内疾病的治疗。与小分子药物相比,生物大分子药物的优势在于其药理活性更强,具有高效力和高特异性。如雷珠单抗、阿柏西普、康柏西普等生物大分子药物用于治疗老年黄斑变性等新生血管性眼底疾病的效果显著。对于目前尚无药可医的致盲性眼部遗传疾病,基因治疗与生物大分子药物更是为患者带来了保留视力的希望。然而,生物大分子药物通常具有相对分子质量大,结构复杂,亲水性强等特点,难以跨越生物屏障;且其稳定性差,体内半衰期短,进一步为其制剂设计增加了难度[2-3]。对于眼科疾病的治疗,滴眼给药一直是最容易被患者接受的给药方式。但是由于眼部存在诸多吸收屏障,生物大分子药物几乎无法通过滴眼给药的方式渗透入眼内[4]。目前这一类药物需要采取眼内注射的方式给药,患者顺应性差,且易引起多种并发症。因此,眼科临床亟需新型的无创给药系统,有效地将这些生物大分子药物靶向递送至眼内病灶部位。
理想的生物大分子药物眼部递送系统应具备以下特征:1)能穿透眼部吸收屏障,将大分子药物靶向递送至眼内病灶部位,并能滞留较长时间;2)能提高生物大分子药物的稳定性,保护其不被各种酶等降解;3)给药方式具有无创性,有较好的患者顺应性,最大程度减少给药引发的副作用;4)能实现控释或缓释,以维持药物的有效治疗浓度,减少给药频率等。近年来已经有许多研究者借助胶束、脂质体等纳米递药系统,或者吸收促进剂细胞穿膜肽,以及一些物理手段实现了大分子药物的眼内递送,特别是通过滴眼给药的方式将有效浓度的蛋白药物或基因药物递送至眼底病灶部位,在动物模型体内抑制了脉络膜新生血管、眼内肿瘤等复杂眼底疾病的进程,为实现眼底疾病的无创治疗带来了曙光。
1 眼部疾病概述
眼球的解剖结构以晶状体为界可分为眼前段和眼后段(见图1)。眼前段包括角膜、结膜、虹膜、睫状体、房水和晶状体,眼后段则包括巩膜、脉络膜、视网膜及玻璃体。其中,角膜、结膜和巩膜包裹在眼球的最外层,阻碍外源性物质进入,使眼球成为一个相对封闭的器官。
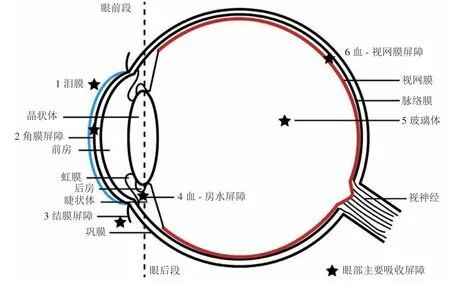
图1 眼球解剖结构Figure 1 Anatomical structure of eyeball
与眼球结构相对应,眼部疾病可根据病变部位分为眼前段疾病和眼后段疾病。角膜炎及结膜炎(俗称红眼病)是典型的眼前段疾病,一般由细菌、真菌或病毒等微生物引起。其他常见的眼前段疾病还包括干眼症(也称角结膜干燥症)、白内障、角膜新生血管、糖尿病性角膜病变等。以视网膜中央黄斑区退行性病变为特征的老年性黄斑变性,即年龄相关性黄斑变性(age-related macular degeneration,ARMD)是最常见的眼后段疾病,可分为干性和湿性黄斑变性,后者与新生血管相关,表现为视力迅速下降,病情发展较快,易引起失明[5]。眼后段疾病还包括糖尿病性视网膜病变、糖尿病性黄斑水肿、视网膜炎、增生性玻璃体视网膜病变、视网膜母细胞瘤及脉络膜黑色素瘤等。此外,葡萄膜炎、青光眼等疾病累及整个眼球,同时影响眼前段和眼后段组织[6]。
2 治疗眼部疾病的生物大分子药物
生物大分子药物指采用生物技术获得的细胞、微生物,以及各种动物或人源组织等生物材料制备的用于人类疾病预防、治疗和诊断的药品,包括多肽类药物、单克隆抗体(单抗)和重组蛋白等蛋白质类药物以及核酸类药物等。在过去的几十年中,结构生物化学、基因工程、药物制剂等领域都取得了重大突破,从而促进了生物大分子药物的临床应用,包括治疗各种眼部疾病。2020年全球销售额排名前100(TOP 100)的药品中,包括单抗、抗体偶联药物、重组蛋白在内的大分子药物共42个,销售额占比49%。目前已上市用于治疗眼部疾病的生物大分子药物见表1。其中,阿柏西普属于重组融合蛋白,于2011年被美国FDA批准上市。该药物作为血管内皮生长因子A(vascular endothelial growth factor A,VEGF-A)的诱骗受体,防止VEGF-A与相应的受体VEGFR-1及VEGFR-2结合,从而抑制新生血管生成,并降低血管通透性,临床上可用于治疗湿性老年性黄斑变性及黄斑水肿[7]。阿柏西普2020年全球销售额达79.09亿元,位列TOP 100榜单第5名。奥克纤溶酶是首个获批用于治疗玻璃体黄斑粘连的眼科药物,作为一种重组蛋白酶,通过降解玻璃体和视网膜交界面的蛋白使两者之间的粘连分离,进而避免导致黄斑裂孔[8]。单抗类药物阿达木单抗连续数年蝉联全球药品销售额冠军。其为抗肿瘤坏死因子α(tumor necrosis factor α,TNF-α)药物,于2016年获批用于非感染性葡萄膜炎的治疗,是首个也是目前唯一可用于治疗葡萄膜炎的非糖皮质激素药物[9]。

表1 美国和中国已上市用于治疗眼部疾病的生物大分子药物Table 1 Biomacromolecules approved in US and China for ophthalmologic application
3 眼部吸收屏障与给药途径
如图1所示,眼部存在多种吸收屏障,主要包括角膜屏障、结膜屏障、血-房水屏障(bloodaqueous barrier,BAB)、血-视网膜屏障(blood-retina barrier,BRB)、泪液清除等。图2展示了滴眼给药后药物吸收进入眼内的2条主要途径,分别为角膜途径和结膜-巩膜途径。经眼表滴入给药后,泪液膜是药物吸收的第一道屏障。泪液更新的速率大约为1 μL · min-1,加之眨眼清除与鼻泪管引流,多数药物在数分钟之内从眼表流失[10-11]。经鼻泪管引流进入体循环的药物还可能产生全身毒性和副作用。致密的疏水性角膜上皮层是局部滴眼给药后药物吸收的主要屏障,相对分子质量大、亲水性的药物很难透过,而亲脂性药物的透过又受限于角膜的亲水性基质层。因此,药物的角膜渗透能力与其亲脂性呈抛物线关系,对数油水分配系数(LogP)在2.0 ~ 2.5区间的药物通常具有较好的角膜渗透速率[12]。结膜上皮除具有紧密连接外,还分布有毛细血管和毛细淋巴管,可阻碍外源性物质进入眼内[6,11]。相较于角膜,巩膜组织的结构更为疏松,亲水性及相对分子质量较大的药物易通过此途径吸收入眼。此外,眼前段还有BAB,由睫状体的无色素睫状上皮细胞与虹膜毛细血管的内皮细胞组成,阻碍药物经虹膜血管进入眼内。玻璃体液富含胶原蛋白、透明质酸等物质,具有黏弹性,大分子药物不易从玻璃体扩散至视网膜。携带正电荷的药物还会与带负电荷的透明质酸或胶原蛋白结合,进一步阻碍其扩散[10]。BRB外侧的视网膜色素上皮细胞之间及其内侧的视网膜毛细血管内皮细胞之间同样具有紧密连接,有效限制了药物分子通过脉络膜血液循环向眼后段运输,只有部分亲脂性的小分子药物可少量透过。

图2 滴眼给药后药物的眼部吸收途径Figure 2 Ocular absorption routes after topical instillation
上述眼部吸收屏障一方面保护眼睛不受外来异物的影响,但另一方面也给药物的眼内递送,特别是眼后段药物递送带来了困难。生物大分子药物可通过滴眼、局部注射及全身给药方式应用。传统滴眼液的眼部生物利用度一般小于5%,大分子药物的吸收则更少[13]。目前眼部应用的生物大分子药物,除了赛奈吉明直接作用于角膜表面外,其他治疗眼后段疾病的生物大分子药物均采用眼内注射(包括玻璃体内注射和视网膜下腔注射)的方式给药(见表1)。眼内注射给药的优势在于可绕过眼前段吸收屏障,使药物直达眼内。然而,眼内注射是一种高侵入性的给药方式,不仅对给药技术的要求较高,还易引发眼部出血、疼痛、眼内压升高、视网膜脱落、白内障、眼内炎等并发症,且频繁注射导致患者的顺应性差[14]。此外,视网膜下腔注射、脉络膜上腔注射等给药方式虽然可绕过结膜和巩膜屏障,在病灶部位达到更高的治疗浓度,但给药操作难度更大,同时也具有更大的风险[6,15]。除阿达木单抗和替妥木单抗通过全身作用发挥药效外,治疗眼部疾病通常不采用全身给药。这是因为BRB使药物难以经此途径渗透入眼,生物利用度极低,仅有1% ~ 2%的药物可到达玻璃体,且易导致全身副作用[16]。因此,滴眼给药仍是患者最乐于接受的给药方式,但需要借助有效的递送系统改善眼部生物利用度,提高疗效及安全性,才能解决生物大分子药物无创眼内递送的难题。
4 多肽蛋白类药物的无创眼内递送
近年来,研究者不断尝试利用胶束、脂质体等纳米递药系统或细胞穿膜肽等吸收促进剂通过滴眼给药将多肽蛋白类药物递送入眼,并在大分子药物的眼后段递送方面取得了一定突破。
4.1 胶束载体
胶束是两亲性嵌段共聚物在水中自组装形成的一种热力学稳定的胶体溶液。将胶束作为眼部药物递送载体的优势在于:1)具有黏膜黏附特性的聚合物胶束可延长药物在眼表的滞留时间,不易被眨眼或泪液清除;2)粒径较小,通常小于100 nm,有利于渗透进入眼部组织;3)可将疏水药物包载于胶束内核以起到增溶作用,且形成的水性溶液澄清透明,不会干扰视力;4)可缓慢释放药物;5)增加药物的稳定性,提高药效,减少副作用[17]。
胶束的特性使其适合作为多肽类药物滴眼给药的载体,与传统的溶液、混悬或乳剂型滴眼剂相比,其在药效与舒适性方面有更好表现。环孢素A(cyclosporine A,CsA)是由11个氨基酸组成的环状多肽,属于免疫抑制剂,临床上可用于治疗干眼症。由于CsA水溶性差(12 mg · L-1,25℃),难以配制成有效浓度的溶液型滴眼剂[18]。2003年,CsA眼用乳剂Restasis(质量分数为0.05%)被FDA批准上市。该产品处方中应用蓖麻油为油相,吐温和甘油为乳化剂,易产生眼部烧灼感、结膜充血、刺痛等不良反应[19]。Di Tommaso等[20]采用甲氧基聚乙二醇和己基取代聚乳酸制备0.05% CsA胶束,粒径为(35±1)nm,所得溶液澄清透明,利用胶束增溶特性克服了CsA溶解度差的问题,可更好地被眼部耐受,提高患者用药的舒适度。同时,CsA胶束溶液连续5 d每天滴眼给药2次,测得每克大鼠角膜中含CsA(1 540±400)ng,显著高于市售乳剂药物Restasis组,其原因在于前者可作为药物贮库缓慢释放。胶束溶液剂和乳剂组血浆中的CsA质量浓度均低于检测限,可避免CsA的全身性副作用[20]。Cholkar等[21]采用优化比例(1∶0.05)的氢化蓖麻油40和辛基酚聚醚40制备0.1% CsA纳米胶束,同样得到澄清透明的水溶液,平均粒径为22.4 nm。值得一提的是,该纳米胶束每日4次(每次间隔2 h)连续滴眼给药5 d后,不仅在眼前段组织有较高的药物分布[每克角膜组织中含CsA(7 805±325)ng,每克结膜组织中含CsA(2 125±575)ng],在眼后段的视网膜和脉络膜组织中也有CsA的分布,每克组织中含CsA(53.7±31.3)ng。眼组织药物分布提示,纳米胶束可通过结膜-巩膜途径将CsA递送至视网膜及脉络膜[21]。2018年8月,FDA批准0.09% CsA眼用溶液Cequa上市,其采用新型专利纳米胶束配方,是一种不含防腐剂的水溶液,每日滴眼2次可促进泪液产生,用于治疗干眼症[22]。
4.2 脂质体载体
脂质体具有类似细胞膜的磷脂双分子层结构,可携带亲水性或亲脂性药物,也是研究的最多的药物递送载体之一。将功能性分子修饰在脂质体上能进一步促进生物大分子药物的眼内递送。膜联蛋白A5(annexin A5,AnxA5)是一种钙依赖性磷脂结合蛋白。有研究发现其可跨越血管屏障,且在角膜上皮中高表达[23-24]。因此,研究者猜想AnxA5可用于促进局部给药向眼组织递送。实验表明,经AnxA5修饰且包载氯化钙的脂质体其人角膜上皮细胞摄取量是未修饰AnxA5脂质体的近3倍,同时在体外模型中其可成功跨越角膜上皮屏障。Davis等[25]采用此递药系统包载抑制新生血管生成的大分子药物贝伐单抗,结果显示,与游离的贝伐单抗溶液相比,滴眼给药后AnxA5的修饰使兔视网膜的贝伐单抗浓度增加了近20倍。因此,有望利用AnxA5修饰的脂质体实现将抗VEGF药物无创递送至眼后段,从而治疗老年黄斑变性等眼底疾病。
另有研究者同样采用AnxA5修饰的脂质体将转化生 长 因子-β1(transforming growth factor-β1,TGF-β1)通过无创给药的方式递送至玻璃体。滴眼给药1h后,玻璃体中TGF-β1的质量浓度达(114.70 ±12.40)ng · L-1,该质量浓度与先前在ARMD模型中被证明有效的TGF-β1质量浓度一致。Draize眼刺激性试验评价结果显示,兔眼对该制剂良好耐受,眼部刺激性较低[26]。ARMD的发展可能与TGF-β1/SMAD(small mother against decapentaplegic)通路的失调有关[27]。采用无创给药方式将TGF-β1递送至眼后段病灶部位,可控制ARMD的发生发展,并对视网膜起到一定的保护作用。
4.3 吸收促进剂
针对眼部存在的多种吸收屏障,不同作用机制的吸收促进剂被尝试应用于眼部无创给药。传统的吸收促进剂主要包括乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)等螯合剂及吐温80(Tween 80)等非离子型表面活性剂。EDTA可打开上皮细胞间的紧密连接,从而促进药物通过细胞旁路途径渗透;而Tween 80可通过扰动磷脂酰基链改善细胞膜通透性[28]。但是眼部组织非常敏感,含有这些小分子吸收促进剂的滴眼液可能会导致眼部刺激,长期应用的眼部蓄积毒性也值得关注。
细胞穿膜肽通常由5 ~ 40个氨基酸组成,可通过能量依赖或非依赖途径高效介导与其共价或非共价连接的药物穿过细胞膜或生物组织屏障[29]。因穿膜能力强且毒性低,近年来穿膜肽逐渐被研究者用作新型眼部吸收促进剂,如反式转录激活因子(trans-activator of transcription,TAT),PEP-1,penetratin及多聚精氨酸等[29-30]。它们多为阳离子穿膜肽,穿膜能力与所带正电荷相关。也有研究发现对penetratin的氨基酸进行色氨酸突变有利于进一步增强其眼部渗透能力[31]。
蛋白类药物大多由于相对分子质量大、亲水性强而无法跨越角膜上皮屏障。将穿膜肽以融合蛋白或物理混合的形式作为大分子药物滴眼剂的吸收促进剂,可显著增加其眼部吸收。FK506结合蛋白12(FK506 binding protein 12,FK506BP)具有一定的免疫调节作用和抗炎活性。利用分子生物学技术制备细胞穿膜肽PEP-1与FK506BP的融合蛋白,滴眼给药后,该融合蛋白对肉毒杆菌毒素A或低湿度气流诱导的2种干眼症模型均具有较好的治疗作用,在增加泪液分泌的同时显著降低白细胞介素1β(interleukin-1β,IL-1β)、TNF-α、巨噬细胞迁移抑制因子(macrophage migration inhibitory factor,MIF)等多种炎症因子的表达,而单独的FK506BP滴眼效果不佳[32-33]。
Zhang等[34]设计并制备了穿膜肽TAT与内皮抑素(endostatin)的融合蛋白。与游离的内皮抑素相比,融合蛋白的体外细胞摄取量显著增加,且呈浓度及时间依赖性,巨胞饮作用可能是融合蛋白进入细胞的主要途径。TAT-内皮抑素融合蛋白滴眼给药后,可跨越眼部吸收屏障到达视网膜,并且有效抑制了小鼠脉络膜新生血管[34]。TAT与酸性成纤维细胞生长因子(acidic fibroblast growth factor-His,aFGF-His)的融合蛋白经大鼠眼表滴入给药30 min后,同样可以分布于视网膜组织,并对大鼠视网膜缺血再灌注损伤模型起到显著保护作用,表现为视网膜内层结构得以维持,减少了视网膜神经节细胞的凋亡并改善了视网膜功能;aFGF-His由于难以到达视网膜而无法发挥视网膜保护作用,该组视网膜损伤程度与生理盐水组类似[35]。de Cogan等[36]将穿膜肽聚精氨酸(R6)与抗VEGF药物贝伐单抗或雷珠单抗简单地物理混合,滴眼给药后,大分子药物可被有效递送至大鼠眼后段组织。同时研究者选用与人眼结构更为接近的猪眼作为体外模型,同样证明了该复合物可将大分子药物递送至玻璃体及视网膜。R6/贝伐单抗复合物每日滴眼2次,持续给药10 d可显著减小小鼠脉络膜新生血管的病变范围,疗效与玻璃体内注射贝伐单抗相当[36]。利用细胞穿膜肽高效的跨越生物屏障能力,可通过无创的滴眼给药的方式将蛋白类药物递送至眼后段,进而发挥药效。
4.4 其他递送方法
离子电渗疗法是基于离子电渗装置、以离子流驱动药物渗透的一种非侵入给药方式。如图3所示,置于眼部的载药电极与耳后接地电极间形成稳定电场,促进带电荷的药物跨越眼部屏障,向眼内渗透。目前,离子电渗疗法已被成功用于将抗生素及类固醇等小分子药物递送入眼,但是很少有研究利用此种方法实现大分子药物的眼内递送。Molokhia等[37]采用离子电渗疗法将0.6 mg贝伐单抗递送入兔眼,证明了此种方法的可行性。然而,尽管离子电渗疗法可帮助获得较高的眼内药物浓度,药物的快速清除在一定程度上限制了其应用。鉴于此,有研究者提出了基于纳米载体的离子电渗疗法,以实现持续的药物递送并维持药物浓度[38]。此外,低频超声导入等物理手段也可辅助大分子药物跨巩膜途径到达兔眼后端[39]。
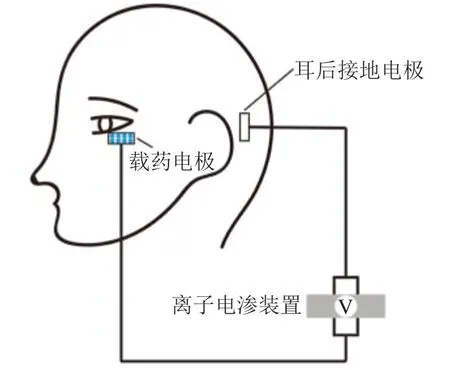
图3 眼部离子电渗递药示意图Figure 3 Iontophoresis for ocular drug delivery
5 基因的无创眼内递送
眼睛是基因治疗的理想器官,对其进行基因治疗具有以下独特优势:在体内相对独立,体积较小,由于存在BRB而具有免疫豁免权;易于接触,可采用不同的递送方式靶向各种眼组织;治疗后易于评估组织结构和视力功能的恢复情况[40]。
眼部疾病的基因治疗具有充分的病理学依据。包括莱伯先天性黑蒙症(Leber's congenital amaurosis,LCA)、视网膜色素变性(retinitis pigmentosa,RP)在内的多种视网膜疾病都与视网膜色素上皮层特定的基因突变有关,例如RPE65,bestrophin及LRAT等[40]。Luxturna是美国批准的首个眼科基因治疗药物,用于治疗双等位RPE65基因突变导致的遗传性视网膜疾病——Ⅱ型先天性黑蒙症,于2017年12月上市,给药途径为视网膜下腔注射(见表1)。这种给药方式可以将基因直接递送到视网膜色素上皮(retinal pigment epithelium,RPE)细胞,但是易引起视网膜出血甚至视网膜脱落等副作用[41]。此外,也有研究者尝试采用基因疗法治疗青光眼、ARMD等神经退行性眼科疾病[42-43]。
由于裸露的核酸分子具亲水特性,尺寸较大且带负电荷,因此很难有效地跨越细胞膜。为解决这一难题,研究者们开发了多种递药系统以确保基因进入至靶细胞内。病毒载体虽具有转染效率高的优势,但潜在的免疫原性及染色体毒性限制了其临床应用[44]。目前研究者致力于开发安全性更佳、更易进行工业化生产的非病毒载体,但其基因转染效率较病毒载体偏低,在递送系统中引入细胞穿膜肽可进一步解决此问题。
5.1 阳离子脂质体载体
阳离子脂质体可与带负电的基因通过静电相互作用结合,保护其不被体内的核酸酶降解,并增强细胞内基因递送。Puras等[45]采用乳化溶剂挥发法制备质粒DNA(pCMS-EGFP)阳离子脂质体。与Lipofectamine 2 000组相比,该脂质体主要通过网格蛋白介导的内吞作用进入细胞,可更高效转染ARPE-19细胞且细胞毒性更低。另有研究者采用RGD肽修饰的脂质体包载小干扰RNA(small interfering RNA,siRNA),体外实验结果显示其在RPE细胞中具有更高的递送效率,且通过整合素受体介导的内吞作用进入细胞[46]。
粒径是影响脂质体眼内分布的重要因素。Lajunen等[47]采用微射流方法制备了包载质粒DNA的脂质体,并将转铁蛋白修饰于阳离子脂质体表面,通过调整该脂质体粒径,经滴眼给药后可有效渗透眼部吸收屏障并靶向视网膜色素上皮层。眼内分布结果显示,粒径小于80 nm的脂质体可渗透至视网膜色素上皮层,而粒径大于100 nm的脂质体多分布于脉络膜内皮层。适宜粒径的配体修饰脂质体有潜力成为通过滴眼给药治疗视网膜疾病的基因载体。
阳离子脂质体可借助不同内吞途径增强包载基因的入胞效率,经修饰后还可增加其渗透屏障的能力。但是阳离子脂质体的缺点在于其潜在的视网膜毒性及可能干扰视力等副作用[48]。目前采用阳离子脂质体作为非病毒基因载体治疗视网膜疾病的研究较少。
5.2 聚合物载体
一些阳离子聚合物可通过静电相互作用及疏水作用与DNA结合,与阳离子脂质体相比,其形成的复合物粒径更小,更有利于细胞转染[49]。天然聚合物和合成聚合物都被大量研究用作基因递送载体,其中一些载体可有效实现无创眼内基因递送。
5.2.1 天然聚合物载体在天然聚合物中,壳聚糖及其衍生物因细胞毒性低、无免疫原性、生物相容性好且可生物降解,成为最常见的非病毒基因载体。壳聚糖具有黏膜黏附特性,可与黏膜上皮相互作用,延长制剂在眼表的滞留时间。此外,壳聚糖还可打开细胞间紧密连接,促进跨膜转运。但壳聚糖也存在一些局限性,如在生理pH条件下溶解度低、体内转染效率低等[40-50]。优化壳聚糖相对分子质量或与其他材料联用可提高基因的转染效率。Klausner等[51]比较了相对分子质量为5 700,7 300,340 000的壳聚糖向角膜递送基因的能力,结果显示较低相对分子质量的壳聚糖与DNA形成的复合物更容易解离,采用相对分子质量为5 700的壳聚糖制备的纳米粒具有最高的大鼠角膜转染效率。天然聚合物透明质酸(hyaluronic acid,HA)也具有可生物降解、生物相容性好、无毒、无免疫原性等特点。其大量存在于细胞外基质及眼内玻璃体液中,具有黏弹性,是眼科制剂的理想载体。此外,透明质酸可与表达于人角膜和结膜上的受体CD44特异性结合[52]。CD44参与受体介导内吞过程,可促进采用HA作为载体的制剂向细胞内转运。HA-CD44相互作用可启动细胞信号传导,促进基因转染[53]。de la Fuente等[54]采用壳聚糖和透明质酸共同构建纳米基因载体。与裸质粒DNA相比,滴眼给药后制剂组展现了更强的体内角膜转染能力及较长时间的基因表达[53-54]。
明胶具有良好的亲水性,是常见的天然聚合物载体。MUC5AC蛋白表达的改变与干眼病的发病机制有关。有研究者选择明胶作为非病毒基因载体,将编码MUC5AC蛋白的质粒包载在阳离子明胶纳米粒中。实验性干眼症小鼠经滴眼给药治疗后,其角膜和结膜中MUC5AC蛋白的表达量及泪液分泌量都显著提高,炎性细胞因子TNF-α及趋化因子干扰素诱生蛋白10(interferon-inducible protein-10,IP-10)等的表达显著降低,且小鼠未出现眼部刺激或水肿[55]。
5.2.2 合成聚合物载体树枝状高分子聚酰胺-胺(polyamindoamine,PAMAM)同样可以通过静电相互作用与基因结合形成稳定的复合物,可作为基因递送的有效载体。较高代数PAMAM的细胞内吞能力较强,转染效率较高,其中PAMAM G4和PAMAM G5通常被用作眼科药物递送载体[56-57]。如Mastorakos等[58]设计了氨基功能化的端羟基PAMAM树枝状聚合物(PAMAM G4)来有效压缩DNA,并采用曲安奈德作为核定位增强子以实现人视网膜色素上皮细胞的高效转染,同时掺入聚乙二醇(polyethylene glycol,PEG)化树枝状大分子进一步保护基因载体,提高制剂的稳定性。但是较高的转染效率常伴随着细胞毒性。Liu等[59]则选择较低代数的PAMAM G3,并联合采用细胞穿膜肽penetratin共同压缩质粒DNA,在保证制剂对眼部组织毒性较低,同时利用细胞穿膜肽的高效穿膜能力进一步增强基因载体的转染效率,促进其向眼底转运。该复合物经大鼠结膜囊滴入给药,10 min后质粒即可分布于眼后段视网膜组织,且可滞留8 h以上。值得一提的是,在该基因载体的帮助下,质粒可分布于视网膜,但是在角膜却几乎未见分布,提示该复合物可能通过非角膜途径,即巩膜途径进入眼内。
PEG多被用于与阳离子脂质体[47]或PAMAM聚合物[58]等共同构建基因递送载体,可起到稳定复合物的作用,避免因盐类、蛋白质、补体诱导等因素而失活。Jiang等[60]设计了一种柔性多价penetratin(8VP)作为基因载体,压缩siRNA并促进其眼内递送。该基因载体以多臂PEG作为核心,末端加以penetratin修饰。8VP/siRNA可以完整复合物的形式穿过体外血-视网膜屏障模型,其体外转染效率可达75%,经滴眼给药10 min后siRNA即可迅速分布到视网膜,且6 h后仍有滞留。荷眼内肿瘤的小鼠连续15 d采用8VP/siRNA滴眼给药,肿瘤细胞内的蛋白表达被显著抑制,且对眼前段角膜组织几乎无毒性作用;而阳离子脂质体/siRNA复合物滴眼给药组对肿瘤细胞内的蛋白表达几乎无抑制效果,眼部生物发光信号强度与生理盐水组没有显著性差异[60]。该研究实现了基因的无创眼后段递送,为眼内相关疾病的基因治疗提供了新方案。
此外,聚乙烯亚胺(polyetherimide,PEI)有强大的DNA压缩能力且具有pH缓冲特性,可实现有效的基因转染,是研究最多的合成聚合物载体之一[61];但因其潜在的细胞毒性,应用于无创眼部基因递送的研究较少。
5.3 物理手段介导基因递送
除利用天然或合成聚合物载体外,超声等物理学手段也可提高基因的转染效率。近年来,将超声微泡造影剂(ultrasound contrast agent,UCA)应用于眼部基因递送获得了广泛关注。UCA在声场内破裂后产生的空化效应和机械效应可使细胞膜通透性增加,细胞间隙变大,短暂打开血-视网膜屏障,为药物的视网膜递送提供一种无创的替代疗法。Park等[62]的研究发现在超声停止3 h后,被打开的BRB会重新恢复。Xu等[63]利用UCA成功将内皮抑素-绿色荧光蛋白(endostatin-green fluorescent protein,ES-GFP)质粒转染至人视网膜血管内皮细胞。
6 总结与展望
各种眼部疾病不仅影响患者的生活质量甚至可能导致失明,同时也给社会带来巨大的经济与医疗负担。随着人口日趋老龄化,ARMD等年龄相关性眼科疾病的患病人数将进一步增加。药剂学领域的研究者一直致力于开发新型的眼部药物递送系统,以期通过患者更易接受的滴眼给药方式将生物大分子药物递送入眼内,特别是眼后段病灶部位,以消除侵入性眼内注射带来的风险。目前大量的研究采用胶束、脂质体、细胞穿膜肽作为载体实现了生物大分子药物的无创眼内递送,在动物眼科疾病模型上取得了较为理想的效果,有望成为眼内注射抗VEGF药物或基因药物的替代疗法。
设计生物大分子药物的无创眼内递送系统必须兼顾安全性与有效性,以及制剂的临床转化前景,这为药物载体的递送效率、生物相容性、生物降解性以及制备工艺可行性提出了更高的要求。目前,各载体携带生物大分子药物进入眼内的具体途径及机制尚无定论,仍需研究者深入探索,且制剂的稳定性及递送效率仍有待进一步提高。此外,还需要构建与人类眼科疾病更为接近的动物模型,并进一步完善治疗效果评价手段,以便更好地预测递送载体的安全性与有效性。在临床需求的促动下,相信在不久的将来可实现无创给药治疗眼底疾病的目标。

