基于外翻肠囊法研究乌蕨醇提物的肠吸收特性*
胡燕珍 刘建坤 黄斌 陈乐#
(1 江西省中医药研究院 南昌 330046;2 江西道地特色中药材标准化重点研究室 南昌 330046;3 江西南华医药有限公司 南昌 330009)
乌蕨 (Odontosoria chinensisJ. Sm.) 为鳞始蕨科(Lindsaeaceae)乌蕨属植物的全草,具有清热解毒、利湿、止血之效,是一种民间常用中草药。现代药理研究表明,乌蕨提取物具有抗炎、抗肿瘤、降血糖等作用[1~3]。本课题组前期对近年来乌蕨的化学成分、含量测定、药理作用等研究进展进行了相关综述,在化学成分的整理中发现,乌蕨中的化学成分以黄酮类和有机酸类成分为主[4]。同时,本课题组也基于超高效液相色谱- 四极杆- 飞行时间质谱(UPLC-Q-TOF-MS)技术验证了乌蕨的化学成分主要为黄酮类和有机酸类化合物[5]。目前,有关乌蕨的研究主要集中在有效成分含量测定、化学成分分离纯化、新化合物结构鉴定、物种鉴别以及对各种乌蕨粗提物疗效物质基础的初步探索阶段,尚未见乌蕨主要化学成分的外翻肠囊吸收特性研究。查阅乌蕨化学成分含量测定相关文献发现,近年来不少学者通过测定乌蕨中原儿茶酸、原儿茶醛、牡荆苷等指标成分的含量来制定其药材或饮片的质量控制标准[6~7]。由于中药成分复杂、药理作用多样,以单个或多个指标性成分的含量高低来评价药材质量的优劣,其合理性有待考究。近年来基于“中药成分群-吸收成分群-药效成分群”的假说来选择中药质量控制指标以及药效物质基础的研究已成为热点。外翻肠囊法是由Wilson 和Wiseman 于1954年创建,最早用于研究葡萄糖和氨基酸在肠道的代谢、转运[8],由于该实验模型具有操作简单、影响因素少、实验条件可控、容易定量、药物积累较快、药物用量较少等优势,现已被广泛用于中药有效成分的识别及其吸收机制研究[9~11]。基于此,本研究采用外翻肠囊法制备各肠段的乌蕨肠囊吸收液,应用高效液相色谱法(HPLC 法)检测肠囊吸收液中的化学成分(牡荆苷、原儿茶酸、原儿茶醛)含量,并对各成分的肠吸收特征进行分析和总结,以期为乌蕨质量控制指标的制定及其提取物剂型的开发提供参考。现报道如下:
1 材料
1.1 仪器 Agilent 1260 型高效液相色谱仪(Agilent 公司,美国);MS105DU 型十万分之一电子天平(梅特勒-托利多公司,瑞士);组织-器官水浴系统(上海奥尔科特生物科技有限公司);Precision HL G3 旋转蒸发仪(德国heidolph 公司)。
1.2 药材与试剂 乌蕨药材于2020年5月28日采集于江西省景德镇市昌江区(批号:20200528),经江西省中医药研究院虞金宝研究员鉴定为鳞始蕨科植物乌蕨的全草。原儿茶酸对照品(批号110809-201906,纯度97.7%)原儿茶醛对照品(批号110810-201608,纯度99.3%),牡荆苷对照品(批号111687-201704,纯度94.9%),均购于中国食品药品检定研究院;乙腈(HPLC 级,Fisher 公司);甲醇(HPLC 级,Fisher 公司);纯净水(杭州娃哈哈集团有限公司);葡萄糖、氯化镁(MgCl2)、氯化钾(KCl)、氯化钠(NaCl)、氯化钙(CaCl2)、碳酸氢钠(NaHCO3)和磷酸二氢钠(NaH2PO4)(AR 级,国药集团)。
1.3 动物 SPF 级健康雄性 Sprague-Dawley(SD)大鼠,体质量230~250 g,购于江西中医药大学实验动物中心,许可证号:SCXK(赣)2018-0003。
1.4 Tyrode 缓冲液配制 准确称取 NaCl 8.0 g,MgCl20.1 g,KCl 0.28 g,NaH2PO40.05 g,NaHCO31.0 g 溶于500 ml 蒸馏水中(溶液Ⅰ),密闭冷藏;准确称取0.2 g CaCl2溶于500 ml 蒸馏水中(溶液Ⅱ),密闭冷藏;使用前将溶液Ⅰ和溶液Ⅱ混匀,并加入1.0 g葡萄糖充分溶解,即得。
2 方法
2.1 色谱条件 迪马钻石Plus C18(250 mm×4.6 mm,5 μm)色谱柱;流动相:A 相为 0.4%磷酸水溶液,B 相为乙腈;检测波长:原儿茶酸、原儿茶醛均为260 nm,牡荆苷为340 nm;流速1.0 ml/min;柱温30℃;进样量 10 μl。洗脱梯度:0~20 min,A 相 95%~90%;20~20.1 min,A 相 90%~82%;20.1~60 min,A相82%~82%。
2.2 对照品溶液的制备 分别精密称取原儿茶酸6.43 mg、原儿茶醛7.10 mg、牡荆苷6.28 mg,加70%甲醇配成浓度0.251 3 mg/ml 的原儿茶酸对照品母液、0.282 0 mg/ml 的原儿茶醛对照品母液、0.238 4 mg/ml 的牡荆苷对照品母液,备用。
2.3 供试品溶液制备 称取乌蕨(批号20200528)药材粉末约1 g,精密称定,置具塞锥形瓶中,精密加入70%甲醇25 ml,称定重量,超声处理(功率250 W,频率为40 kHz)60 min,放冷,再称定重量,用70%甲醇补足减失的重量,摇匀,滤过,取续滤液,经0.22 μm 微孔过滤膜过滤,即得。
2.4 乌蕨醇提物的制备及乌蕨含药Tyrode 缓冲液的配制 将乌蕨鲜品用清水洗净,水分沥干后,置于70℃烘箱中烘干。将烘干的乌蕨药材粉碎(过3 号筛),称取乌蕨药材粉末500 g,加6 倍量95%乙醇,回流提取2 次,每次2 h,趁热过滤,合并两次滤液,浓缩干燥得乌蕨醇提物。使用前用Tyrode 缓冲液配制高、中、低质量浓度的乌蕨醇提物供试药液。
2.5 乌蕨肠囊吸收液的制备 参照文献方法[8,11],复制大鼠外翻肠囊实验模型。18 只雄性SD 大鼠随机分成三组,每组6 只,对应高、中、低3个剂量乌蕨醇提物供试药液。实验动物禁食(自由饮水)12 h 后,断颈椎处死,沿腹部中线剖开,迅速取出小肠和大肠,分别剪取十二指肠、空肠、回肠、结肠各10 cm,将剪下的肠管放置于盛有0℃Tyrode 缓冲液的玻璃培养皿内,用0℃Tyrode 缓冲液冲洗肠管,至无内容物冲出为止,并小心剥离肠管表面的肠系膜和脂肪。将肠管的一端结扎在自制硅胶套管上,小心翻转肠管,用0℃Tyrode 缓冲液冲洗内表面,洗净后将另一端结扎,形成囊状肠管。在囊状肠管中注入2 ml 37℃Tyrode 缓冲液,置于预先加入25 ml 乌蕨醇提物供试药液(高、中、低3个剂量)的麦氏浴管中,通入混合气体(95%O2,5%CO2),整个实验过程保持37℃恒温。分别于 30 min、45 min、60 min、90 min、120 min、150 min、180 min 7个时间点收集 0.4 ml 肠囊吸收液置于EP 管中,同时各肠管补充0.4 ml 37℃的Tyrode 缓冲液,各样品于-20℃密封保存,待用。
2.6 肠囊吸收液样品处理 精确量取“2.5 项”下各时间点乌蕨肠囊吸收液200 μl,使用氮吹仪吹干肠囊吸收液样品后,加入等体积70%甲醇复溶,超声样品 15 min,涡旋 30 s,样品经 0.22 μm 滤膜过滤待测。乌蕨供试品溶液及空白肠囊吸收液Tyrode 缓冲液采用与乌蕨醇提取肠囊吸收液相同的处理方式。
3 结果
3.1 专属性 在建立的色谱条件下,乌蕨供试品溶液中的原儿茶酸、原儿茶醛、牡荆苷3 种活性成分的峰与其他非被检测峰均能够达到基线分离,色谱峰形尖锐、对称性良好,分离度>1.5。对照品和供试品色谱图见图1。

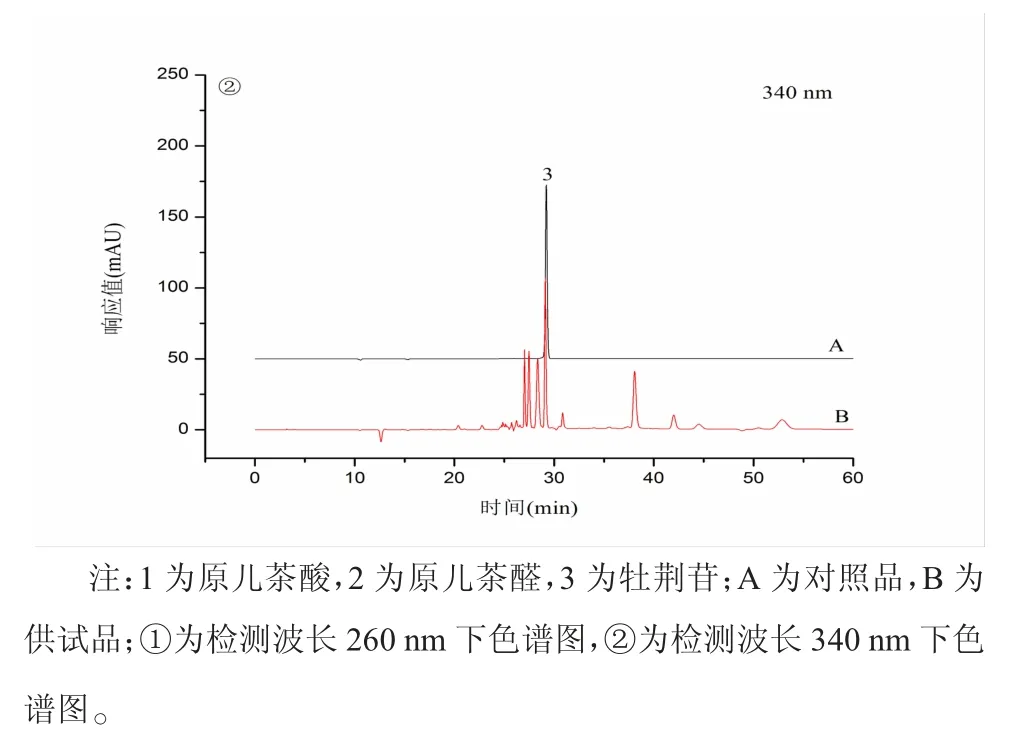
图1 不同波长下对照品溶液和供试品溶液的色谱图
3.2 标准曲线制备 精密吸取“2.2”项下原儿茶酸、原儿茶醛和牡荆苷对照品母液,用70%甲醇依次稀释,得不同溶度混合对照品溶液。精密吸取上述各溶液 10 μl,按“2.1”项色谱条件测定,记录各成分峰面积,以进样量(X)为横坐标,峰面积(Y)为纵坐标,进行线性回归。线性方程如下:原儿茶酸(Y=3.466 2×103X+0.394 1,r=0.999 9,0.050 26~0.502 6 μg);原儿茶醛(Y=1.132 5×103X+1.693 8,r=0.999 9,0.056 40~0.564 0 μg);牡荆苷(Y=1.100 8×103X+0.252 8,r=0.999 8,0.143 04~1.430 4 μg)。
3.3 精密度试验 精密吸取同一样品10 μl,按“2.1”项色谱条件,连续进样6 次,记录原儿茶酸、原儿茶醛、牡荆苷3 种成分的峰面积,计算各成分峰面积的RSD,分别为0.23%、0.28%、0.13%(RSD 均小于2%),表明液相色谱仪精密度良好。
3.4 稳定性试验 精密吸取供试品溶液10 μl,按“2.1”项色谱条件测定,分别于 0 h、2 h、6 h、10 h、16 h、20 h、24 h 进样,记录原儿茶酸、原儿茶醛、牡荆苷3 种成分的峰面积,计算各成分峰面积的RSD,分别为 0.69%、0.61%、0.68%(RSD 均小于 2%),表明乌蕨样品溶液在24 h 内稳定性良好。
3.5 重复性试验 精密称取乌蕨(批号:20200528)药材粉末6 份,按“2.3”项下供试品溶液制备方法处理,得6 份供试品溶液。精密吸取上述溶液10 μl,按“2.1”项色谱条件测定原儿茶酸、原儿茶醛、牡荆苷:3 种成分的含量,各成分的平均含量分别为0.03%、0.04%、0.24%(RSD 均小于2%),表明该法重复性良好。
3.6 加样回收率试验 精密称取乌蕨(批号:20200528)药材粉末 6 份,分别为 0.493 2 g、0.491 9 g、0.493 1 g、0.492 5 g、0.493 4 g、0.493 5 g,依次精密加入含原儿茶酸、原儿茶醛、牡荆苷的混合对照品溶液25 ml(原儿茶酸6.760 8×10-3mg/ml、原儿茶醛9.493 1×10-3mg/ml、牡荆苷 39.28×10-3mg/ml),按“2.3”项方法处理。精密吸取供试品溶液10 μl,按“2.1”项色谱条件测定原儿茶酸、原儿茶醛、牡荆苷3种成分含量,计算各成分的平均加样回收率,分别为103.36%、99.47%、97.23%,RSD 分别为 3.17%、3.37%、4.45%,符合样品分析要求。
3.7 乌蕨醇提物肠囊吸收液各成分测定分析 在建立的色谱条件下,乌蕨醇提物中的原儿茶酸、原儿茶醛、牡荆苷3 种活性成分的峰与其他非被检测峰能够达到基线分离。但乌蕨醇提物肠囊吸收液中未检测出原儿茶酸、原儿茶醛、牡荆苷3个指标性成分。见图2。
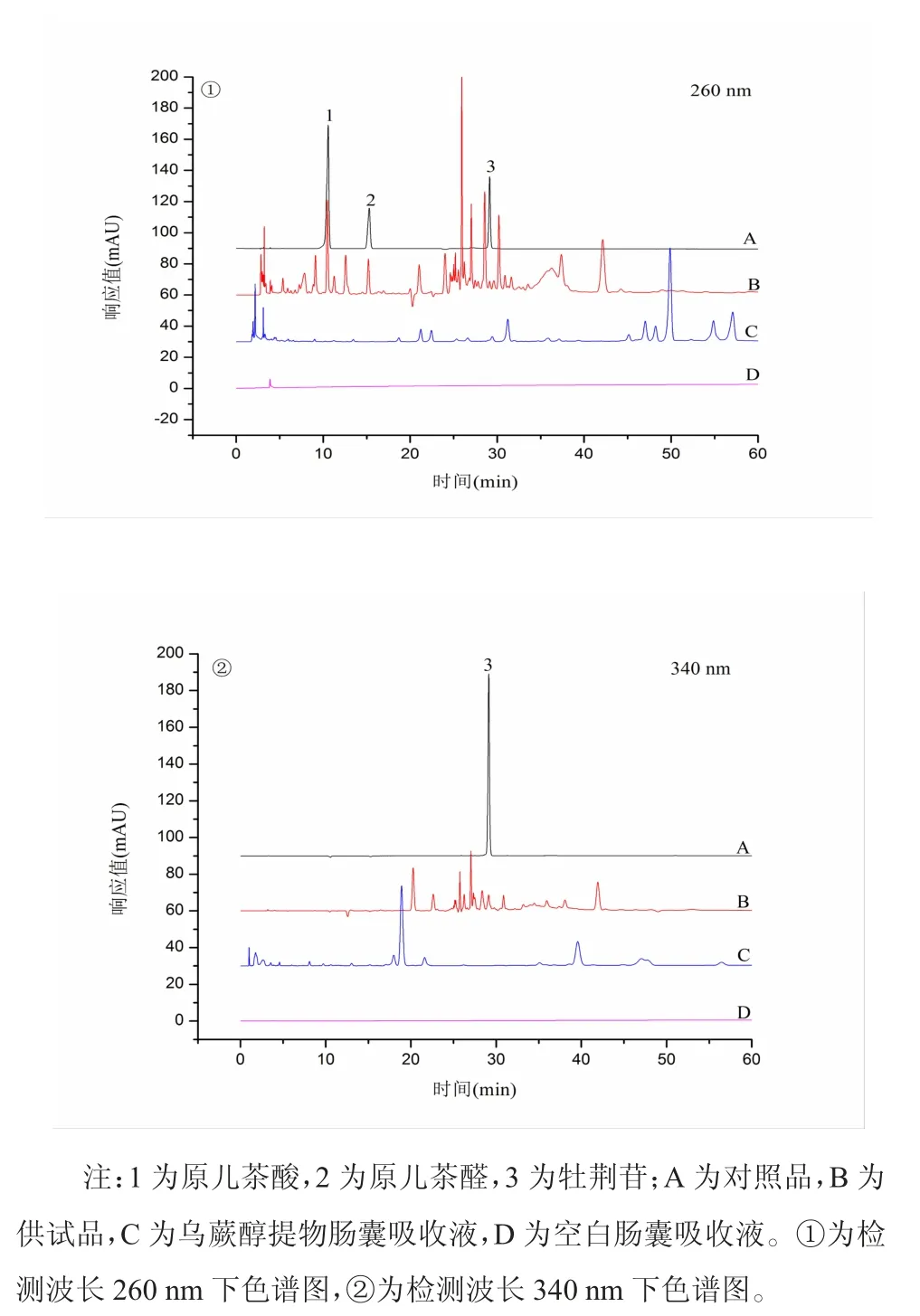
图2 不同波长下对照品溶液和供试品溶液的色谱图
4 讨论
外翻肠囊法保留了肠道组织的完整性和黏膜的特性,可在体外模拟体内生理状态下小肠对药物的吸收情况,能较为真实地反映药物在肠道中的吸收情况[12]。本研究建立了HPLC 同时测定乌蕨醇提物中的原儿茶酸、原儿茶醛、牡荆苷3 种成分的方法,并对该法进行了方法学考察,结果表明该法重复性好、检测效率高、专属性强,适于乌蕨中原儿茶酸、原儿茶醛、牡荆苷3 种化学成分的定量分析。但在本研究建立的色谱条件下,乌蕨醇提物肠囊吸收液未检测出原儿茶酸、原儿茶醛、牡荆苷3 种成分。出现这种现象的原因可能有以下几方面:(1)原儿茶酸、原儿茶醛、牡荆苷三者非以原型形式在小肠吸收;(2)原儿茶酸、原儿茶醛、牡荆苷三者在小肠吸收过程中,需要某些特定转运载体介导,而乌蕨中其他成分对转运载体具有一定的抑制作用,有关推测需进一步研究确证;(3)乌蕨肠囊吸收液样品中3 种活性成分(原儿茶酸、原儿茶醛、牡荆苷)含量较低,低于检测限。针对上述原因,本研究后续将进一步深入探索。

