外源土壤调理剂增施对滴灌玉米田土壤细菌群落多样性的影响
赵卉鑫,杨 江,王艳明,梅锐锋,张瑞喜,马 鑫
(1.内蒙古自治区水利科学研究院,呼和浩特010020;2.内蒙古河套灌区水利发展中心乌兰布和分中心建设二分干渠供水所,内蒙古巴彦淖尔015200;3.内蒙古河套灌区水利发展中心乌兰布和分中心,内蒙古巴彦淖尔015200)
0 引言
河套灌区是我国设计灌溉面积最大的灌区[1],以黄河水畦灌为主,这不仅会导致水资源的大量浪费,而且会加深土壤盐渍化程度,因此改良灌溉方式和改善河套灌区土壤质量是十分必要的。滴灌水肥一体化技术可显著节约灌溉水,是提高水肥利用效率和改善土壤质量的重要技术措施[2],因此本文通过在河套灌区试验区进行滴灌农田灌排安全技术研究,将黄河水经过三道程序过滤,然后将水肥一体化混合后进行滴灌,可减少输水过程中的渗漏和蒸发损失,提高水资源利用效率。外源土壤调理剂能有效改善土壤养分状况及理化性质,促进土壤团粒的形成、提高肥力、改善土壤保水保肥性,对土壤问题可以起到积极的修复作用[3]。在此过程中,土壤细菌发挥着十分重要且不可忽视的作用,其不仅可以促进土壤养分的循环与转化,还参与土壤有机质的矿化和土壤腐殖质的形成[4]。生物炭(BIC)拥有多孔结构、具有较强的吸附性,可与土壤黏土矿物有机质形成团聚体,其与有机碳结合可提高其氧化稳定性[5],可为微生物提供良好的生长与繁殖空间,从而影响了土壤微生物的多样性及群落结构组成。聚丙烯酰胺(PAM)是一种线性水溶性高分子聚合物,其主要作用是减少径流和土壤侵蚀,稳定土壤结构,提高水分利用效率,减少肥料的流失[6],并且能增加或改变某些利用PAM的菌群数量及结构[7]。保水剂(SAP)是一种化学节水技术,不仅能够增加土壤团聚体改善土壤结构,而且能够提高土壤吸水能力[8]。除此之外,保水剂还可以通过改善土壤微生物结构而提高植物的干旱适应能力[9]。
综上所述,当前试验研究多集中在土壤单独施加BIC、PAM 和SAP,关于其中两者或三者联合施用对盐渍化土壤的综合作用研究相对较少。因此本研究在滴灌技术的基础上,针对河套灌区保水性、质量较差的盐渍化土壤,展开BIC、PAM 和SAP 的应用研究,并基于PE250 测序平台,对滴灌条件下外源土壤调理剂增施对土壤细菌群落结构和多样性进行分析,并探讨细菌群落组成与环境因子之间的关系,这为滴灌条件下盐渍化土壤的改良提供微生物方面的参考依据,同时也对当地乃至全国的盐渍化土壤地区发展农业节水具有重要的现实指导意义。
1 材料与方法
1.1 试验地概况
试验于2020年4-10月在内蒙古自治区巴彦淖尔市临河区双河镇进步村进行。该地区地理坐标为东经107°6′E~107°44′E,北纬40°34′N~44°17′N,属于温带大陆性气候,年平均气温为6.8°C,年均降雨量是141.2 mm,蒸发量较大,无霜期为140 d 左右,昼夜的温差较大。该地土壤类型为轻度盐渍化土壤,盐分偏高。该试验地土壤理化性质见表1。

表1 土壤基本化学性质Tab.1 The basic chemical properties of soil
1.2 试验设计
在滴灌条件下,分别设置CK(对照处理),SAP+PAM(保水剂+聚丙烯酰胺处理,DSP),SAP+BIC(保水剂+生物炭处理,DSB),PAM+BIC(聚丙烯酰胺+生物炭处理,DPB)和SAP+PAM+BIC(保水剂+聚丙烯酰胺+生物炭处理,DSPB)五个不同处理,每个处理5 次重复,以下分别以DCK,DSP,DSB,DPB,DSPB 表示。每个小区面积均为72 m2,小区间保留30 cm 隔离间距,每个小区周边设置面积大小相同的保护行,供试作物为玉米。外源土壤调理剂施入量分别为SAP:45 kg/hm2;PAM:22.5 kg/ hm2;BIC:9 000 kg/ hm2。灌溉参照当地现有灌水次数及水量,增加玉米苗期滴水2次,滴水追施磷肥(磷酸二氢钾),用量为45 kg/hm2。CK 除不增施外源土壤调理剂,其他田间管理措施均一致。
1.3 样品采集
于玉米灌浆期进行取样,用土钻取耕层0~30 cm 土壤样品作为供试样品。每个小区采用“S”形取样法选5 点取样,在已进行75%酒精棉消毒的盆中立刻混合均匀,迅速去除植物残体与各种残渣后,分别装入两个无菌自封袋,标记之后立刻放入装有干冰的泡沫箱中。小区的取样前均进行土钻和手套的消毒,尽量保证在无菌条件下取得土样。土样取完立刻带回实验室,一部分样品放在-80 ℃冰箱中冷冻保存,用于微生物群落的分析与测定;一部分土样直接风干,过2 mm 和0.15 mm筛备用,用于测定土壤化学性质指标。
1.4 土壤微生物样品的测定
土壤微生物样品测序平台为PE250。本试验中土壤样品的细菌16S 引物区域为V3~V4 区,目的片段长度为480bp,前引物名称338F,前引物序列ACTCCTACGGGAGGCAGCA,后引物名称806R,后引物序列GGACTACHVGGGTWTCTAAT。使用的试剂盒为omega M5635-02。
1.5 土壤化学性质的测定
参照《土壤农化分析》[10]的方法,土壤pH 值和电导率用pH 值计和电导仪测定;土壤速效磷采用NaHCO3-紫外分光光度法测定;土壤速效钾采用NH4OAc-原子吸收法测定;土壤水解氮采用碱解扩散法测定。
1.6 数据处理
试验数据分析基于上海派森诺生物科技股份有限公司所提供的云服务(https://www.genescloud.cn/login)进行,微生物使用的UPARSE 软件,根据97%的相似度对序列进行OTUs(operational taxonomic units)聚类;土壤微生物OTU 分析使用Usearch;土壤微生物群落Alpha 多样性指数、NMDS 分析、组间差异分析、群落组成、LEfSe 分析、随机森林和RDA 分析(冗余分析)使用R 语言进行作图。采用Excel 2010 进行数据整理和图表制作,SPSS25 进行相关性分析和方差分析(P<0.05)。
2 结果与分析
2.1 外源土壤调理剂增施对滴灌玉米田土壤化学性质的影响
由表2可看出,外源土壤调理剂增施能够改善土壤化学性质。与DCK 相比,DSP 和DSB 处理显著增加土壤pH 值,但DPB 和DSPB 处理无显著变化,且与本底值相比有所降低,降幅分别为:0.51%和0.76%;各处理均增加土壤电导率,且DSB处理最为显著;DPB处理显著增加土壤水解氮含量,增幅为24.01%;而各处理在土壤速效磷、速效钾含量方面与DCK之间不存在显著性差异。
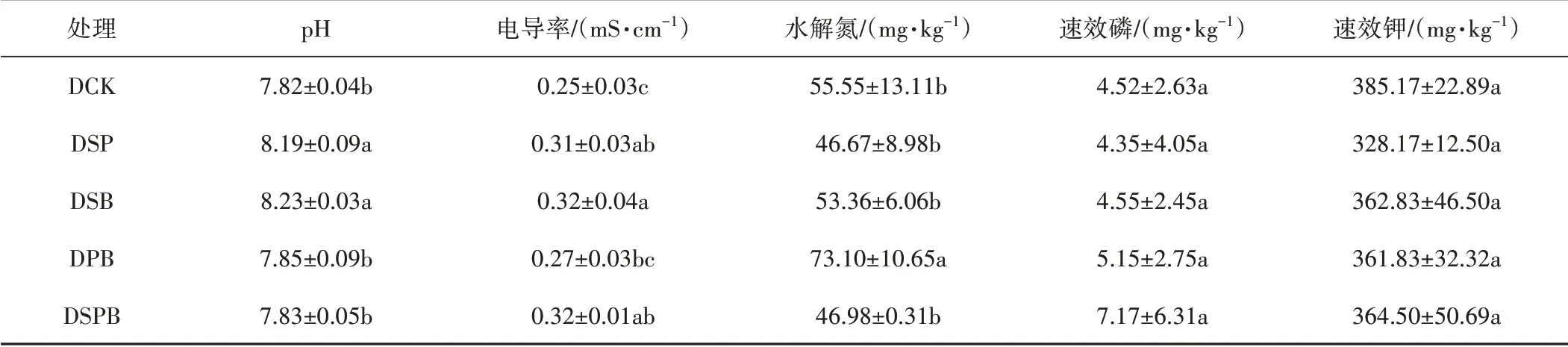
表2 不同处理的土壤化学性质Tab.2 Soil chemical properties of different treatments
2.2 外源土壤调理剂增施对滴灌玉米田土壤细菌群落多样性的影响
2.2.1 土壤细菌样本测序结果及OTUs数
由图1可以看出所有样本中共有的OTUs 总数为2 917,各处理OUT 数量由多到少为:DCK>DSB>DSPB>DSP>DPB,分别为7 433、7 147、5 971、5 848和5 710。
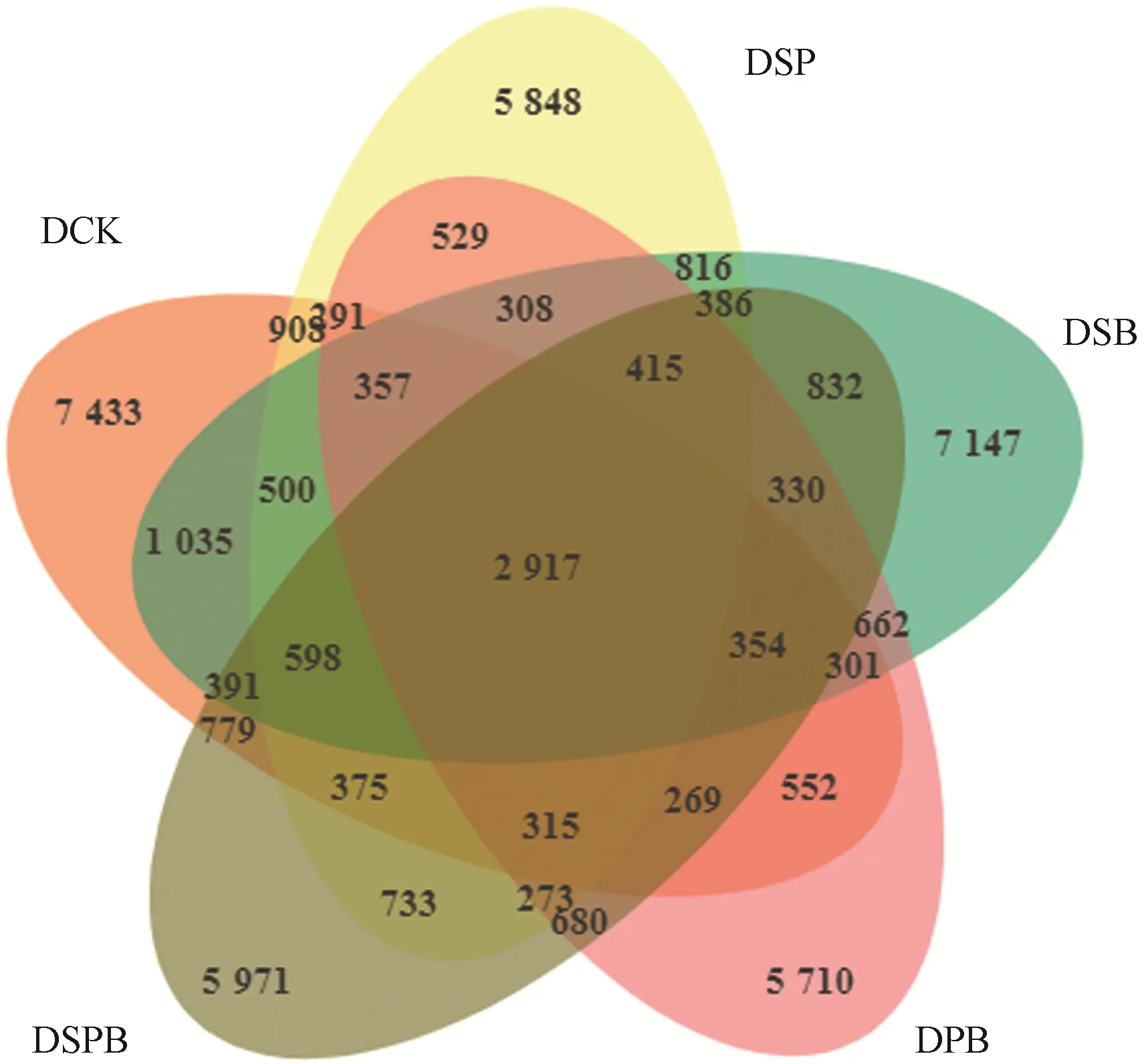
图1 不同处理细菌群落OTUs数Fig.1 OTUs number of bacterial community in different treatments
2.2.2 不同处理对土壤细菌群落α-多样性的影响
由图2(a)可以看出,在各处理中,Chao1(丰富度)指数最低的是DPB 处理,相比DCK 和其他处理明显降低(P<0.05)。 各处理的Goods_coverage (覆盖度)指数和Pielou_evenness(均匀度)指数均达到96%和0.86 以上[图2(b)和图2(d)],这说明测序深度能够满足分析要求,能够覆盖土壤细菌群落的绝大部分物种,这足以反映环境中的物种多样性。在各处理中Shannon(多样性)指数最高的是DSB处理(10.85),其次是DSPB 处理(10.78),而最低的是DSP处理(10.68)。与DCK 相比,DSB 和DSPB 处理提高了土壤细菌群落的多样性指数,但差异性不显著(P>0.05),而DSP 和DPB处理则无显著变化[图2(c)]。
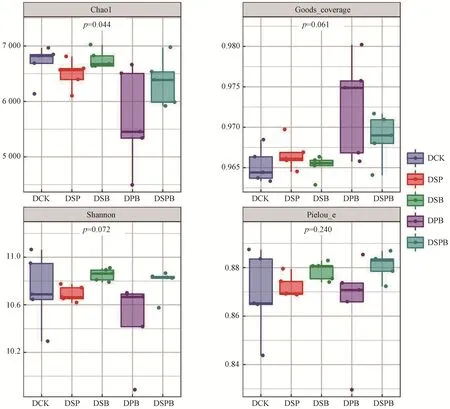
图2 不同处理下土壤细菌群落α-多样性分析Fig.2 Effects of different treatments on α-diversity of soil bacterial community
2.3 外源土壤调理剂增施对滴灌玉米田土壤细菌群落结构(门水平)的影响
不同处理的土壤细菌优势门均为变形菌门(Proteobacteria),分别占总物种的32.37% (DCK),29.98%(DSP),33.73%(DSB),31.85%(DPB)和32.77%(DSPB);其次为放线菌门(Actinobacteria),分别占总物种的15.85%,17.17%, 17.97%, 21.44% 和18.25%;以及酸杆菌门(Acidobacteria)分别占总物种的18.62%,19.42%,16.43%,13.65%和16.98%。与DCK 相比,DSB 和DSPB 处理的变形菌门分别提高了4.20%和1.24%,DPB 和DSPB 处理的放线菌门分别提高了35.29%和15.20%,而酸杆菌门则分别降低了26.71%和8.80%(图3)。

图3 门水平细菌群落的相对丰度Fig.3 Relative abundance of bacterial communities at the phylum level
2.4 外源土壤调理剂增施对滴灌玉米田土壤细菌群落结构(属水平)的影响
不同处理的土壤细菌优势属均为Subgroup_6 属,分别占总物种的8.83% (DCK),9.01% (DSP),7.64% (DSB),6.70%(DPB)和7.90%(DSPB);其次为Skermanella 属,分别占总物种的2.26%,3.85%,3.76%,4.80%和3.86%;以及RB41 属,分别占总物种的4.57%,4.68%,3.64%,2.94%和3.79%。与DCK 相比,DSP 处理的Subgroup_6 属和RB41 属分别提高了70.45% 和2.41%,而DSB、DPB 和DSPB 处理的Subgroup_6 属的相对丰度分别降低了13.55%、24.14% 和10.57%,RB41 属分别降低了20.42%、35.60% 和17.03%,Skermanella 属分别提高了 66.29%、112.35% 和70.81%(图4)。
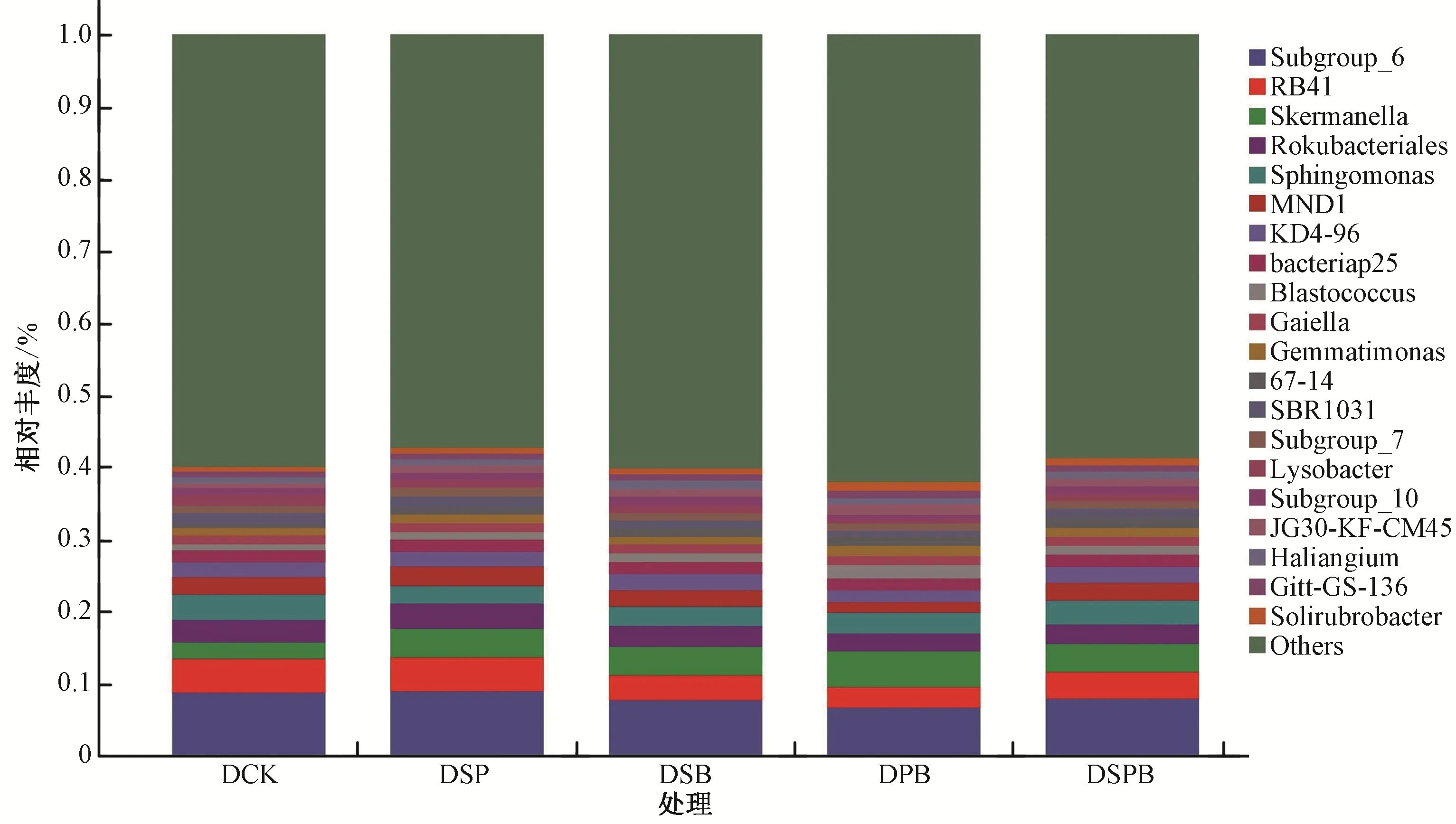
图4 属水平细菌群落的相对丰度Fig.4 Relative abundance of bacterial communities at the genus level
2.5 外源土壤调理剂增施对滴灌玉米田土壤细菌群落结构的分析
基于Bray–Curtis 距离对不同处理的土壤样本微生物群落组成进行非度量多维尺度(Non-metric multidimensional scaling analysis,NMDS)分析(图5),细菌群落NMDS 分析stress 为0.067 6,说明NMDS 分析的结果更可靠。其中,DPB 处理与其他处理的距离较远,说明这个处理与其他处理的土壤细菌群落组成丰度存在差异,其他4 个处理样本点的距离较近,说明这些处理的土壤细菌群落结构组成丰度相似。

图5 基于不同处理下细菌群落的NMDS分析Fig.5 NMDS analysis of bacterial community under different treatments
2.6 外源土壤调理剂增施对滴灌玉米田土壤细菌种群的差异性分析
在图6(a)中不同颜色的条形表示在不同处理组别中丰度较高的差异物种,且DCK 和DSB 处理的差异性更为显著。 紫色条表示在DPB 处理中显著增加的种群是o_Soilrubrobacterales目和绿弯菌纲(c_Chloroflexia);绿色条表示在DSB 处理中显著增加的种群是o_Betaproteobacteriales 和g_Subgroup_10;红色条表示在DSP 处理中显著增加的种群是o_Actinomarinales 和拟杆菌目(o_Bacteroidales);青色条表示在DSPB 处理中显著增加的种群是杆状菌属(g_Maricaulis)和多孢菌属(g_Thermopolyspora)。在图6(b)中,如图例所示,这36个物种是具有显著差异的标志物种。
2.7 外源土壤调理剂增施对滴灌玉米田土壤细菌群落结构的随机森林分析
由图7 可以看出,假诺卡氏菌属(Pseudonocardia)、孢囊菌属(Sorangium)和IMCC26256 属是增施外源土壤调理剂后微生物变化的标志性物种(Biomaker)。

图7 属水平土壤细菌群落结构随机森林分析Fig.7 Random forest Analysis of soil bacterial community structure at genus level
2.8 RDA冗余分析
在门水平上,冗余分析(redundancy analysis,RDA)分析显示[图8(a)],RDA1 和RDA2 分别解释细菌群落结构总差异的18.06%和1.22%。土壤环境因子pH 对细菌群落结构组成的影响最大,其次是HN 和EC。pH 被认为是土壤细菌群落结构变化的重要预测因子。放线菌门(Actinobacteria)与土壤pH 和速效磷含量呈正相关关系;芽单胞菌门(Gemmatimondetes)与土壤pH 和电导率为正相关关系;酸杆菌门(Acidobacteria)与土壤pH 呈正相关关系;绿弯菌门(Chloroflexi)与土壤水解氮含量呈正相关关系;变形菌门(Proteobacteria)与土壤水解氮、速效钾和速效磷含量呈正相关关系。在属水平上,冗余分析(redundancy analysis,RDA)分析显示[图8(b)],RDA1 和RDA2 分别解释细菌群落结构总差异的19.72%和RDA2。土壤环境因子EC 对细菌群落结构组成的影响最大,其次是pH 和AP。Skermanella 属与土壤pH、电导率和水解氮含量呈正相关关系;Subgroup_6属、己科河菌属(Rokubacteriales)、RB41属与土壤pH 为正相关关系;鞘氨醇单胞菌属(Sphingomonas)与土壤速效钾、速效磷含量呈正相关关系。因此,外源土壤调理剂增施可能通过改变盐渍化土壤化学性质,进而提高土壤细菌群落多样性和影响土壤微生物群落结构,最终优化土壤结构。

图8 土壤细菌群落结构与化学性质的相关性分析(RDA)Fig.8 Correlation analysis of soil bacteria structure with chemical properties(RDA)
2.9 不同处理对玉米产量相关指标的影响
由表3可以看出,DPB 处理的玉米行数最多、秃尖长的值最大;DSB 处理的玉米行粒数和穗长值最大;但无显著变化(P>0.05)。但是玉米穗粗和脱粒重在各处理之间存在显著差异(P<0.05),DSP 处理的穗粗是最高的,DPB 处理的脱粒重最高。综合来看,DPB 处理对玉米行数、秃尖长和脱粒重影响最大,对玉米产量的提高起一定作用。
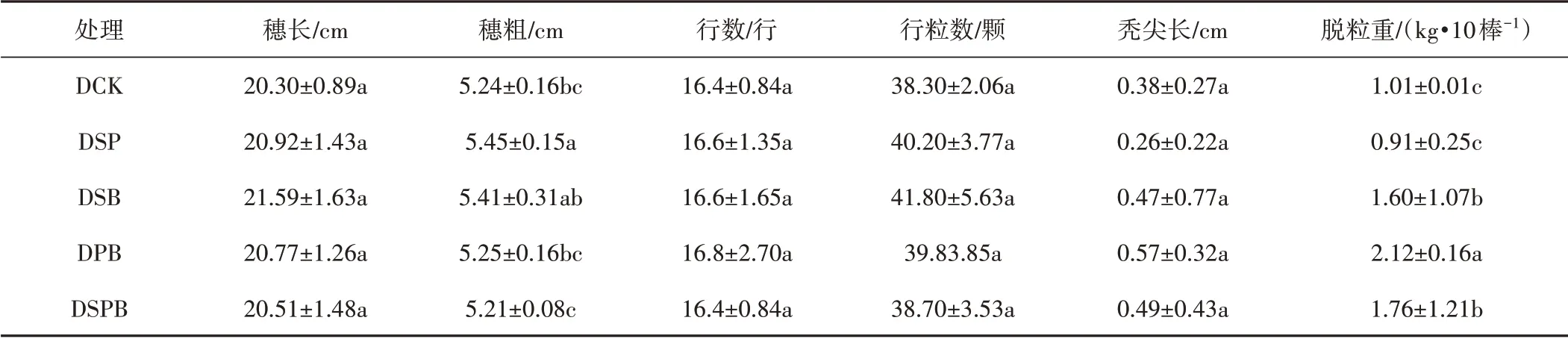
表3 不同处理的玉米产量相关指标Tab.3 Related indexes of corn yield under different treatments
2.10 土壤细菌对玉米产量指标的影响
放线菌门与脱粒重呈正相关关系,而酸杆菌门、Subgroup_6属和己科河菌属与脱粒重呈负相关关系(P<0.05),RB41属与脱粒重呈极显著负相关关系(P<0.01),见表4。

表4 土壤细菌与玉米产量指标的相关性Tab.4 Correlation between soil bacteria and maize yield index
3 讨论
3.1 外源土壤调理剂增施对滴灌玉米田土壤细菌群落的影响
外源土壤调理剂增施可改变土壤细菌群落多样性。与对照相比,DSB 和DSPB 处理提高了土壤细菌群落的多样性指数。这可能是因为外源土壤调理剂可为微生物提供生长发育的能量,进而增加某一种或几种物种,最终使得细菌群落多样性增加,这与前人[11]的研究结果一致。
在本研究中,变形菌门是最为优势的土壤细菌门,其次优势菌门依次为:放线菌门和酸杆菌门。该试验田土壤为盐渍化土壤,由此推测变形菌门是盐渍化土壤中的主要优势群落,这与多位学者的研究结果相似[12-14]。变形菌门属于有益菌群[15],且DSB 和DSPB 处理均提高了其相对丰度,这说明外源土壤调理剂增施可增多有益细菌的比例。有研究发现,放线菌门可产生大量的多种抗生素[16],放线菌门作为第二大优势细菌门,表明该试验田盐渍化土壤有利于放线菌的生长繁殖。而且放线菌门具有丝状形态,有降解和利用有机物料的潜在能力[17],因此将外源土壤调理剂施入盐渍化土壤后,可为放线菌门提供较多营养物质,使其在盐渍化土壤中生长具有优势,成为优势菌群。在属水平上,其他未知菌属占全部菌属的60%左右,说明该研究区土壤中依然存在着大量未被挖掘利用的属水平细菌。不同处理的土壤细菌优势属均为Subgroup_6属,其次依次为Skermanella 属和RB41 属。除了DSP 处理,其
他处理均降低Subgroup_6 属和RB41 属的相对丰度;各处理均提高Skermanella 属的相对丰度,Skermanella 属为典型的生物固氮菌[18],在盐渍化土壤中,生物固氮极其重要,固氮微生物的增加可使得土壤氮素养分含量提高,且在其中起着一定的重要作用。
3.2 土壤化学性质对细菌群落的影响
在NMDS 分析中表明,DPB 处理与其他处理的距离较远,说明这个处理与其他处理的土壤细菌群落组成结构存在差异,这表明通过增施外源土壤调理剂可改变土壤细菌群落结构。而且土壤化学性质也影响着土壤微生物群落的变化[19,20],在本研究中,土壤环境因子pH 和电导率是影响土壤细菌群落的主要因素。 放线菌门 (Actinobacteria)、酸杆菌门(Acidobacteria)、Skermanella 属、Subgroup_6 属和RB41 属与pH 有较强的正相关性;Skermanella 属与电导率有较强的正相关性。其中,pH 和电导率对酸杆菌门的影响与张萍等的研究一致[21]。因此,pH 值是影响细菌群落的重要因素,与其具有显著的相关关系,而且有学者研究证明pH 被认为是土壤细菌群落结构变化的重要预测因子[22],pH 已被发现在多个地理尺度上与一般微生物群落组成高度相关[23]。因此,外源土壤调理剂增施可能通过改变盐渍化土壤化学性质,提高土壤细菌群落多样性和影响土壤微生物群落结构,进而提高农田生态系统的生产力、优化土壤结构。
4 结论
外源土壤调理剂增施改变了土壤细菌群落多样性及其结构组成,DSB(保水剂+生物炭)和DSPB(保水剂+聚丙烯酰胺+生物炭)处理提高了土壤细菌群落的多样性指数;各处理的土壤细菌优势类群为变形菌门(Proteobacteria)和Subgroup_6 属。假诺卡氏菌属(Pseudonocardia)、孢囊菌属(Sorangium)和IMCC26256属是增施外源土壤调理剂后细菌群落变化的标志性物种。不同外源土壤调理剂增施显著改变了土壤pH 和电导率,DPB 处理的水解氮含量显著增加,但对其他土壤速效养分影响不显著。冗余分析表明土壤pH 和电导率是影响土壤细菌群落结构的主要环境因子。在滴灌条件下各处理均可不同程度地提高有益细菌菌群的相对丰度,如放线菌门、芽单胞菌门和Skermanella 属,降低部分不适宜在该地生长的菌群,如酸杆菌门和Subgroup_6 属,DPB 和DSPB 处理尤为显著。DPB 处理对玉米行数、秃尖长和脱粒重的影响最大,对玉米产量的提高起一定作用,且放线菌门对玉米脱粒重起正向促进作用。综上,短期实验结果表明DPB 处理改善土壤细菌群落结构和化学性质、提高玉米产量的效果较好,可在当地推广示范。

