α-MnO2纳米棒:一种催化葡萄糖级联反应的串联酶
张元红
(山东农业大学化学与材料科学学院,山东 泰安 271018)
近年来,具有过氧化物酶和类氧化酶活性的串联酶被开发用于葡萄糖比色检测,它具有多种催化功能,可以同时催化级联反应。然而,大多数串联酶都有一个共同的缺点[1-3],即它们的最佳反应通常发生在pH值约为3的酸性溶液中,而在中性条件下,它们的级联催化活性可以忽略不计。这一缺点严重限制了它们在需要接近中性pH值(pH 5.0~7.4)的生物系统中的进一步应用。尽管最近报道了几种在近中性pH值下表现出良好催化活性的串联酶模拟物[4-5],但开发在近中性pH值下表现出优异催化活性的串联酶仍然非常有意义。
在这里,选择MnO2是因为其独特的化学、化学催化、电催化和光催化特性[6-9]。我们不仅发现了串联纳米酶-MnO2纳米棒,该方法不仅可以实现葡萄糖的快速肉眼定性分析,还可以实现葡萄糖的分光光度定量分析。由于邻近效应和原位反应,该方法具有较高的灵敏度和较低的检测限。更重要的是,这项工作达到了真正意义上的“一锅”、“无酶”和“中性条件”的葡萄糖检测。
1 实验部分
1.1 材料来源
高锰酸钾、盐酸(37%)、3,3’,5,5’-四甲基联苯胺(TMB)、葡萄糖、果糖、麦芽糖和蔗糖从中国阿拉丁化学试剂公司采购。所有化学品均为商业采购,使用时无需进一步纯化。
1.2 α-MnO2纳米棒的制备 [10]
将1.3 g高锰酸钾溶解在150 mL超纯水中,并在磁力搅拌器中搅拌。搅拌5 min后,逐滴加入1 mL浓HCl(37%)、继续搅拌5 min,以获得完全均匀的溶液。将溶液转移到100 mL聚四氟乙烯内衬不锈钢高压反应器中,并将其置于140 ℃ 的烘箱中反应16 h。从反应器中取出溶液并冷却至室温。通过离心收集棕色产品,并用去离子水洗涤4~5次、乙醇洗涤3次,去除最终产品中可能残留的杂质。最终在80 ℃下干燥24 h后得到样品。
1.3 葡萄糖的比色反应
在不同浓度的葡萄糖溶液中加入α-MnO2纳米棒溶液(500 μL, 1 mg/mL)和柠檬酸-磷酸氢二钠缓冲液(100 mM, pH 7.0)。将混合溶液置于40 ℃下孵育25 min,加入TMB溶液(100 μL, 15 mmol)。最后用紫外分光光度计测量652 nm处的吸光度。
2 结果与分析
2.1 扫描电镜
采用溶剂热法制备了具有高双酶催化活性的α-MnO2,用扫描电镜对α-MnO2的形貌进行了表征。如图1所示,直径约为20~100 nm的α-MnO2的微米级一维棒状结构。棒状结构提供了独特的一维几何结构和大表面积,这是有效催化所必需的[11]。

图1 α-MnO2纳米棒的SEM图Fig.1 SEM image of α-MnO2 nanorods
2.2 XRD谱
为了进一步获得α-MnO2纳米棒的纯度和物相,获得了α-MnO2纳米棒的典型X射线衍射图来表征其晶体结构。从图2可以看出,所有衍射峰可以被认定为体心四方α-MnO2,表明所获得的是纯相α-MnO2。
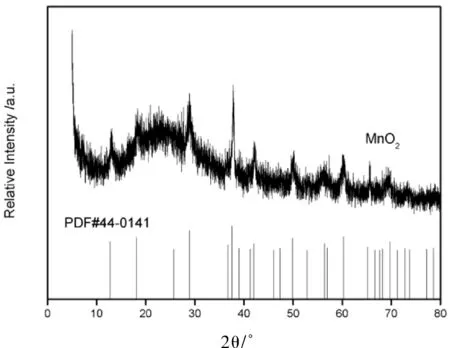
图2 α-MnO2纳米棒的XRD谱Fig.2 XRD patterns of α-MnO2 nanorods
2.3 葡萄糖检测的可行性

图3 不同反应体系的紫外-可见光谱Fig.3 UV-vis spectra of different reaction systems: TMB+glucose, TMB+catalysis and TMB+catalysis+glucose
为了验证α-MnO2纳米棒是否能够模拟催化葡萄糖级联反应,在柠檬酸-磷酸氢二钠缓冲溶液(pH=7)中测量了三种体系的吸光度。图3显示TMB-葡萄糖没有明显的吸收峰;而一个弱峰(652 nm)出现在TMB-α-MnO2体系中;幸运的是,当α-MnO2纳米棒加入TMB-葡萄糖反应系统中时,652 nm处的吸收峰明显增加。三个体系表现出来的不同特点说明葡萄糖的级联反应主要依赖α-MnO2纳米棒催化作用。在α-MnO2纳米棒-TMB-葡萄糖体系中并未加入H2O2,可以推测α-MnO2纳米棒首先催化氧化葡萄糖生成H2O2,然后催化H2O2氧化为oxTMB从而在652 nm产生吸收,说明α-MnO2纳米棒具有串联酶活性。
2.4 葡萄糖检测的条件优化
图4显示的是在不同pH条件下,652 nm处oxTMB的吸收强度。在弱酸(pH=3~5)或弱碱性(pH=8~10)环境中时,α-MnO2纳米棒对葡萄糖的响应相对较低。然而,一旦pH值位于6~7范围内,尤其是在pH=7的环境中,紫外-可见吸收峰强度最大。溶液的相应照片也显示了最佳颜色变化。结果表明,α-MnO2纳米棒在中性环境中具有较高的催化葡萄糖级联反应的活性。
此外,我们还研究了不同温度(包括20、30、40、50、60 ℃)的影响,考察了相应的比色传感性能。根据图5展示的oxTMB在652 nm处的紫外-可见吸收峰强度,α-MnO2纳米棒在40 ℃时对葡萄糖具有较高的串联酶活性。
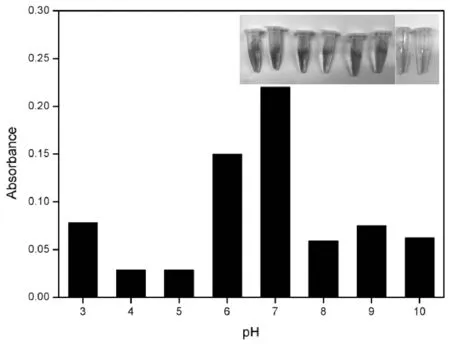
图4 α-MnO2纳米棒在不同pH下的反应活性Fig.4 The optimization of pH value for the reactivity of α-MnO2 nanorods
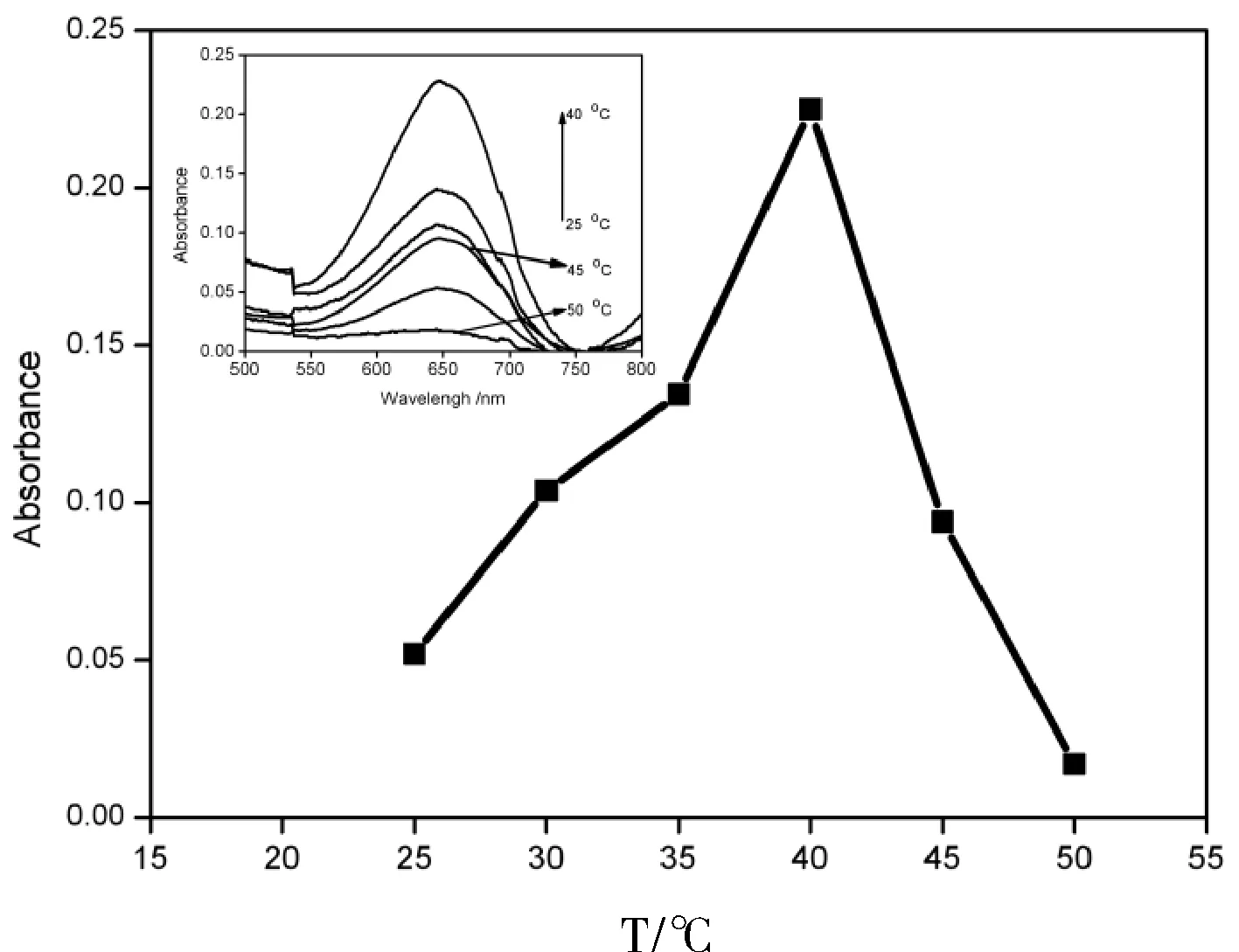
图5 α-MnO2 纳米棒在不同温度下的反应活性Fig.5 The optimization of temperature for the reactivity of α-MnO2 nanorods
2.5 葡萄糖检测
接下来,我们研究了α-MnO2纳米棒对葡萄糖的检测性能。图6显示了在不同浓度的目标葡萄糖存在下α-MnO2纳米棒体系的紫外-可见吸收光谱。随着葡萄糖浓度(0~5 mM)的增加,紫外-可见吸收响应逐渐增强。652 nm处对应吸光度与葡萄糖浓度的校准曲线在图7中显示,插图给出的是α-MnO2纳米棒的相对吸光度强度和葡萄糖浓度(0.5~250 μM)的线性校正。线性方程为Y=2.51908x+0.31578 (相关系数R2=0.9928),葡萄糖的检出限为0.3 μM。
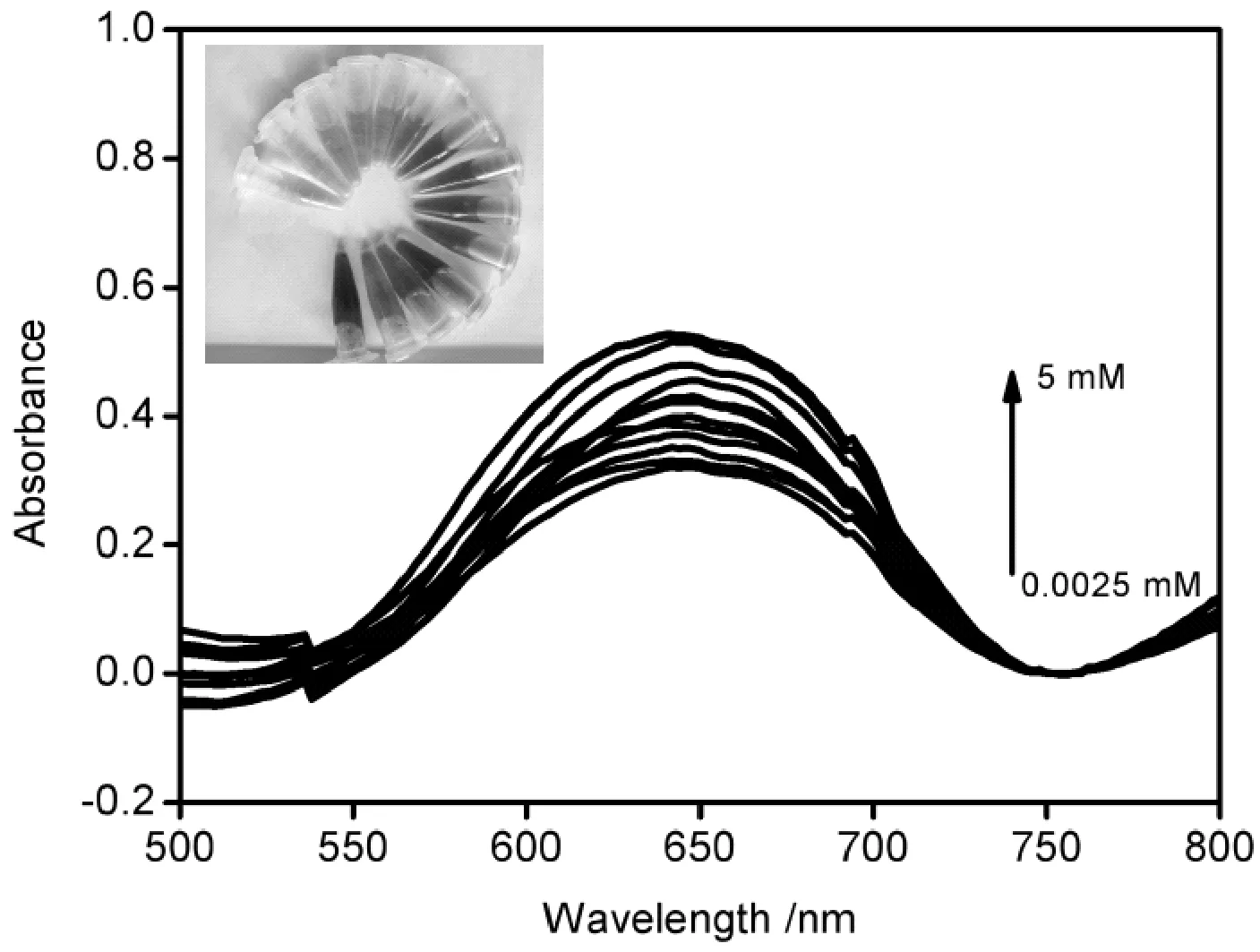
图6 不同葡萄糖浓度条件下的紫外-可见光谱图Fig.6 UV-visible spectra of glucose and TMB in the presence of α-MnO2 nanorods with different glucose
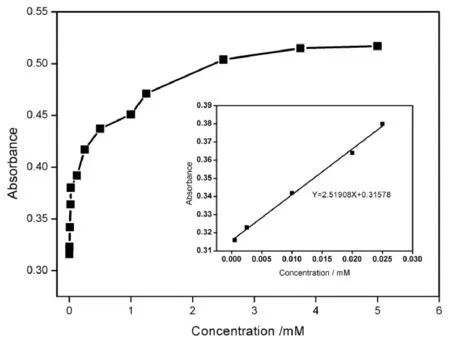
图7 652 nm处对应吸光度与葡萄糖浓度的校准曲线; 插图显示652 nm处葡萄糖检测的线性校准曲线Fig.7 Calibration curve of corresponding absorbance at 652 nm versus glucose concentrations Insert shows linear calibration curve for glucose detection at 652 nm
2.6 葡萄糖检测的选择性
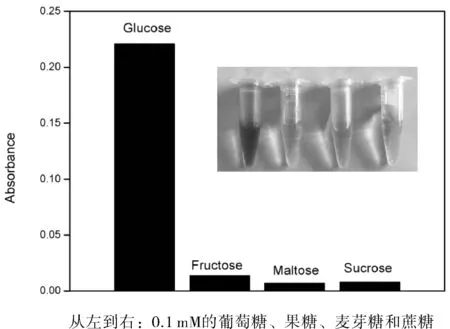
图8 α-MnO2纳米棒的选择性实验Fig.8 Selectivity of α-MnO2 nanorods
考虑到实际研究样品的复杂性,测试α-MnO2纳米棒对葡萄糖的选择性至关重要。因此,在相同条件下,乳糖、果糖和蔗糖被用作对照。结果(图8)表明,只有葡萄糖的加入才产生显著的吸光度变化,证实了α-MnO2纳米棒对葡萄糖具有优良的选择性。
3 讨 论
葡萄糖检测为通常采用将过氧化物酶模拟物与天然葡萄糖氧化酶(GOx)相结合方法,通过两步反应达到检测目标分子的目的[12-13]。具体而言,GOx首先用于在中性缓冲液中催化葡萄糖氧化生成H2O2,然后在酸性溶液中由过氧化物酶模拟物催化,以诱导显色反应来指示目标物的水平。显然,两步方案在测试操作和分析性能方面存在一些不足:一方面,两种酶/纳米酶应提供不同的反应pH条件,这使得研究中的检测操作步骤复杂[14],另一方面,第一步生成的H2O2中间体容易自发分解,其部分损失会限制检测灵敏度。因此,具有同时具有氧化物酶活性和过氧化物酶活性的纳米酶材料的开发将有利于解决上述问题。
4 结 论
葡萄糖是生物体中新陈代谢不可或缺的营养物质,也是人体重要的组成部分。葡萄糖的水平决定着动物、植物以及微生物等生理活动过程。糖尿病和低血糖症是与葡萄糖代谢异常有关的临床疾病,血糖含量过高或者过低都会引起相应的疾病。另外,葡萄糖也广泛应用于食品加工工业中,在保健品加工生产、乳制品生产及饮料制品生产等过程中,葡萄糖含量都是重要的检测指标。本文采用简单的水热法制备了α-MnO2纳米棒,它可以在中性条件、无天然酶存在的条件下一锅中选择性地催化葡萄糖级联反应。该纳米酶有望在临床血糖检测和/或食品工程中有一定的应用前景。
—— “T”级联

