熔盐辅助硅热还原法制备二硼化钛粉体
刘家良,韩兵强,张锦化,陈俊峰
(武汉科技大学 材料与冶金学院;省部共建耐火材料与冶金国家重点实验室,湖北 武汉 430081)
超高温陶瓷二硼化钛(TiB2)是硼(B)和钛(Ti)二元体系中最稳定的化合物,Ti和B之间以共价键形式结合成六方准金属化合物。在TiB2晶体中,B和Ti的原子面交替构成三维结构[1-2]。TiB2陶瓷具有优异的物理与化学性能,如高熔点(3 225 ℃)、高硬度(维氏硬度可达39.6 GPa)、优异的耐磨性、低温抗氧化性、抗腐蚀性(可抵抗熔融金属、盐酸和氢氟酸的腐蚀)、优良的电学性能、良好的导热性以及特殊的光学性能等[3-5]。作为超高温陶瓷材料的TiB2及其复合材料主要应用于航空航天、陶瓷、冶金、军工、核物理、耐火材料、光学及电化学等行业领域,例如可制成金属真空镀膜的蒸发舟[7]、炭阴极新型涂层[8]和计算机磁头纳米抛光液[9]等。
TiB2粉体的制备主要采用热还原法,分为碳热还原法、镁热还原法、硼热还原法等。其中,碳热还原法的反应温度较高,容易造成TiB2粉体烧结团聚,晶粒异常长大,影响粉体的均匀性;镁热还原法的粉体制备过程中易形成难以去除的中间产物,无法避免使用酸洗等污染环境的后处理工艺。为了改善TiB2粉体性能,研究人员在热还原法基础上结合使用了如熔盐法[10]、机械合金化[11]、自蔓延高温合成法[12]等工艺技术。
硅热还原法具有低温、可控等特点,但对反应副产物二氧化硅(SiO2)的分离技术是采用该方法制备TiB2粉体面临的关键技术难题。Qin等[13]以无水硼砂为原料,基于硅热还原法制备了TiB2粉体,通过引入钠盐,实现了TiB2和SiO2的有效分离。在前述工作基础上,本文中拟以偏硼酸钠(NaBO2·4H2O)作为硼源,并在反应体系中引入熔盐硅酸钠(Na2SiO3),采用熔盐辅助硅热还原法制备超高温陶瓷TiB2粉体;讨论合成温度、添加Na2SiO3和热水水洗法对反应进程的影响,并表征目标产物TiB2的微观形貌,以期实现对副产物的绿色、环保式的有效去除。
1 实验
1.1 原料
二氧化钛(TiO2,质量分数为98.0%);工业硅粉(Si,质量分数为98.4%);偏硼酸钠(NaBO2·4H2O,AR)。
1.2 制备方法
未添加钠盐Na2SiO3时的化学反应方程式为
2TiO2+5Si+4NaBO2=2TiB2+2Na2Si2O5+SiO2,
(1)
添加钠盐Na2SiO3时的化学反应方程式为
2TiO2+5Si+4NaBO2+Na2SiO3=2TiB2+3Na2Si2O5。
(2)
首先将NaBO2·4H2O在600 ℃温度条件下进行脱水处理,然后根据反应(1)、(2)按照化学计量比进行配料,混合研磨后将混合均匀的样品放入带盖的石墨坩埚中;反应在刚玉管式炉中进行,并采用流动氩气(Ar)保护;分别在900、1 000、1 100、1 200 ℃合成温度条件下保温4 h,随炉冷却至室温;将反应产物用沸水溶解、过滤、洗涤,直至滤液的pH接近于7,分离后的TiB2样品置于110 ℃烘箱中进行干燥。
1.3 仪器与设备
使用X'Pert Pro MPD型X射线衍射仪(XRD,Malvern Panalytical)分析产物水洗前、后的物相组成,测试条件为Cu靶Kα射线(λ=0.154 18 nm),Ni滤波,管电压为40 kV,管电流为40 mA,2θ为10°~80°,超能探测器。使用Factsage热力学软件中的Viscosity模块计算反应过程中液相的黏度。采用Nicolet IS50型傅里叶变换红外光谱(FTIR,ThermoFisher Scientific)对合成产物中非晶相组分进行分析,以了解其中的结构基团。通过Apreo S Hivac型扫描电子显微镜(SEM,ThermoFisher scientific)和JEM-2100型透射电子显微镜(TEM,JEOL)对TiB2产物进行形貌和结构识别。
2 结果与讨论
2.1 产物的物相组成
2.1.1 钠盐Na2SiO3的影响
在保温时间都为4 h的前提下,为了研究是否添加钠盐Na2SiO3的影响,不同合成温度条件下获得的未经水洗的产物的XRD图谱如图1所示。
由图1(a)可以看出,未添加钠盐Na2SiO3时,在合成温度为900 ℃时,已经开始生成目标产物TiB2(PDF 35-0741),同时可观察到几种中间产物,如Na—Ti—O的化合物(Na1.7Ti6O11,PDF 47-0097)、Ti2O3(PDF 76-0145)和NaTiSi2O6(PDF 77-0468);随着合成温度的升高,这些物相衍射峰明显降低。除了存在多种中间产物,原料Si的衍射峰也可被观察到;当合成温度升高到1 000 ℃时,Na1.7Ti6O11、Ti2O3和NaTiSi2O6等3种中间产物的衍射峰值明显减弱,但仍然可以检测到少量的Si;当合成温度升高到1 100 ℃时,中间产物消失,主晶相为目标产物TiB2,但仍然存在少量的Si;当合成温度升高到1 200 ℃时,仅有目标产物TiB2,中间产物和Si的特征衍射峰完全消失。合成温度在900 ℃时,反应虽不完全,但TiB2衍射峰明显,此时TiO2-Na2O-B2O3三元系统低共熔点约为480 ℃[14],这种熔融态提供了液相环境,Si不断溶于液相中,加快了硅热反应的进行;随着反应的进行,系统逐渐向TiO2-Na2O-B2O3-SiO2四元组分系统转化,虽然熔体不断吸收生成的SiO2,但1 100 ℃时仍然可以检测到单质Si的存在,这与该系统熔体对原料Si的溶解度有关。
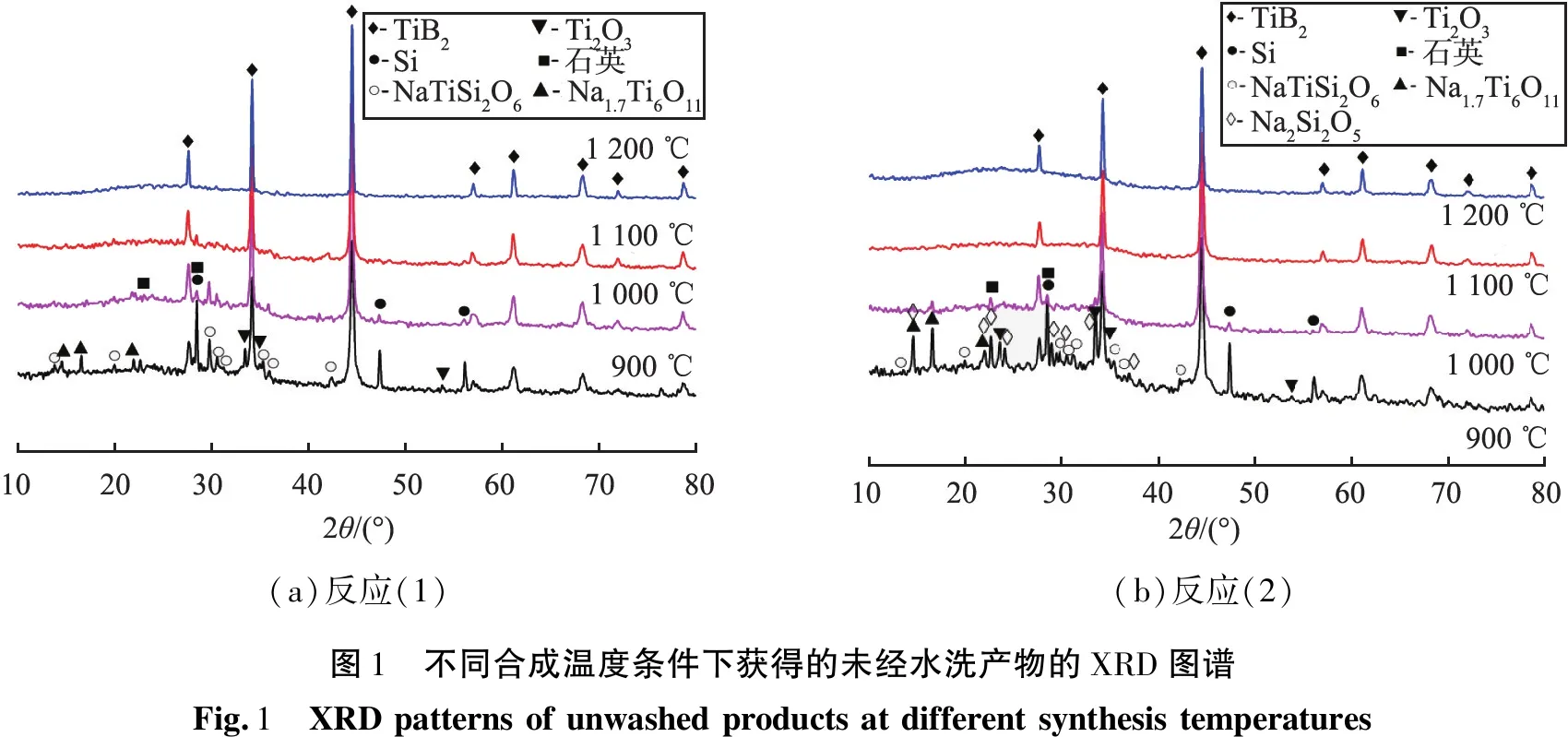
由图1(b)可知,添加钠盐Na2SiO3时,在合成温度在900 ℃时,除了存在3种中间产物衍射峰,还可以观察到少量Na2Si2O5(PDF 74-1821)衍射峰,这是熔体吸收了部分SiO2(PDF 70-3315))形成的,Na2SiO3的引入改变了熔体组成,反应初期已经形成了TiO2-Na2O-B2O3-SiO2四元组分系统,该系统的低共熔点在510 ℃左右,远小于反应温度,同样提供了液相环境;但由于温度较低,黏度较大,总体反应活性不高,反应仍不够完全;当合成温度升高到1 000 ℃时,体系的黏度降低,促进了反应进程,因此中间产物的衍射峰基本全部消失。合成温度继续升高至1 100 ℃,除了目标产物TiB2衍射峰外,未观察到其他物相的特征衍射峰,表明Na2SiO3的引入改变了熔体组成,也影响了熔体对Si的溶解度。当合成温度升高到1 200 ℃时,TiB2衍射峰强度基本不变,表示合成温度在1 100 ℃时,反应已经趋于完全。
假设最终产物无TiO2和B2O3,全部转化成TiB2,以TiO2的变化来表示整体反应程度,再结合反应方程,通过假设反应初期与结束的液相组成,模拟理论液相组成变化与反应程度的关系,反应(1)、(2)中理论液相组成与反应程度的关系如表1和表2所示。

表1 反应(1)中理论液相组成与反应程度关系Tab.1 Relationship between composition of theoretical liquid phase and reaction degree in reaction (1)

表2 反应(2)中理论液相组成与反应程度的关系Tab.2 Relationship between composition of theoretical liquid phase and reaction degree in reaction (2)
采用Factsage热力学软件,计算得到的反应(1)、(2)中理论液相组成的理论黏度如图2所示。由图2可知,反应(2)的总体黏度小于反应(1)的,这是由于反应液相体系中SiO2的不断形成,反应黏度都呈增大趋势,反应温度越高,总体反应黏度越小。
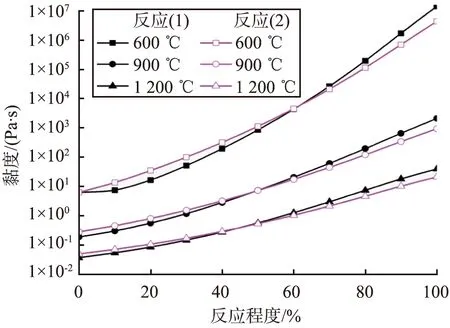
图2 反应(1)、(2)中理论液相组成的理论黏度Fig.2 Theoretical viscosity of theoretical liquid composition in reactions (1) and (2)
根据反应(1)以及XRD图谱,可以推导出如下可能的主要反应方程式
Si+4TiO2=SiO2+2Ti2O3,
(3)
4NaBO2+3Si=2Na2SiO3+SiO2+4B,
(4)
Na2SiO3+SiO2=Na2Si2O5,
(5)
Ti2O3+Na2Si2O5+2SiO2=2NaTiSi2O6,
(6)
4NaTiSi2O6+3Si+8B=4TiB2+2Na2Si2O5+7SiO2。
(7)
2.1.2 热水水洗的影响
当合成温度为1 100 ℃、保温时间为4 h时,反应(2)制得产物热水水洗前、后的XRD图谱如图3所示。由图3可以看出,水洗后非晶包消失,TiB2特征衍射峰更明显,经计算可知,产物TiB2的晶格常数a为0.302 911 nm,c为0.322 773 nm,与ICDD标准卡PDF 35-0741的数据a为0.303 034 nm和c为0.322 953 nm基本吻合。

图3 反应(2)制得产物热水水洗前、后的XRD图谱Fig.3 XRD patterns of products obtained by reaction (2) before and after hot water washing
当合成温度为1 100 ℃、保温时间为4 h时,热水水洗前、后反应(2)制得的产物与商业粉体试剂TiB2(Aladdin T119914)的傅里叶变换红外光谱如图4所示。由图4可见,特征峰1 367.94 cm-1对应Ti—B键振动峰,774.27 cm-1特征峰是B—O—B基团的弯曲振动峰[15],振动峰948.28 cm-1包括900~1 200 cm-1范围内可能为Na2O-B2O3-SiO2玻璃体系的吸收振动峰[16-17],振动峰475.06 cm-1为Si—O—Si的振动峰[18]。产物进行水洗后,能观察到Ti—B吸收振动峰,以及微弱的B—O—B基团的弯曲振动峰,与商品TiB2吸收峰相同,证明水洗效果明显。

图4 热水水洗前、后反应(2)制得的产物与商业粉体试剂TiB2的傅里叶变换红外光谱Fig.4 Fourier transform infrared spectra of products prepared by reaction (2) before and after hot water washing and commercial powder reagent TiB2
综上,本实验的目的是试图通过用热水水洗法去除副产物硅酸钠,而不使用其他可能造成环境污染的后处理方法。在图1(a)中未观察到大量SiO2的出现,表明部分SiO2已经以非晶相形态存在。
另外,在后续水洗实验中发现,未添加钠盐Na2SiO3时制得的块状产物经过8 h的热水洗涤后未观察到明显的分散现象,溶液pH值为8~9,属弱碱性,此时形成的硅酸钠溶液体系的模数(SiO2与Na2O的摩尔数之比)可能较高。当模数大于3时在常压下难以通过热水水溶,因此加入适量的Na2SiO3进行模数调整处理,在反应过程中,吸收SiO2的同时降低硅酸钠模数,进而实现常压下采用热水水洗法去除副产物。根据反应(2)可知,副产物硅酸钠的模数理论上为2,可以在常压下通过热水实现水溶。
当合成温度为1 100 ℃、保温时间为4 h时的部分块状产物,经过热水水洗,0.5 h就可以实现样品的有效分散,溶液pH为12~13,属强碱性,将获取的前几次滤液做化学分析检测,实际计算模数约为2,与理论计算结果相符。
2.2 目标产物TiB2的微观形貌
图5为目标产物TiB2的微观形貌。由图5(a)、(b)可见,TiB2以六方柱状单晶为主,结晶性较好,多数晶粒粒径在400 nm左右;存在少量异常长大的颗粒,这种较大尺寸的晶粒有层片状晶粒发展趋势,可能与原料粒度有关。由图5(c)为选区的二硼化钛晶格条纹,经过测量该条纹在晶体中显示为0.153 7 nm的晶面间距,与(110)晶面的晶格条纹有较好的匹配。图5(d)为(b)选区的电子衍射斑点,通过软件计算与分析,(100)、(010)和(110)晶面相对应的晶面间距与TiB2标准物相卡片(PDF 35-0741)对应较好,证明了产物TiB2结晶较为完整。

3 结论
以TiO2、Si粉、NaBO2·4H2O作为初始原料,采用熔盐辅助硅热还原法,成功合成出晶粒尺寸较小且规整的六方柱状单晶TiB2粉体。
1)在合成温度为1 100 ℃、保温时间为4 h时,可以得到结晶程度高的TiB2晶粒,粒径约为400 nm;有少部分颗粒的粒径可达到1 μm,这种较大尺寸的晶体趋向于薄片状。
2)加入钠盐Na2SiO3可降低体系液相的黏度,加速Si的溶解,促进了反应进行,同时会吸收副产物SiO2,使硅酸钠熔体体系更加均匀。
3)通过调整硅酸钠模数,可在常压下通过热水水洗法去除副产物,避免了酸洗等污染环境的后处理模式,实现了绿色环保制备超高温陶瓷TiB2粉体的理念。

