Ag/AgCl改性Bi5O7I/Bi2O3复合材料光催化氧化单质汞性能
石 磊,张安超,张慧鸽,张倩倩,郑宏祥,张 旭,张景繁
(河南理工大学 机械与动力工程学院,河南 焦作 454003)
0 引 言
汞是一种剧毒重金属,由于其在环境中的扩散及传播具有持久性、生物聚积性和全球性,使汞污染成为世界范围内亟需解决的问题之一[1]。煤炭燃烧是汞污染的主要人为来源[2],我国能源结构以煤炭为主,已成为全球汞人为排放量最大的国家。燃煤烟气中汞主要以元素态汞(Hg0)、氧化态汞(Hg2+)及颗粒态汞(HgP)存在[3]。利用Hg2+易溶于水的特性,使用湿法烟气脱硫装置(WFGD)可去除;Hgp则可通过静电除尘器(ESP)或织物过滤器(FF)等颗粒控制装置去除。相较而言,Hg0易挥发且难溶于水,较难通过现有设备脱除[4]。因此,探究高效脱除Hg0的方法对燃煤烟气汞污染治理具有现实意义[5]。
多年来光催化治理汞污染的研究取得较大进展[6-9]。作为目前研究热点的半导体,卤氧化铋BiOX(X=Cl、Br、I)为四方晶体结构,其结构由[Bi2O2]2+和双卤素原子层组成[10-11]。在众多BiOX基光催化剂中,Bi5O7I由于结构多样、制备方法简单、可见光响应强已成为关注较多的卤氧化铋光催化材料。然而,作为单相光催化剂的Bi5O7I,其比表面积、光吸收能力和载流子传输效率仍不能满足实际应用的要求。为解决上述问题,可通过构建异质结的方法促进界面光生电子对分离和传输速率,增强光催化剂的吸光性能和比表面积。近年来,多种银基材料由于其良好的光响应性能和优异的污染物降解能力受到关注,如Ag/AgCl[12]、Ag/AgI[13]、Ag2O[14]和Ag2CO3[15]等。研究表明,贵金属沉积可作为光诱导电子的陷阱,减少电子-空穴对的复合,且负载贵金属Ag微纳米颗粒的光催化剂在可见光辐照下能够产生等离子体共振效应(SPR),进一步提高了其光催化活性。因此,使用银基改性铋基半导体形成的复合材料具有较大的应用前景。LIU等[16]发现在碳纤维布(CFC)上构建BiOBr/Ag/AgBr光催化剂对酸橙7(Acid Orange 7,AO 7)的降解率为99.0%,远高于CFC/BiOBr的降解率(55.0%)。DERIKVANDI等[17]发现Ag/AgCl和Cu/Cu2O对四环素的降解效率分别为30%和50%,而四元Ag/AgCl/Cu/Cu2O复合材料由于金属离子的SPR效应使其光降解性能高达97%。然而,铋基及其改性光催化剂在燃煤烟气汞污染治理方面的研究还较少,其光催化氧化效果和机理尚不明确。
为此,笔者制备了Ag和AgCl共改性的Bi5O7I/Bi2O3多元复合光催化剂,研究了其在液相可见光辐射下的脱汞性能,采用一系列表征手段对复合材料的物理化学结构进行分析,为揭示Ag/AgCl/Bi5O7I/Bi2O3四元光催化剂高效脱汞机理提供参考。
1 材料与方法
1.1 光催化剂的制备
1.1.1Ag/AgCl的制备
取5 g NaOH和20 mL乙二醇(EG)加入300 mL去离子水中,超声10 min至其完全溶解;分别将0.010 4 g KCl和0.023 7 g AgNO3溶于100 mL去离子水并依次缓慢滴加至上述强碱性溶液中,磁力搅拌2 h,静置4 h,所得沉淀物用乙醇和水混合溶液洗涤3~5遍,过滤后置于烘箱中80 ℃下干燥24 h,筛分至120目(0.125 mm),得到Ag/AgCl光催化剂。
1.1.2Bi5O7I/Bi2O3和Bi2O3材料的制备
分别取5 g NaOH和9.45 g Bi(NO3)3·5H2O,依次加入20 mL EG和300 mL去离子水的混合溶液中,超声10 min使其完全溶解;将10 mL含0.65 g KI的溶液缓慢滴加至上述混合溶液中,磁力搅拌2 h,静置4 h,所得沉淀物用乙醇和水混合溶液洗涤3~5遍,过滤后置于烘箱中80 ℃下干燥24 h,筛分至120目(0.125 mm),得到Bi5O7I/Bi2O3。制备未添加KI条件下的Bi2O3进行对比。
1.1.3Ag/AgCl负载Bi5O7I/Bi2O3四元复合材料的制备
分别取5 g NaOH和9.45 g Bi(NO3)3·5H2O,依次加入20 mL EG和300 mL去离子水的混合溶液中,超声10 min使其完全溶解,记为溶液A;将10 mL含有0.65 g的KI溶液缓慢滴加至A溶液中,所得混合物记为溶液B;20 min后,在持续搅拌作用下,分别将30 mL含有ymmol的KCl溶液(y=0.188、0.377、0.754、1.130、1.507和1.884 mmol)缓慢滴加至B溶液中,继续搅拌10 min,记为溶液C;将30 mL含有相同物质的量的AgNO3溶液滴加至C溶液,继续磁力搅拌2 h,静置4 h,所得沉淀物用乙醇和水混合溶液洗涤3~5遍,过滤后置于烘箱中80 ℃ 下干燥24 h,筛分至120目(0.125 mm),得到EG环境下制备的Ag/AgCl/Bi5O7I/Bi2O3-x(x=0.5、1.0、2.0、3.0、4.0和5.0),其中x为Ag原子与Bi原子的质量比。
1.2 表征方法
采用比表面积及孔隙分析仪(QuadraSorb SI)检测样品的N2吸附-脱附等温特性;使用德国布鲁克D8 Advance型X-射线衍射仪(XRD)测试样品的物相;采用场发射扫描电子显微镜(Quanta 430)获取光催化剂的形貌;使用紫外可见分光光度计(UV-4100)确定样品的紫外-可见漫反射光谱(DRS);采用X射线光电子能谱仪(XPS,Escalab 250xi)分析样品中的元素及其存在形态;在室温条件下,采用Bruker ER200-SRC光谱仪在黑暗或可见光照射下(λ>420 nm)检测溶液中电子自旋共振(ESR)光谱。
1.3 光催化剂活性分析
在室温下采用湿式鼓泡光催化反应装置进行光催化氧化单质汞性能研究,该装置的具体介绍参考文献[18]。试验中,模拟烟气由Hg0蒸气、O2(6%)、CO2(12%)和平衡N2组成。模拟气体总流量为1.50 L/min,烟气中Hg0蒸气质量浓度约50 μg/m3,光催化剂用量为0.10 g。可见光源由11 W荧光灯(FSL,YDN11-π.RR型)提供。使用俄罗斯LUMEX汞仪器公司生产的RA-915M测汞仪获得反应前后的汞浓度。光催化剂对Hg0的脱除效率(η,%)计算式为
η=(1-Cout/Cin)×100%,
(1)
式中,Cin和Cout分别为光催化反应器进口和出口的Hg0质量浓度,μg/m3。
2 结果与讨论
2.1 光催化剂的脱汞性能
2.1.1不同光催化剂对脱汞性能的影响
所制备光催化剂对Hg0的光催化氧化能力如图1所示。在荧光灯辐射下,Bi2O3和Bi5O7I/Bi2O3对Hg0的脱汞效率分别为2.5%和61.6%,表明Bi5O7I与Bi2O3之间具有一定协同作用。随Ag/AgCl负载量增加,光催化剂的脱汞性能逐渐提高。当Ag/AgCl与Bi5O7I/Bi2O3的质量比为3%、4%和5%时,光催化剂对Hg0的去除效率分别为98.5%、98.8% 和99.2%,结果表明Bi5O7I/Bi2O3和Ag/AgCl之间产生了良好的协同作用,使脱汞能力大幅提升。考虑到光催化剂的经济性,选取Ag/AgCl/Bi5O7I/Bi2O3-3.0作为研究对象考察各运行参数对脱汞性能的影响。
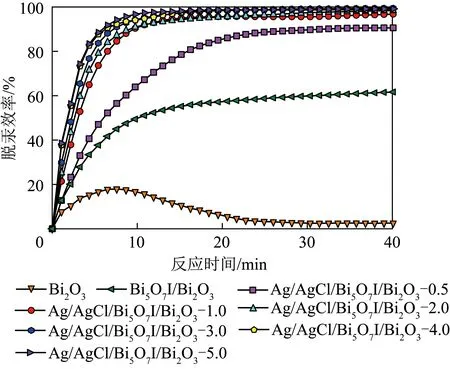
图1 荧光灯辐照下不同光催化剂对Hg0的脱除性能Fig.1 Removal performance of different photocatalysts for Hg0 removal under fluorescent lamp irradiation
为验证光催化剂的脱汞性能及了解试验误差,采用相同质量的Ag/AgCl/Bi5O7I/Bi2O3-3.0光催化剂在相同条件下进行了3次试验,如图2所示。相同条件下3次试验的脱汞效率分别为96.70%、99.10%和97.09%,平均脱汞效率为97.63%,相对误差约为1.5%。结果表明,脱汞试验受试验条件影响较小,试验误差可忽略。
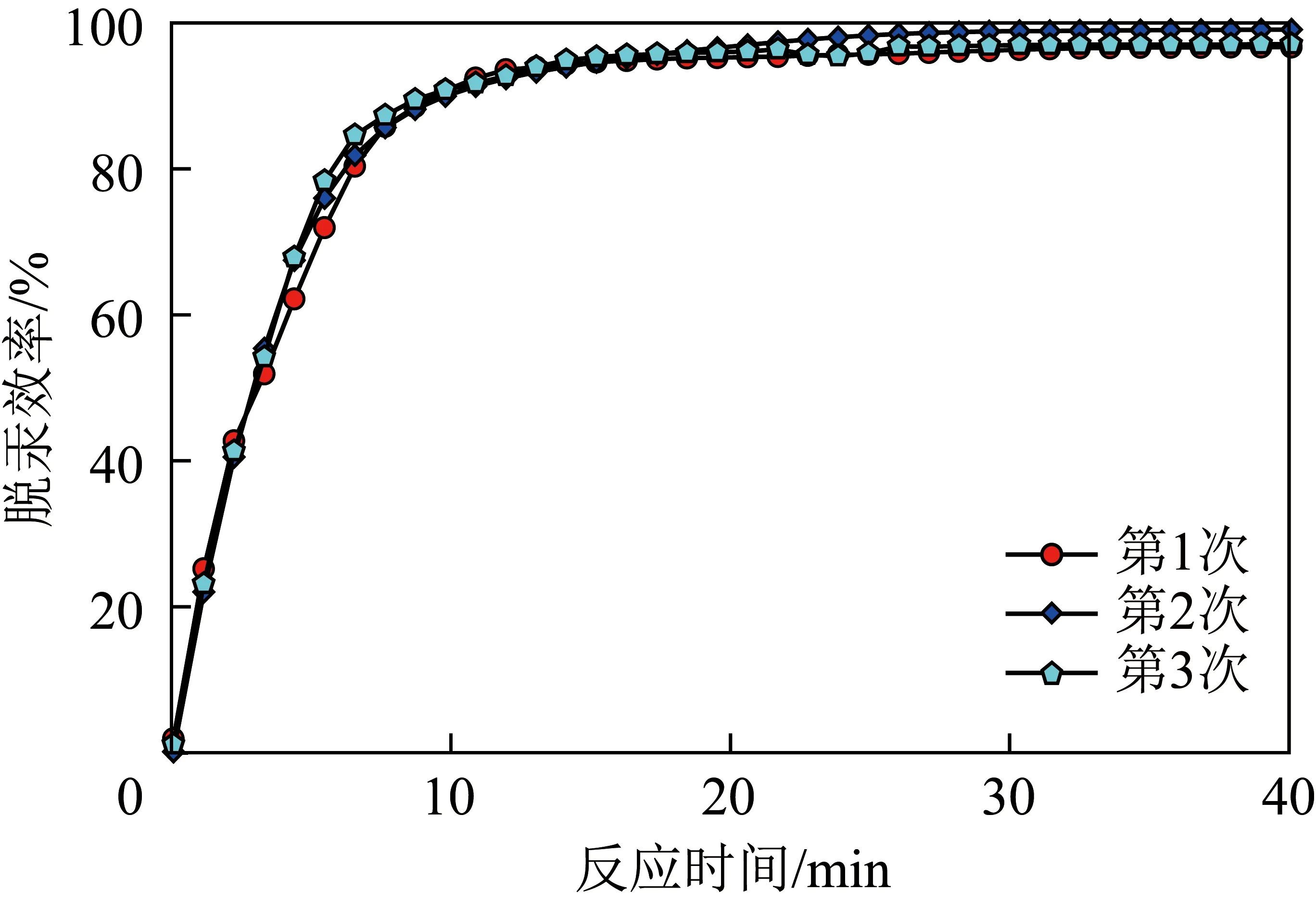
图2 光催化剂的重复脱汞试验Fig.2 Repeated mercury removal experiments of photocatalyst
2.1.2pH和阴离子浓度对脱汞性能的影响
反应溶液pH和阴离子浓度对脱汞效率的影响如图3所示。由图3(a)可知,pH<9时,Ag/AgCl/Bi5O7I/Bi2O3-3.0光催化剂的脱汞效率均保持在97%以上,表明该光催化剂在酸性、中性和弱碱条件下均具有良好的脱汞性能。对比发现,pH=12时,光催化剂的脱汞反应活性滞后约3 min。然而,随反应时间增加,光催化剂脱汞活性逐渐提高。据报道,在较高pH下,溶液中的OH-会消耗光生空穴(h+),导致光催化性能降低,发生的化学反应[19-21]如下:

(2)
这意味着在光催化氧化脱汞过程中,与·OH相比,h+具有更强的Hg0氧化能力。
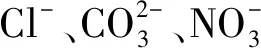
(3)
(4)
(5)
(6)
(7)
2.1.3SO2和NO对脱汞性能的影响
煤炭中含有S和N等元素,燃烧后会生成SO2和NO等酸性气体。虽然燃煤电厂现有的污染物治理设备可大幅降低SO2和NO排放,但烟气中仍会存在少量该类气体,因此研究SO2和NO对Hg0脱除性能的影响具有重要意义,SO2和NO对Hg0脱除性能的影响如图4所示。

图4 SO2和NO对Hg0的脱除性能Fig.4 Effects of SO2 and NO on Hg0 removal performance
由图4(a)可知,在通入250 mg/m3SO2后,光催化剂的脱汞效率由98%急剧下降至约5%;关闭SO2气体后,光催化剂的脱汞效率恢复至初始值。由于未通入SO2气体时反应溶液中产生了大量活性物质,溶液中通入少量SO2气体后,SO2会先与溶液中存在的活性物质反应,因此SO2通入约20 min后其脱汞效率急速降低。在100~170 min重复该试验,所得结果基本一致,验证了上述结论的正确性。SO2对Hg0脱除抑制的原因可能为大量活性物质的消耗,发生的化学反应[24]如下:
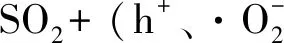
(8)
NO气体对Ag/AgCl/Bi5O7I/Bi2O3-3.0光催化剂脱汞性能的影响如图4(b)所示。与不含NO的模拟烟气相比,通入120 mg/m3NO后,光催化剂的脱汞性能略有提高,说明NO对Hg0脱除具有一定促进作用,发生的化学反应[19]如下:

(9)

(10)
2.2 表征分析
2.2.1N2吸附-脱附与XRD分析
3种光催化剂的N2吸附-脱附等温线和XRD图谱如图5所示。
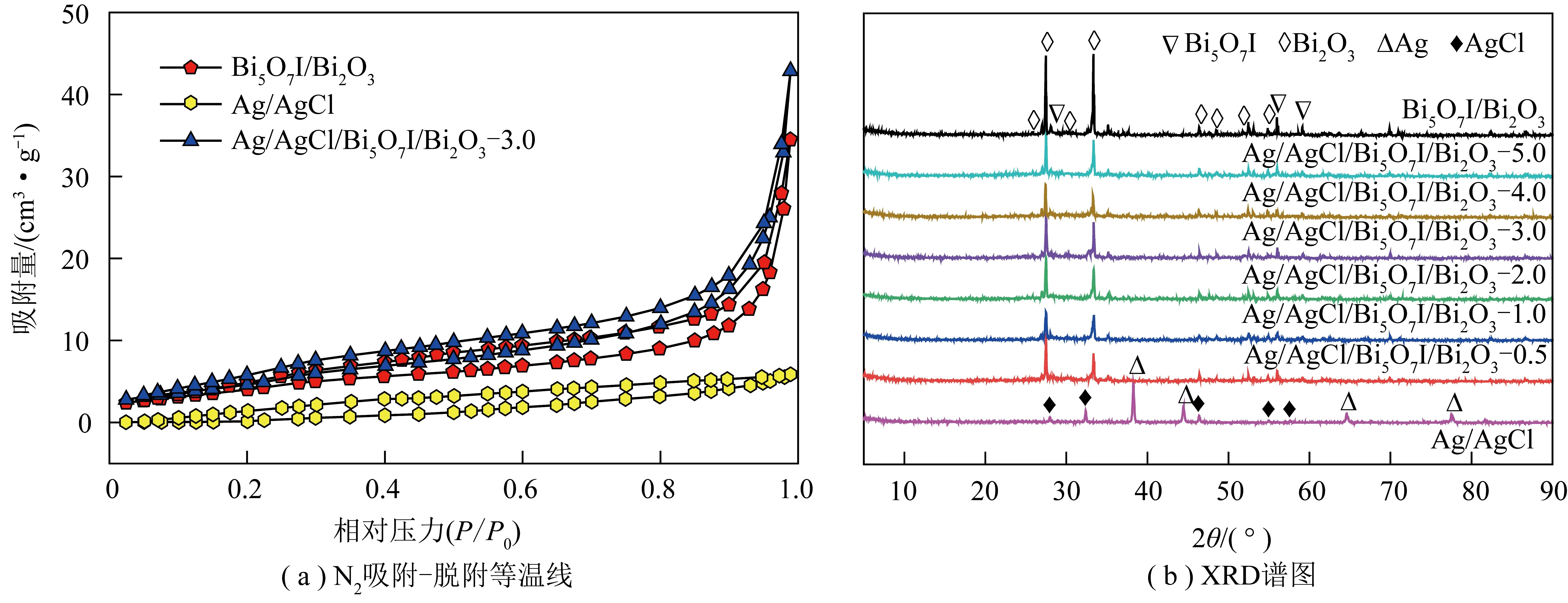
图5 样品的N2吸附-脱附等温线和XRD谱图Fig.5 N2 adsorption-desorption isotherm and XRD spectra of the samples
根据IUPAC分类,Bi5O7I/Bi2O3和Ag/AgCl/Bi5O7I/Bi2O3-3.0均符合IV型等温线且存在H3型滞后环,表明其属于典型的介孔材料(2~50 nm)结构,且存在狭缝形孔隙。另外,添加Ag/AgCl后,四元复合光催化剂的总孔容积有所提升,有利于提高光催化剂的活性位和脱汞效率。
采用XRD手段测试得到了光催化剂的物相组成,结果如图5(b)所示,可知样品Bi5O7I/Bi2O3在2θ=25.7°、27.4°、30.1°、33.3°、46.3°、48.4°、51.8°和54.8°的特征衍射峰与单斜晶相Bi2O3(JCPDS No. 78-1793)吻合[25],而在2θ=28.09°、56.00°和59.10°的特征衍射峰与斜方晶相Bi5O7I(JCPDS No. 40-0548)一致[26]。与Bi5O7I相比,Bi2O3的特征峰强度较强且尖锐,表明光催化剂Bi5O7I/Bi2O3以单斜晶型Bi2O3为主,且结晶度较好。在Ag/AgCl的XRD谱图中,位于27.9°、32.3°、46.4°、54.9°和57.6°的衍射峰均归于AgCl(JCPDS No.31-1238)[27-28],而在2θ=38.2°、44.3°、64.6°和77.5°处显示出的特征峰与单质银Ag0(JCPDS No.04-0783)的(111)、(200)、(220)和(311)晶面对应[29],证明了Ag0出现。Ag0出现是因为在制备光催化剂过程中添加了具有还原作用的EG,使得部分银离子转化为Ag0。在不同比例多元复合物的XRD谱图中,可知属于Bi5O7I和Bi2O3的衍射峰均有不同程度减弱,表明Ag/AgCl成功负载;然而,AgCl和Ag0的衍射峰未被发现,这可能是由于Ag/AgCl含量较少及其在Bi5O7I/Bi2O3表面分布较均匀。
2.2.2SEM与DRS分析
4种样品的扫描电镜图如图6所示,可知Bi2O3呈棒状且表面较为光滑。添加Bi5O7I后,Bi2O3表面附着了较多小颗粒。与Bi5O7I/Bi2O3相比,由于Ag/AgCl的负载,复合光催化剂表面增加了较多的不规则颗粒,表明成功制备了多元复合光催化材料。

图6 样品的SEM图像Fig.6 SEM images of the samples
5种光催化剂的DRS谱图如图7所示。据报道,除紫外区吸收带外,AgCl在波长400~800 nm区域内几乎没有光吸收性能[30],因此,Ag/AgCl在可见光区域较强的吸收性能应为Ag0的SPR效应所致[31]。在360~450 nm,Bi5O7I/Bi2O3表现出较低的吸收能力。经Ag/AgCl负载后,Ag/AgCl/Bi5O7I/Bi2O3光催化剂的光吸收能力均有增强。尤其是当负载量提高至3%和5%时,四元复合光催化剂的光吸收能力大幅提高。

图7 样品的紫外-可见漫反射吸收光谱Fig.7 UV-Vis DRS spectra of the samples
2.2.3XPS分析
为进一步研究光催化剂表面的元素组成和化学状态,使用XPS技术对Bi5O7I/Bi2O3、Ag/AgCl和Ag/AgCl/Bi5O7I/Bi2O3-3.0三种样品进行表征,结果如图8所示。由图8(a)可知,Ag/AgCl/Bi5O7I/Bi2O3-3.0光催化剂主要由Bi、I、O、Ag和Cl组成。
与Ag/AgCl相比,四元复合光催化剂中的Ag和Cl强度较弱,这是由于Ag/AgCl含量较少。Bi5O7I/Bi2O3在164.4和159.1 eV处的2个峰分别对应Bi 4f5/2和Bi 4f7/2的内层轨道电子,说明Bi以Bi3+形式存在[32];负载Ag/AgCl后,Ag/AgCl/Bi5O7I/Bi2O3-3.0的Bi 4f主峰向低结合能处偏移,说明添加Ag/AgCl改变了Bi5O7I/Bi2O3中Bi的化学存在形态,二者之间可能形成了异质结。图8(c)中630.6和619.1 eV处的2个峰分别对应I 3d3/2和I 3d5/2,说明存在I-[33]。图8(d)中Ag/AgCl中结合能为373.4和367.4 eV的峰归属于Ag 3d3/2和Ag 3d5/2[34],Ag/AgCl/Bi5O7I/Bi2O3-3.0中Ag 3d峰的结合能分别为374.3和368.3 eV。与Ag/AgCl相比,该峰向高结合能处偏移了约0.9 eV。Ag/AgCl在198.9和197.3 eV处显示出2个明显的特征峰,分别对应Cl 2p1/2和Cl 2p3/2[35];然而,Ag/AgCl/Bi5O7I/Bi2O3-3.0中的Cl 2p峰较难辨别,其原因为Ag/AgCl的负载量较小且分散较高。对于O 1s光谱,Bi5O7I/Bi2O3在529.9和531.5 eV处出现的2个峰分别归属于Bi—O键的晶格氧和催化剂表面吸收的羟基氧[27,36];而Ag/AgCl/Bi5O7I/Bi2O3-3.0的O 1s光谱则存在3个峰,其中位于533.4 eV的新峰应归属于光催化剂表面的化学吸附态氧,化学吸附态氧含量的大幅增加有利于提高光催化剂性能。
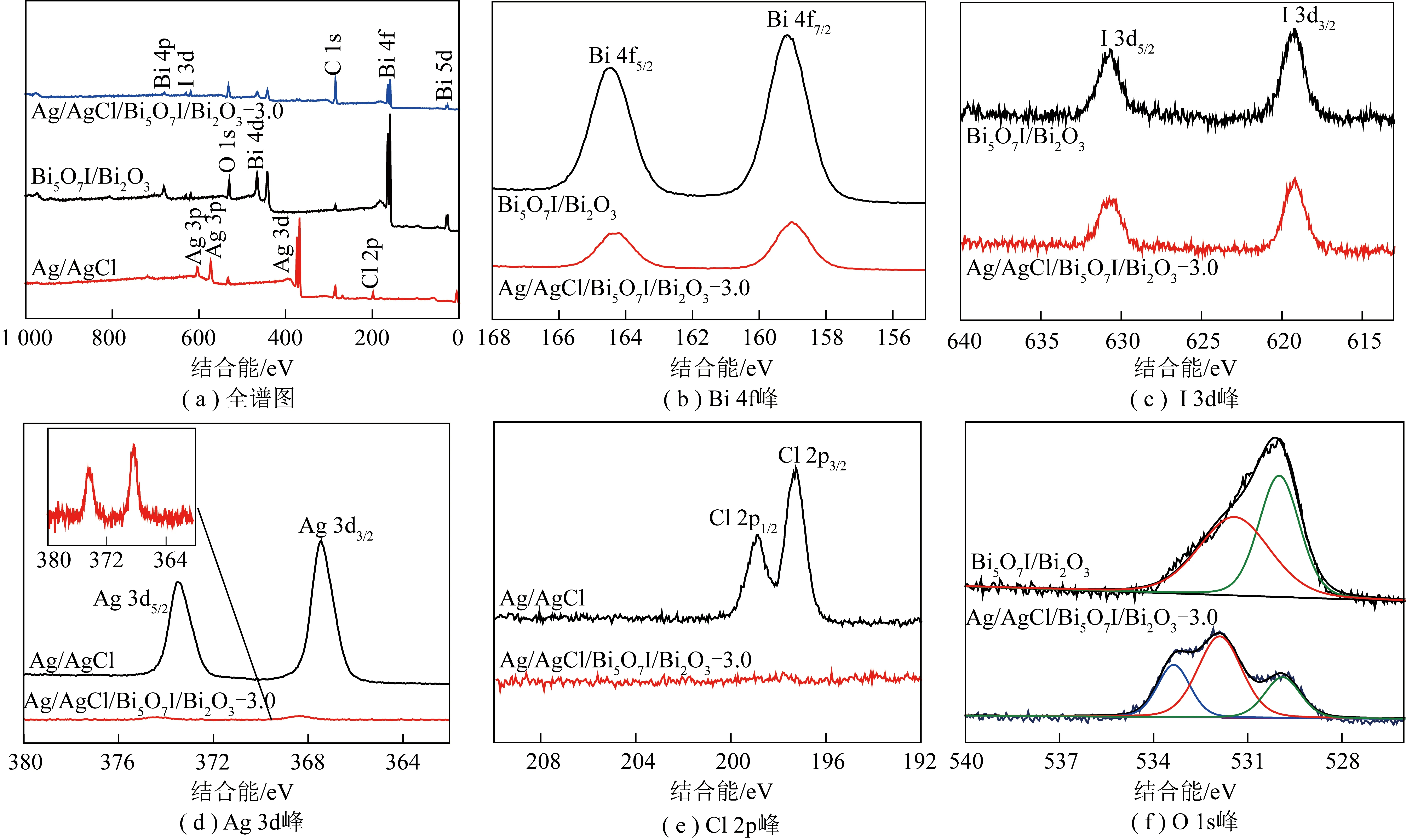
图8 样品的XPS谱图Fig.8 XPS spectra of the samples
2.3 机理分析
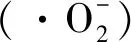
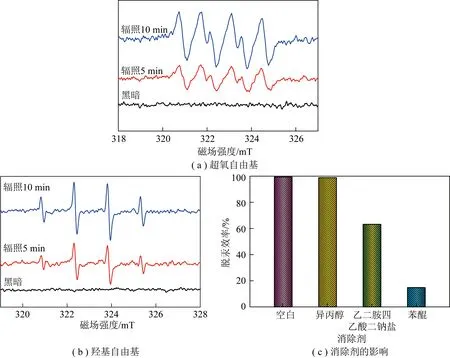
图9 光催化剂的ESR谱图和自由基捕获试验结果Fig.9 ESR spectra and free radicals capture results of the photocatalysts
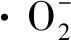
基于上述试验与表征结果,推断Ag/AgCl/Bi5O7I/Bi2O3四元复合光催化材料的高效脱汞机理(图10)。
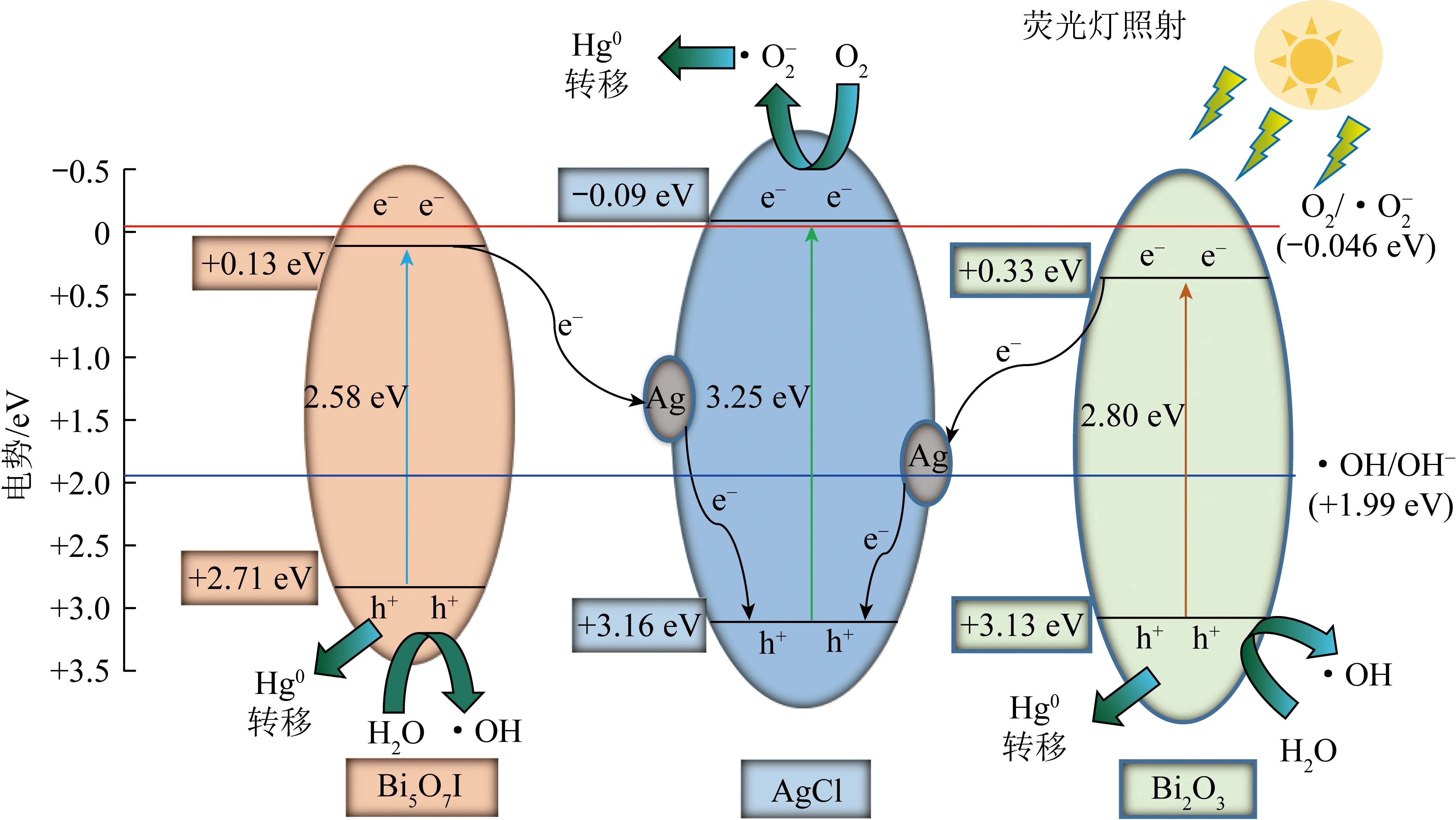
图10 四元光催化剂的电荷转移及可能的脱汞机理Fig.10 Charge transfer of quaternary photocatalyst and its possible mechanism of mercury removal
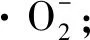
3 结 论
1)在所制得的Ag/AgCl/Bi5O7I/Bi2O3系列光催化剂中,Ag/Bi质量比为0.03时,样品具有最佳的光催化氧化能力,其脱汞效率高达98.5%;与NO相比较,添加少量SO2能大幅降低Hg0脱除性能。
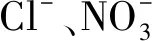
3)由于Ag/AgCl含量较少且在Bi5O7I/Bi2O3表面上高度分散,Ag/AgCl衍射峰未能在Ag/AgCl/Bi5O7I/Bi2O3的XRD图谱中出现。

