汽油PRF 简化化学反应动力学模型的构建研究
刘凯敏,鄂加强,杨靖,马寅杰,杨汉乾,罗武生
(1.湖南大学汽车车身先进设计制造国家重点实验室,湖南长沙 410082;2.中南林业科技大学机电工程学院,湖南长沙 410004)
汽油表征燃料的研究是发动机领域的热门话题,即选取少数几种代表性的成分来表征汽油理化特性和燃烧反应特性.当前,越来越多的试验和数值模拟方法被用来研究汽油燃料的化学反应机理.在进行缸内多维燃烧计算时,由于详细反应机理会占用大量的计算机内存,且计算时间过长,因此,简化反应机理是研究发动机缸内燃烧的重要方法.
汽油表征燃料中包含异辛烷和正庚烷两种主要成分的基础参考燃料(PRF)常用来表征不同辛烷值的汽油.在PRF 氧化机理的研究中,何邦全等人[1]通过温度敏感性分析,构建了一个可以合理描述燃料高温反应过程的PRF 简化化学反应机理,并模拟研究了不同残余废气率下正庚烷和异辛烷的高温反应路径.Ra 和Reitz[2]利用反应速率常数优化的方法对PRF 详细机理进行简化,该机理模拟结果与激波管、HCCI 发动机和缸内直喷发动机的试验数据体现了良好的一致性.Tsurushima[3]构建了一个适用HCCI燃烧的PRF骨架模型,在不同压力、当量比和辛烷值的条件下,该模型对滞燃期的预测效果良好,并且可以较好地预测HCCI 发动机的缸内压力和燃烧放热率.Selim等人[4]详细分析了PRF84(异辛烷的体积百分数为84%,正庚烷的体积百分数为16%)的燃烧化学反应机理路径,详细阐述了造成实验结果和仿真结果存在差异的原因,并给出了提高反应机理准确性的方法.Rezgui[5]利用数值仿真方法,研究了HCCI发动机在1200 r/min 和进气压力为1 bar 的工作条件下,不同氢气添加比对PRF85燃烧特性的影响.
通过汽油PRF 简化模型的回顾不难发现,当前国内外学者提出的汽油PRF 简化动力学机理,很少考虑重要组分演变和层流火焰速度的变化,多数仅通过了滞燃期的验证.然而,对于实际点燃式发动机,层流火焰速度的大小是缸内气体流动、燃烧初始条件和可燃混合气性质综合效应的体现[6],是燃料化学反应机理可靠性的验证指标[7].另外,在燃料燃烧各类基础实验反应器中,关键组分的变化过程与燃油消耗率、燃烧放热率以及发动机最终排放物息息相关.为了获得不仅能够准确描述汽油燃料着火阶段,也可以更加准确地反映火焰前锋面发展、燃料燃烧放热和排放物生成特性的汽油表征燃料简化模型,本文将利用反应路径分析和敏感性分析方法对异辛烷和正庚烷的详细化学反应动力学模型进行简化,根据“半解耦”思想,构建包含41种组分和131个反应的PRF 简化化学反应动力学模型,并通过基础反应器包括激波管(ST)、一维层流火焰速度(LFS)和射流搅拌器(JSR)的实验数据进行验证.
1 汽油PRF简化动力学模型的构建
1.1 仿真工具及机理的选择
本文采用的仿真工具为美国Sandia 国家实验室开发并推出的CHEMKIN PRO 大型气相化学反应动力学程序.异辛烷的详细化学反应动力学模型采用最为著名的LLNL 实验室Curran 等人提出的详细氧化模型[8],涉及857 种组分和3606 个基元反应.该模型包括所有与低温化学反应动力学和高温化学反应动力学有关的化学反应,已经被用在射流搅拌器、流动反应器、激波管和某一摩托车发动机等反应器中研究异辛烷的氧化过程.
在进行异辛烷氧化过程的分析中,由于燃料的氧化燃烧过程受温度、压力及当量比的影响很大,因此需要在多种工况下研究燃料的氧化过程.限于文章篇幅,本文选用Dec 等人[9]使用异辛烷作为燃料的单缸HCCI发动机试验数据进行建模,此发动机的压缩比为18,发动机排量为0.98 L.选用燃空当量比为0.26,发动机转速1200 r/min,初始压力和初始温度为120 kPa 和395 K 的工况条件为例,讨论异辛烷详细机理模型的化学反应动力学过程.
1.2 异辛烷详细化学反应动力学模型的简化
1.2.1 低温反应阶段
在化学反应刚开始的低温区域,燃料的消耗由异辛烷(iC8H18)和氧气直接发生反应开始,并放出部分热量.图1 给出了异辛烷与氧气的化学反应速率.由图可知,异辛烷氧化平均反应速率最大的反应为R3167 和R3169,分别生成同分异构体aC8H17和cC8H17.燃料与氧气的直接反应属于低温反应阶段的一种脱氢反应.
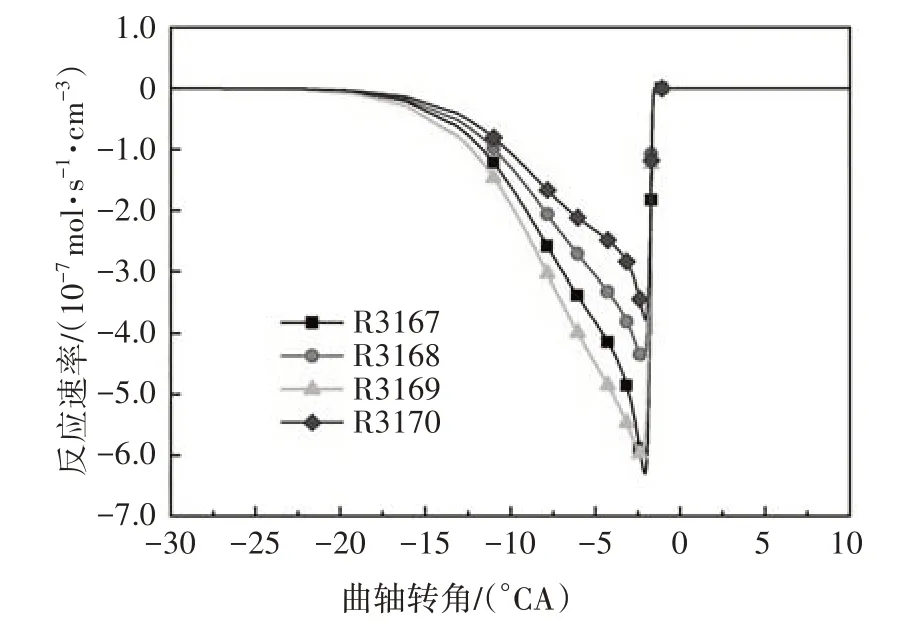
图1 异辛烷氧化反应速率Fig.1 The oxidation reaction rate of iso-octane
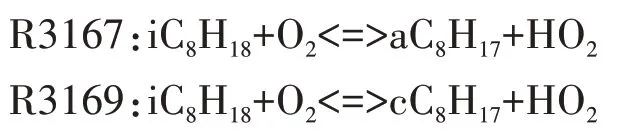
参与脱氢反应的自由基主要包括H、OH、O、CH3、HO2、H2O2、CH3O、C2H5、C2H3等.其中,在低温反应阶段,HO2在所有脱氢自由基中摩尔分数最大(见图2),HO2与异辛烷反应生成辛烷基以及在高温反应中起重要作用的H2O2.图3给出了异辛烷与HO2的反应速率,有较大反应速率的两个脱氢反应依次为R3159、R3161.随着反应的进行,自由基OH 也大量生成且远远多于其他脱氢自由基.

图2 异辛烷脱氢自由基摩尔分数Fig.2 The dehydrogenation free radicals of iso-octane
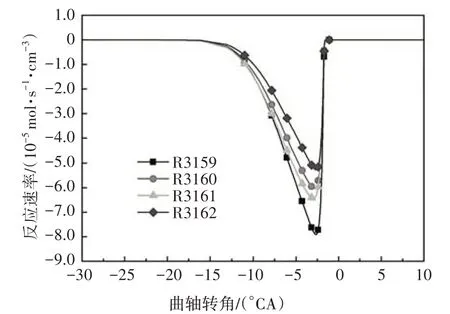
图3 异辛烷与HO2脱氢反应速率Fig.3 The dehydrogenation rate of iso-octane with HO2
图4 给出了异辛烷与OH 自由基脱氢反应的温度敏感性分析.本文中燃料(异辛烷或正庚烷)氧化反应的分析在HCCI发动机模型中进行,反应的敏感性系数为负,代表该反应的发生有利于燃料的氧化分解,反应显示较高的负敏感性系数,则意味着加大该反应速率能大大提高系统的反应活性;反之反应的敏感性系数为正,代表该反应对燃料的氧化分解起抑制作用.由图4可知,R3151在四个异辛烷与OH脱氢反应中敏感性系数最大,并生成aC8H17,这说明aC8H17是最重要的脱氢产物,这与图5 中异辛烷与OH的反应路径分析结果一致.为了尽可能的减少基元反应数目,本文选用aC8H17作为唯一的脱氢产物,对应的脱氢反应为:
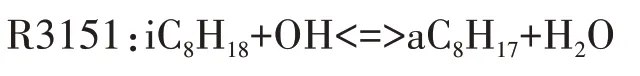

图4 异辛烷与OH脱氢反应的温度敏感性分析Fig.4 The temperature sensitivity analysis of dehydrogenation reaction of iso-octane with OH
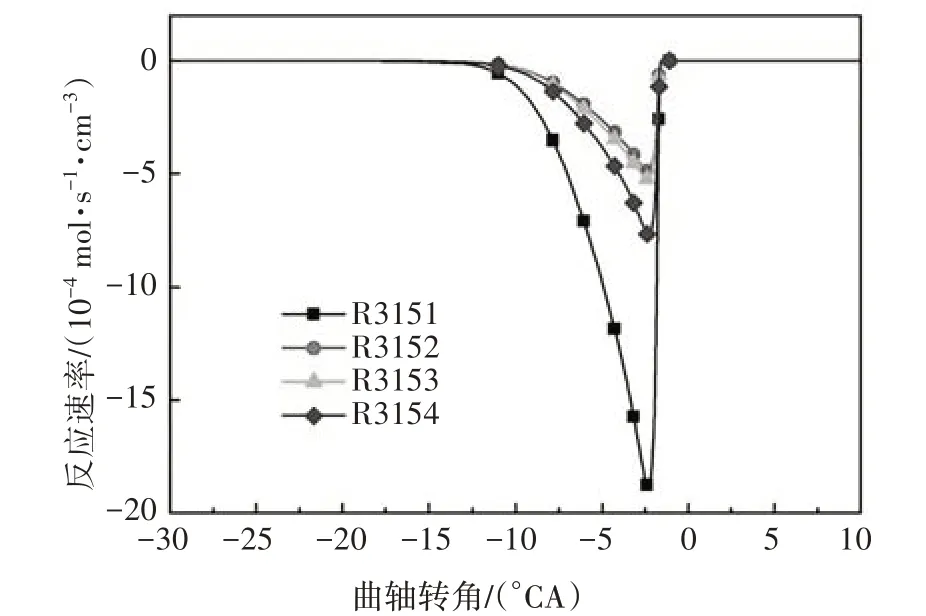
图5 异辛烷与OH脱氢反应速率Fig.5 The dehydrogenation rate of iso-octane with OH
选定aC8H17作为唯一的脱氢产物后,其对应的第一次加氧反应为R3216,生成aC8H17O2.随后第一次加氧产物生成4 种C8H16OOH 同分异构化产物,图6 给出了aC8H17O2同分异构化反应的温度敏感性分析.其中,R3266 和R3267 对aC8H17O2的同分异构化影响最大,分别生成aC8H16OOH-a、aC8H16OOH-b,有助于燃料的低温氧化.然而,aC8H17O2生成aC8H16OOH-c、aC8H16OOH-d 的同分异构化反应敏感性系数很小,且R3268 对燃料氧化起抑制作用.因此,选择敏感性系数最大的R3266 作为aC8H17O2的同分异构化反应.

图6 第一次加氧产物C8H17O2发生同分异构化的温度敏感性分析Fig.6 The temperature sensitivity analysis of the isomerization reaction of the first oxygenated product C8H17O2
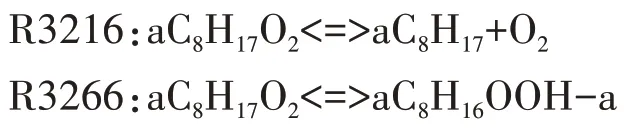
中间产物aC8H16OOH-a 确定后,对应的第二次加氧反应为R3298.第二次加氧产物经历两次分解反应,释放出OH 自由基,这是低温反应阶段OH 自由基的主要来源.第二次加氧反应及其对应的两次分解反应分别为:
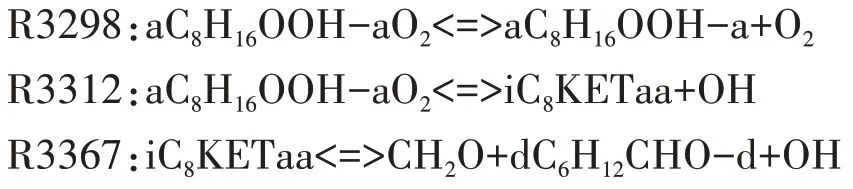
1.2.2 负温度系数区
随着温度的升高,C8H16OOH 各同分异构体进行第二次加氧反应逐渐减弱,系统的整体反应速率下降,化学反应链转向C8H16OOH 的分解反应.通过分析C8H16OOH 各同分异构体的分解反应路径,理论上C8H16OOH分解生成烯烃和HO2的反应路径对系统的整体反应速率抑制作用最大,但是异辛烷氧化详细反应机理中,没有给出C8H16OOH 的同分异构体aC8H16OOH-a 分解生成烯烃和HO2的反应.因此,本文选择aC8H16OOH-a 分解生成小分子烯烃、醛和OH的反应R3378,表现负温度系数区的主要反应特征.

1.2.3 高温反应阶段
在高温反应阶段,第一次加氧反应C8H17O2<=>C8H17+O2的平衡状态变得越来越重要,平衡状态从形成第一次加氧产物C8H17O2的方向,向C8H17O2分解为C8H17和O2的方向转移,高温反应链进一步转向辛烷基C8H17的分解.对于选定的唯一脱氢产物aC8H17,详细反应机理中包含R3179、R3180 两个裂解反应和R3365、R3366 两个同分异构化反应.由于高温条件下辛烷基裂解成小分子烷烃基和烯烃基所需的活化能比裂解成大分子烃基少,小分子组分生成量比大分子组分多,因此,选择R3180 作为辛烷基的分解反应.

图7 给出了H2O2主要反应路径.由图可见,H2O2的主要生成反应按反应速率由大到小排列依次为R50、R54,其中R50 中H2O2由两个HO2分子结合生成,HO2自由基主要来源于以下两方面:其一,在负温度系数阶段,C8H16OOH 各同分异构体发生分解反应,生成大量HO2;其二,在高温反应阶段,R46 对HO2自由基的生成起主导作用,如图9 所示的HCO自由基主要反应路径可见,在高温反应的第一阶段,HCO 自由基的主要消耗反应为R46,HCO 被氧化生成大量的HO2和CO,HO2在此阶段非常活跃并通过R50、R54 等反应被逐渐消耗生成H2O2.对H2O2的主要消耗反应依次为R51、R537.
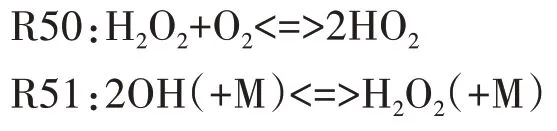

图7 H2O2主要反应路径Fig.7 The main reaction path of H2O2
如图2 所示,对燃料分子氧化最为重要的自由基OH在高温反应阶段大量生成,各组分间化学反应加剧,使燃烧放热率增大,缸内燃烧温度也急剧上升至最大值.图8 给出了OH 自由基主要反应路径.在高温反应第一阶段,R51 具有最高的羟基生成速率,该反应所需活化能较高,在缸内温度升高至1060 K时才能发生,为吸热反应;羟基最重要的消耗反应为R32.在高温反应的第二阶段,生成OH 自由基主要的基元反应依次为R10、R8,此类反应所需的活化能更高,通常需要缸内温度上升至1200 K时才会进行;此阶段OH自由基主要的消耗反应依次为R7、R49.
图8 OH自由基主要反应路径Fig.8 The main reaction path of OH free radical
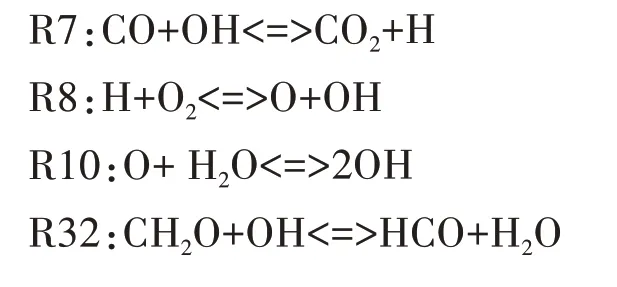
图9 给出了HCO 自由基的主要反应路径.由图可知,HCO 主要通过CH2O 与OH 的反应R32 生成,其主要的消耗反应依次为R46、R12.R46 中HCO 通过进行氧化反应生成CO,R12 中HCO 通过吸热分解为H 和CO.


图9 HCO自由基主要反应路径Fig.9 The main reaction path of HCO free radical
异辛烷氧化的高温反应开始后,CH2O 的摩尔分数逐渐达到最大值,在高温反应第一阶段结束时减小至零,随后CO 的摩尔分数也快速上升达到峰值.随着燃料被完全氧化,CO 逐渐转化为CO2,此过程伴随着大量的光和热,所以高温反应第二阶段通常被称作热焰反应阶段.由图10 所示的CO 主要反应路径可知,CO 通过反应R7 生成CO2的反应速率最大,因此羟基是降低CO含量的关键自由基.

图10 CO主要反应路径Fig.10 The main reaction path of CO
通过上述对异辛烷燃料在低温反应阶段、负温度系数区和高温反应阶段的基本反应链以及所涉及的中间产物反应路径分析,本文绘制了异辛烷简化机理的主要反应路径,如图11 所示.值得注意的是,限于文章篇幅,本文没有详细列出其余主要中间产物的反应路径简化过程.比如,在低温反应阶段,R3367 中iC8KETaa 分解生成CH2O、dC6H12CHO-d 和OH,其中dC6H12CHO-d 是重要的中间产物,找出dC6H12CHO-d 反应路径上逐步生成小分子组分的关键反应显得尤为重要.dC6H12CHO-d 主要通过反应R3433 消耗生成iC3H5CHO 和iC3H7,而iC3H5CHO 的主要消耗反应为R1510,生成iC3H5CO 和H2O.在高温反应阶段,选择R3180:aC8H17<=>iC4H8+iC4H9作为辛烷基的分解反应.对于iC4H9,其主要生成反应为R3180,并通过反应R262 消耗生成C3H6和CH3.对于另一个分解产物iC4H8,其主要消耗路径为R213,在此反应中iC4H8与OH 自由基发生脱氢反应生成iC4H7.因此,异辛烷简化机理中主要中间产物的反应路径可根据图11,并结合本文选用的反应路径分析和敏感性分析方法分析得出.

图11 异辛烷简化机理的主要反应路径Fig.11 The main reaction path of iso-octane reduced mechanism
1.3 正庚烷详细化学反应动力学模型的简化
对正庚烷的详细氧化机理研究,最为著名的仍是LLNL 实验室的Curran 等人提出的正庚烷详细氧化模型[10],该机理给出了正确的燃烧氧化速率和化学反应路径,预测结果已经被大量实验结果验证.Tsurushima[3]曾指出异辛烷与正庚烷具有相似的燃烧氧化过程,本文在对异辛烷详细氧化机理进行分析和简化的基础上,同样分析了正庚烷燃烧氧化的主要反应路径和重要中间产物,并得出了与Tsuru⁃shima 等人相同的结论.由于研究分析方法与1.2 节相同,为了节省文章篇幅,本文没有详细列出正庚烷氧化的研究过程.
1.4 PRF简化化学反应动力学模型的构建
通过对比多种化学反应动力学简化机理构建方法发现,Liu 等人[11]提出的“半解耦”思想,能够对关键组分及层流火焰速度的演变过程作出良好的预测,该方法具体描述为:将详细和普适的H2/CO/C1~Cn小分子机理(n取1、2 或者3)作为整个机理的“内核”,以准确计算燃料在高温阶段的火焰传播特性及化学反应过程;将燃料低温阶段的化学反应进行简化后,与“内核”机理进行耦合,以模拟燃料的着火特性.在构建包含多组分燃料的骨架模型时,可以以可靠的“内核”机理作为基础,通过简化不同组分燃料的低温反应机理并调整其化学反应常数,从而对滞燃期、层流火焰速度和关键组分的变化等特性参数进行准确预测.
本文构建的PRF 化学反应动力学简化模型,涉及异辛烷和正庚烷两种燃料组分.根据“半解耦”思想,本文选用Liu模型[11]中C0~C1的小分子机理作为PRF 燃料的“内核”,选择“内核”机理后,C0~C1 的小分子机理无需修改,只需要在“内核”机理基础上,构建并添加PRF 燃料两种成分的低温反应和大分子向小分子的过渡反应.选用Patel 等人[12]的C2~C3 的子机理作为过渡机理,这是由于该机理已经被证实具有很好的实用性和可靠性,且机理规模很小,仅包含C2H3、C2H4、C3H4、C3H5、C3H6和C3H7六种组分.结合本文对异辛烷和正庚烷的低温反应及大分子向小分子的过渡反应的简化,最终构建了包含41 种组分和131个反应的PRF简化化学反应动力学模型.
2 汽油PRF简化动力学模型的验证
2.1 激波管的验证
在验证本文所构建PRF 简化动力学模型的准确性时,使用在激波管中计算的滞燃期与Fieweger 等人[13]和Ciezki 等人[14]的实验数据进行对比.限于文章篇幅,本节仅列出某一组分或组分间混合物的对比结果,如无特殊说明,各组分比例是指液体体积分数.在PRF 基础燃料中,若异辛烷的体积百分数为80%,正庚烷的体积百分数为20%,则该燃料简写为PRF80.为了方便表述,本文图例中使用Exp和Cal分别表示文献中的实验值和本文所构建的简化动力学模型的计算值.
图12~图14 分别给出了本文构建的PRF 简化动力学模型中异辛烷、正庚烷及其两种组分的混合物在不同边界条件以及混合浓度下的滞燃期预测值与试验值的对比.由图可知,新构建的PRF简化动力学模型的滞燃期计算值与试验结果体现了很好的一致性,能够很好地预测燃料氧化的负温度系数行为,计算值稍微偏离试验值的主要原因是由于内核机理中涉及H、H2、CH3和CH4反应的简化所致[3].

图12 异辛烷在激波管中滞燃期的计算值与实验值[13]的对比Fig.12 The ignition delay comparison between calculated value and experimental data of iso-octane in ST
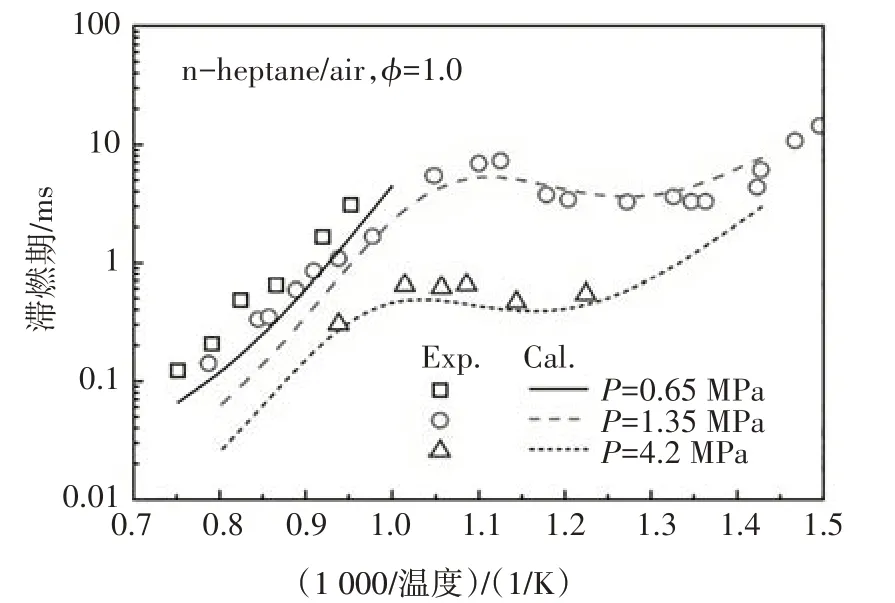
图13 正庚烷在激波管中滞燃期的计算值与实验值[14]的对比Fig.13 The ignition delay comparison between calculated value and experimental data of n-heptane in ST

图14 PRF燃料在激波管中滞燃期的计算值与实验值[13]的对比Fig.14 The ignition delay comparison between calculated value and experimental data of PRF in ST
2.2 一维层流火焰速度的验证
图15 给出了本文构建的PRF 简化动力学模型中正庚烷或异辛烷燃料在空气中燃烧的层流火焰速度与试验数据及其相关模型的对比,实验在初始温度298 K、压力0.1 MPa 条件下开展.可以看出,利用本文构建的PRF简化动力学机理计算的层流火焰速度与试验数据吻合良好,尽管图15b 中异辛烷的层流火焰速度计算值仍然偏高,但相比其它模型计算值已经有了很大改善.

图15 层流火焰速度计算值与实验值对比Fig.15 The LFS comparison between simulation results and experimental values
2.3 射流搅拌器的验证
图16 给出了本文构建PRF 机理中的正庚烷或异辛烷在射流搅拌器中摩尔质量分数的计算值与Dagaut 等人[18]实验值对比.试验在当量比为1.0、温度范围550~1150 K、压力为1.0 MPa 条件下进行,并采用氮气对燃料稀释.由图可知,在机理规模的大大简化的情况下,虽然CO 计算值与试验值略有不同,但在不同当量比下,本文构建的PRF 简化化学反应动力学机理中的正庚烷或异辛烷模型仍能比较准确的拟合试验结果,并反映组分的变化趋势.同时,燃料分子摩尔分数在NTC区域的变化趋势也与试验值比较接近.除当量比1.0 以外,Dagaut 等人[18]的试验值也涉及当量比分别为0.5 和1.5、温度范围550~1150 K、压力为1.0 MPa 的实验条件,利用本文构建的PRF 简化机理对重要组分摩尔质量分数的预测,与这两种当量比条件下的实验值同样体现了较好的一致性,限于文章篇幅,本文没有给出相应图例.

图16 射流搅拌器中摩尔质量分数计算值与实验值的对比Fig.16 The species mole fraction comparison between simulation results and experimental values in JSR
3 结论
1)根据“半解耦”思想,本文选用Liu 模型[11]中C0~C1 的小分子机理作为PRF 燃料的“内核”,选用Patel 等人[12]的C2~C3 的子机理作为过渡机理,利用反应路径分析和敏感性分析方法对异辛烷、正庚烷的大分子反应进行简化,并组合构建了包含41 种组分和131个反应的PRF简化化学反应动力学模型.
2)结合本文构建的PRF 简化化学反应动力学模型,选择不同液体体积分数组分燃料作为实际汽油的表征,并与实验结果进行对比,结果表明:本文构建的PRF 简化化学反应动力学模型很好地通过了激波管、一维层流火焰速度和射流搅拌器的实验数据验证,不仅可以准确预测燃料的滞燃期,而且可以比较准确地预测反应中重要中间组分、自由基浓度和层流火焰速度的发展趋势.

