Lnc-AK077216基于OPG/RANKL/RANK通路对破骨细胞分化成熟的调控作用
李坤,喻锋,余国庆,陈志龙,王晶
(鄂州市中心医院 骨科,湖北 鄂州 436000)
人体中骨代谢的稳定性由骨重建维持,包括成骨细胞(Osteoblast,OB)介导的骨形成、破骨细胞(Osteoclast,OC)介导的骨吸收[1]。当骨重建平衡被打破,骨量将异常减少或增加,导致骨质疏松、骨关节炎、佩吉特病等骨破坏性疾病,其中骨质疏松发病率居首位,严重降低患者生活质量[2]。目前骨质疏松治疗以基础药物、抗吸收药物、骨生成药物为主,但前两类药物无诱导骨生成能力,且安全性有待提升,骨生成药物可刺激骨生成,但容易导致内分泌紊乱。故进一步探讨新型治疗方式以改善骨质疏松疗效具有必要性。OC是机体中唯一具有骨吸收作用的细胞,目前调节OC活性被认为是治疗骨质疏松较为直接、有效的方式。长链非编码RNA(long noncoding RNA,LncRNA)是新发现的一类非编码RNA分子,几乎参与mRNA转录、拼接、降解、翻译等全部过程,已有国内外研究证实其异常表达与OC活性关系密切[3-5]。但目前鲜有关于Lnc-AK077216对OC分化成熟的调控作用及具体机制的研究。鉴于此,本研究通过建立敲低Lnc-AK077216的RAW264.7细胞模型,探讨Lnc-AK077216对OC分化成熟的调控作用,并探讨相关调控机制,为骨质疏松治疗提供依据。
1 材料与方法
1.1 细胞、主要试剂及仪器
RAW264.7小鼠单核巨噬细胞(中国科学院细胞库)。MEMα培养基(上海康朗生物科技有限公司),胎牛血清、DMEM培养基(美国Thermo Fisher Scientific公司),磷酸盐缓冲液(PBS)[西格玛奥德里奇(上海)贸易有限公司],Trizol试剂盒(北京柏莱斯特科技发展有限公司),RT-Kit逆转录试剂盒[宝生物工程(大连)有限公司],QIAGEN208054荧光定量试剂盒[天根生化科技(北京)有限公司],抗酒石酸酸性磷酸酶(tartrate resistant acid phosphatase,TRAP)染色试剂盒(美国Sigma公司),Bradford蛋白定量试剂盒(美国Thermo Fisher Scientific公司),ECL化学发光检测试剂盒(北京庄盟国际生物基因科技有限公司),6XD-3光学显微镜(上海光学仪器一厂),BX61型荧光显微镜(日本Olympus株式会社),实时荧光定量聚合酶链反应(qRT-PCR)仪、ChemiDoc XRS化学发光成像系统(美国Bio-Rad公司)。
1.2 方法
1.2.1 细胞培养、转染RAW264.7细胞培养于MEMα培养基(含10%胎牛血清、1%双抗),于37℃、5%二氧化碳培养箱中传代培养。取对数生长期细胞经胰蛋白酶消化,以8×104个/mL接种于24孔板,置于培养箱中继续培养。观察细胞生长状态,当融合度达到50%左右时,吸弃上层培养液,PBS洗涤2次。按照脂质体转染法操作说明书进行转染,转染Lnc-AK077216-shRNA、ControlshRNA的细胞分别设为转染组和空载组。每孔板加入2 mL高糖DMEM培养液(含20%胎牛血清,不含抗生素),继续培养48 h,荧光显微镜下观察感染率。未经处理的RAW264.7细胞设为对照组。每组设置5个复孔。
1.2.2 转染后Lnc-AK077216 mRNA相对表达量检测采用qRT-PCR法检测空载组和转染组的Lnc-AK077216 mRNA相对表达量。收集转染48 h后的RAW264.7细胞,Trizol试剂盒提取细胞总RNA,取2μg样本逆转录获取cDNA。采用琼脂糖凝胶电泳法对产物进行鉴定,实施qRT-PCR。按照QIAGEN208054荧光定量试剂盒说明书设置反应体系:2×SYBR Green Master Mix 10.5μL,正反向引物各0.7μL(10μmol/L),cDNA 1μL,dd H2O 7.6μL。反应条件:95℃预变性5 min;95℃变性25 s,60℃退火20 s,72℃延伸60 s,重复40个循环。Lnc-AK077216正向引物:5'-TGACAGTGCGCATGAGTGC CACGT-3',反向引物:5'-TGTGGACGTGACGCACG TCTATGC-3';β-actin正向引物:5'-CCAGATGCCG TGACGGCACAAGTC-3',反向引物:5'-TGAACTCG TACCATACCGTGCGCA-3'。以β-actin为内参基因,采用2-ΔΔCt法计算目的基因相对表达量。所有实验重复3次求Ct均值。
1.2.3 TRAP染色取对数生长期RAW 264.7细胞以1.5×104个/孔接种于96孔板,待细胞铺满底部时采用DMEM高糖培养基(含100 ng/mL RANKL)进行诱导分化,隔天换液,7 d后行TRAP染色。移除孔中培养液,用PBS洗3次后吸除干净;室温下用4%多聚甲醛固定液固定20 min,用PBS洗3次后吸除干净;加入配置好的TRAP染色液,置于37℃孵箱中孵育40 min;弃去培养液,加入PBS 100μL/孔,显微镜下观察染色情况并计数,以≥3个细胞核,且TRAP染色阳性为OC鉴定标准;使用IPP软件统计视野下TRAP阳性染色面积,每孔随机选取3个视野求均值。
1.2.4 各组细胞骨保护蛋白(OPG)/细胞核因子κB受体活化因子配体(RANKL)/细胞核因子κB受体活化因子(RANK)mRNA相对表达量检测收集各组诱导分化培养3 d的细胞,提取、鉴定总RNA方式及qRT-PCR法同1.2.2。OPG正向引物:5'-TTGTACGTT GCACGCCAGTGCACG-3',反 向 引 物 :5'-TACAACCAACTGCCACGTTGCACG-3';RANKL正 向引物:5'-ACCGTGTCACGTTGCACTGCACGT-3',反向引 物:5'-GTGACTCCAGTGCCGTGCATGCCA-3';RANK正向引物:5'-CTGACGTGCACGTGCCACGTGG CA-3',反向引物:5'-ATTGGAAACGGCACTTGAACTG CA-3';β-actin正向引物:5'-TGACTGGCAGTCAGCA TGCGTGGC-3’,反向引物:5'-TGTACGTGCACGTGC CACGGCCAC-3'。以β-actin为内参基因,采用2-ΔΔCt法计算目的基因相对表达量。所有实验重复3次求Ct均值。
1.2.5 各组细胞OPG、RANKL、RANK蛋白相对表达量检测采用Western blotting检测各组细胞OPG、RANKL、RANK蛋白相对表达量。取各组诱导分化培养3 d的RAW264.7细胞,冰上操作,经预冷PBS洗涤2次,弃去PBS。加入蛋白裂解液,置于离心管,冰上裂解30 min,4℃13 000 r/min离心15 min(离心半径为8 cm),取上清液,使用Bradford蛋白定量试剂盒进行检测。取50μg样品加入5×SDSPAGE上样缓冲液,沸水浴5 min。冰上冷却后以恒定电压进行聚偏二氟乙烯膜转膜,转膜后加入50 g/L脱脂奶粉,室温摇床孵育2 h。将封闭好的聚偏二氟乙烯膜置入杂交袋,加入一抗(1∶1 000)室温孵育过夜,TBTS漂洗15 min×3次。再次将聚偏二氟乙烯膜置入杂交袋,加入二抗(1∶8 000)室温孵育1 h后TBTS漂洗10 min×3次。将ECL A、B液等量混合,放入聚偏二氟乙烯膜,孵育10 s,吸除膜上发光液,采用ECL化学发光成像系统对目的条带进行检测,以OPG、RANKL、RANK蛋白灰度值/内参β-actin灰度值表示蛋白相对表达量。
1.3 统计学方法
数据分析采用SPSS 24.0统计软件,计量资料以均数±标准差(±s)表示,比较用方差分析,进一步两两比较采用SNK-q检验。P<0.05为差异有统计学意义。
2 结果
2.1 RAW264.7细胞转染率
转染48 h后,荧光显微镜下观察同一视野里RAW264.7细胞转染情况,转染率>70%。见图1。
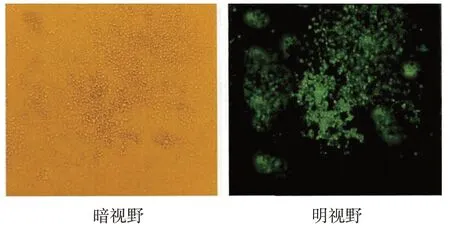
图1 荧光显微镜下观察RAW264.7细胞转染率(×100)
2.2 转染后细胞Lnc-AK077216 mRNA相对表达量下降
转染48 h后对照组、空载组、转染组细胞Lnc-AK077216 mRNA相对表达量分别为(0.74±0.08)、(0.71±0.09)、(0.47±0.05),经方差分析,差异有统计学意义(F=19.324,P=0.000),转染组Lnc-AK077216 mRNA相对表达量均低于对照组和空载组(P<0.05);对照组与空载组比较,差异无统计学意义(P>0.05)。见图2。
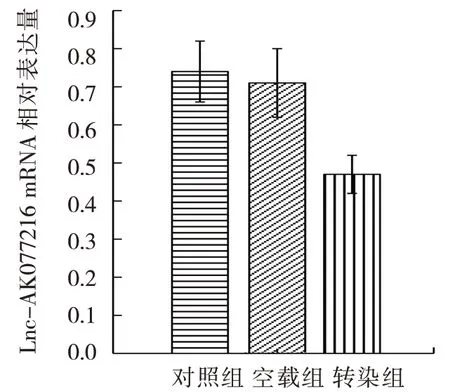
图2 转染后各组Lnc-AK077216 mRNA相对表达量(±s)
2.3 诱导分化RAW 264.7细胞后的形态学变化
诱导分化前RAW264.7细胞多呈圆形且形态规则,诱导分化7 d后经TRAP染色,可观察到呈阳性的多核巨细胞,细胞有伪足、突起,且体积较大,表明生成OC。见图3。
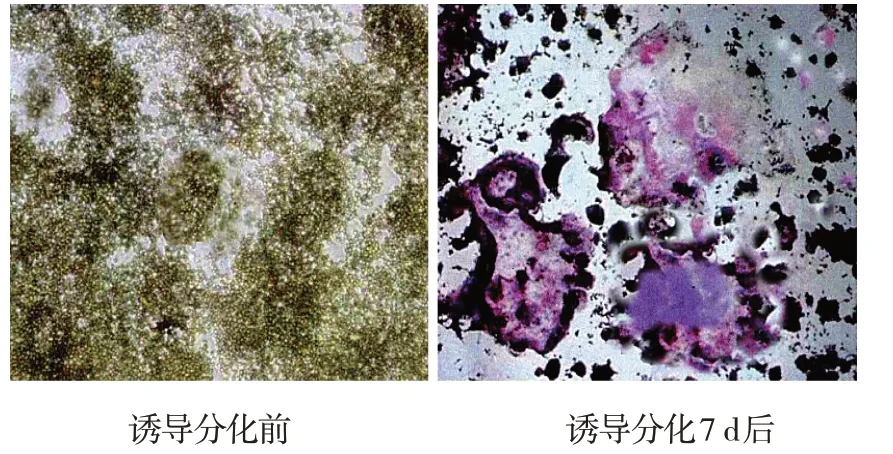
图3 RAW 264.7细胞诱导分化前、诱导分化7 d后TRAP染色结果(×100)
2.4 各组OC数、阳性染色面积比较
各组OC数、阳性染色面积比较,经方差分析,差异有统计学意义(P<0.05),转染组OC数少于对照组和空载组(P<0.05),阳性染色面积小于对照组和空载组(P<0.05);对照组与空载组OC数、阳性染色面积比较,差异无统计学意义(P>0.05)。见表1和图4。
表1 各组OC数、阳性染色面积比较(±s)
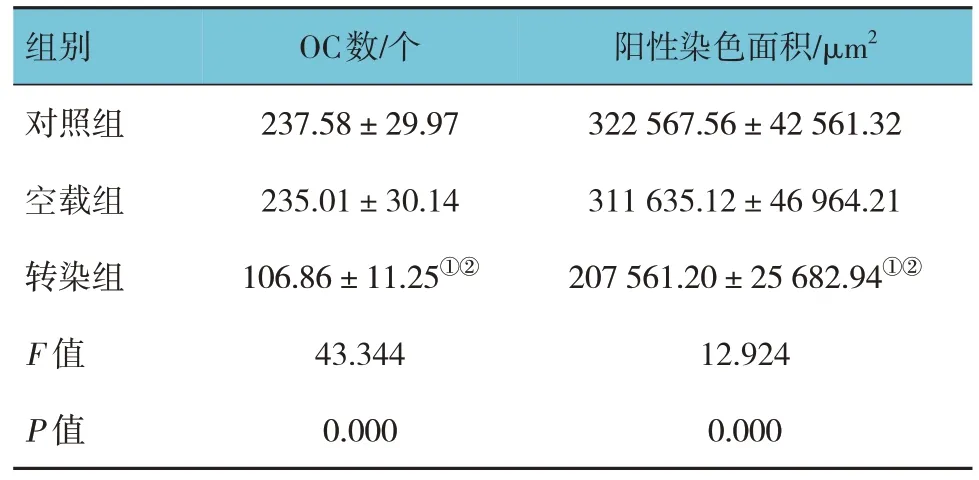
表1 各组OC数、阳性染色面积比较(±s)
注:①与对照组比较,P<0.05;②与空载组比较,P<0.05。
组别对照组空载组转染组F值P值OC数/个237.58±29.97 235.01±30.14 106.86±11.25①②43.344 0.000阳性染色面积/μm2 322 567.56±42 561.32 311 635.12±46 964.21 207 561.20±25 682.94①②12.924 0.000
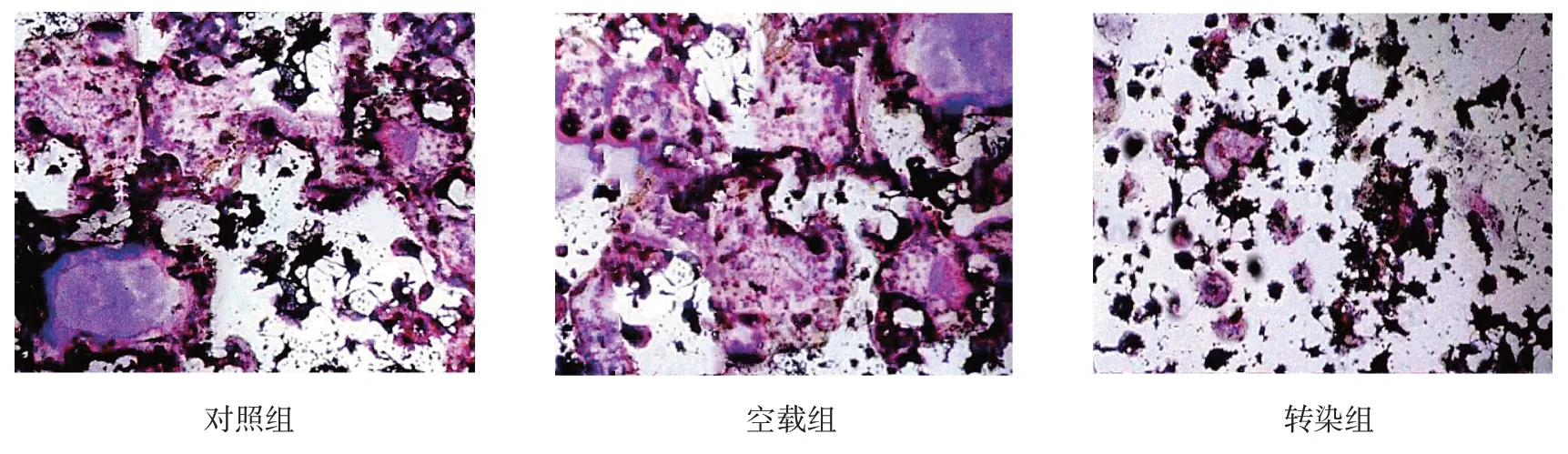
图4 各组细胞TRAP染色结果(×100)
2.5 各组细胞OPG、RANKL、RANK mRNA相对表达量比较
各组细胞OPG、RANKL、RANK mRNA相对表达量比较,经方差分析,差异有统计学意义(P<0.05),转染组OPG mRNA相对表达量高于对照组和空载组(P<0.05),RANKL、RANK mRNA相对表达量低于对照组和空载组(P<0.05);对照组和空载组OPG、RANKL、RANK mRNA相对表达量比较,差异无统计学意义(P>0.05)。见表2。
表2 各组细胞OPG、RANKL、RANK mRNA相对表达量比较(±s)
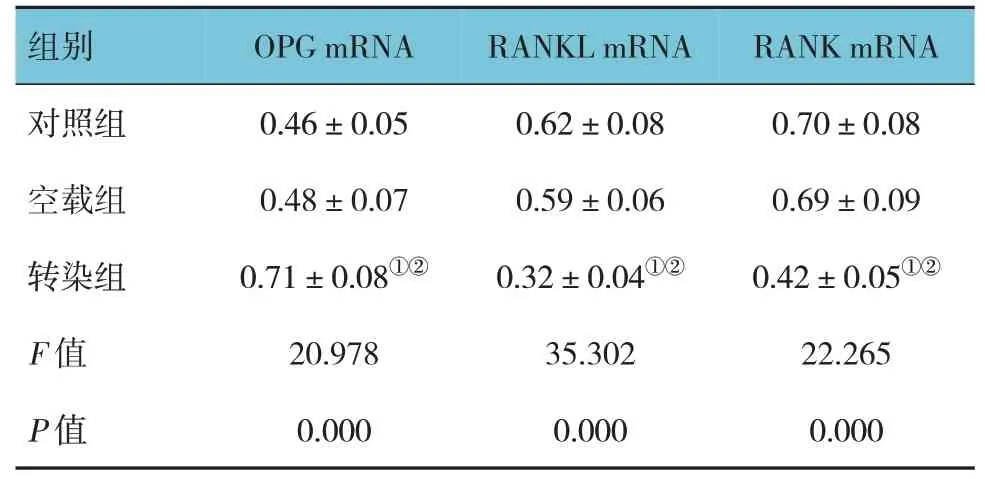
表2 各组细胞OPG、RANKL、RANK mRNA相对表达量比较(±s)
注:①与对照组比较,P<0.05;②与空载组比较,P<0.05。
组别对照组空载组转染组F值P值OPG mRNA 0.46±0.05 0.48±0.07 0.71±0.08①②20.978 0.000 RANKL mRNA 0.62±0.08 0.59±0.06 0.32±0.04①②35.302 0.000 RANK mRNA 0.70±0.08 0.69±0.09 0.42±0.05①②22.265 0.000
2.6 各组细胞OPG、RANKL、RANK蛋白相对表达量比较
各组细胞OPG、RANKL、RANK蛋白相对表达量比较,经方差分析,差异有统计学意义(P<0.05),转染组OPG蛋白相对表达量高于对照组和空载组(P<0.05),RANKL、RANK蛋白相对表达量低于对照组和空载组(P<0.05);对照组和空载组OPG、RANKL、RANK蛋白相对表达量比较,差异无统计学意义(P>0.05)。见表3和图5。
表3 各组细胞OPG、RANKL、RANK蛋白相对表达量比较(±s)
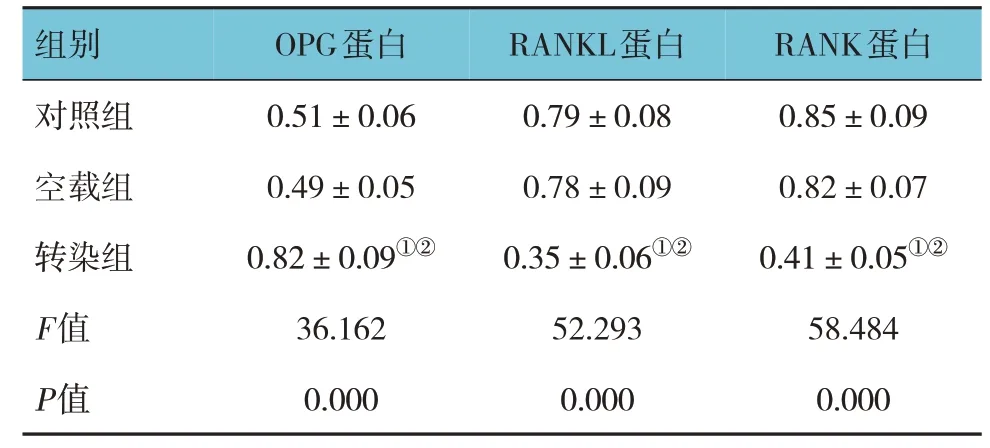
表3 各组细胞OPG、RANKL、RANK蛋白相对表达量比较(±s)
注:①与对照组比较,P<0.05;②与空载组比较,P<0.05。
组别对照组空载组转染组F值P值OPG蛋白0.51±0.06 0.49±0.05 0.82±0.09①②36.162 0.000 RANKL蛋白0.79±0.08 0.78±0.09 0.35±0.06①②52.293 0.000 RANK蛋白0.85±0.09 0.82±0.07 0.41±0.05①②58.484 0.000
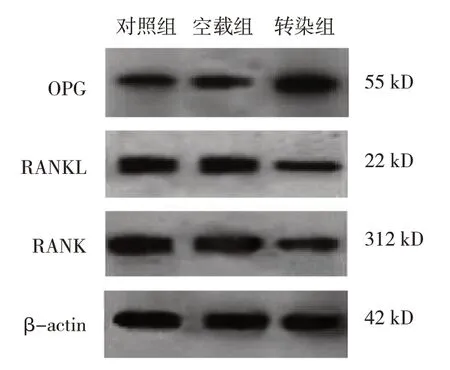
图5 各组细胞OPG/RANKL/RANK通路蛋白表达
3 讨论
骨质疏松好发于老年群体,研究认为高龄、内分泌异常、肥胖、偏食、缺乏运动、遗传等均为其发生的危险因素[6-7]。骨质疏松的直接病因是OC过度激活或破骨前体细胞向OC过度分化,导致骨吸收过程加速,并以骨组织显微结构变化、骨量降低等为主要病理改变[8]。OC经过细胞成熟和极化,骨吸收面细胞中生成肌动蛋白环,促使细胞膜形成微皱褶,与骨表面形成封闭区域,进而发挥骨吸收功能,参与骨质疏松进程。因此,研究影响OC分化活性的基因对于骨质疏松治疗具有重要意义。
本研究发现,转染组Lnc-AK077216 mRNA相对表达量低于对照组和空载组;转染组OC数少于对照组和空载组,TRAP阳性染色面积小于对照组和空载组,提示敲低LncRNA-AK077216可显著抑制RAW264.7细胞向OC分化。LncRNA具有基因表达调控功能,广泛参与细胞增殖、分化、凋亡等生物学行为过程[10]。WANG等[11]表明,LncRNA LINC00311可通过调控Notch信号通路促进骨质疏松模型大鼠中OC的增殖、分化。洪宇桁等[12]研究证实,LncRNA NEAT1在OC分化过程中过表达,且可促进OC分化并抑制OB分化进而诱发骨质疏松。表明调控LncRNA可能作为影响OC分化的途径之一。Lnc-AK077216可通过介导相关信号通路调控OB形成,其异常表达可影响破骨前体细胞向OC分化的活性,导致骨量紊乱。本研究结果显示,诱导后OC数量减少。由此可见,敲降Lnc-AK077216可显著阻断RAW264.7细胞向OC分化的过程,该基因可能成为骨质疏松治疗的潜在靶点。
本研究结果提示敲低Lnc-AK077216对RAW264.7细胞向OC分化的抑制作用可能与调控OPG、RANKL、RANK表达有关。OPG/RANKL/RANK信号通路是近年来发现的OC分化过程中重要的信号传导通路,该通路被激活后可延缓OC凋亡,通过复杂的机制促进骨基质吸收,引发骨质疏松[13-14]。破骨前体细胞或OC细胞表面RANK与RANKL结合后,介导信号激活破骨前体细胞向成熟OC分化,并抑制OC凋亡[15]。OPG可竞争性结合RANKL,阻断RANKL与RANK结合,抑制破骨前体细胞分化,促使成熟OC凋亡。LIU等[16]研究证实,Lnc-AK077216可促进NFATc1表达,而NFATc1是OC形成过程中必需的转录因子,且去卵巢小鼠骨髓中Lnc-AK077216、NFATc1表达均上调。而NFATc1是RANKL/RANK信号系统下游关键转录因子[17],故结合本研究结论推测Lnc-AK077216可通过介导OPG/RANKL/RANK信号通路影响OC分化。
综上所述,敲低Lnc-AK077216可抑制RAW264.7细胞向OC分化,其调控机制可能与上调OPG mRNA及蛋白表达,下调RANKL和RANK mRNA及蛋白表达有关,提示Lnc-AK077216基因及其靶蛋白OPG、RANKL、RANK可能成为骨质疏松及其他骨破坏相关疾病治疗的潜在靶点,为临床治疗提供理论依据。Lnc-AK077216对OC分化的调控可能存在其他机制,仍需进一步研究。

