银杏酚酸通过ERK-JNK-AKT途径诱导前列腺癌细胞p53依赖性凋亡
杨 波,杜岳峰,马帅军
(1 陕西省正和医院泌尿外科,西安 710061;2 西安交通大学第一附属医院泌尿外科;3 空军军医大学西京医院泌尿外科;*通讯作者,E-mail:mashuaijun9@163.com)
前列腺癌(prostate cancer,PCa)在世界范围内男性常见癌症中排名第二,并且也是男性癌症相关死亡的第五大病因[1]。化疗对大多数癌症类型有效,但耐药性在许多情况下限制了化疗疗效。抗癌药物耐药性与许多因素有关,这些因素包括药物外流、药物失活、药物靶标的改变、DNA甲基化、细胞周期停滞和细胞凋亡等[2]。已有数百种化合物在体外被发现可以调节耐药表型,然而,由于体内的高毒性,其临床应用仍然受到限制[3]。因此,寻找更好、更安全的天然药物受到极大的关注。
p53抑癌基因是一种调控细胞凋亡的重要基因,其可被癌基因或DNA损伤诱导的信号通路激活,p53反过来又可促进凋亡相关基因的转录,如Bcl-2家族的促凋亡成员[4]。此外,p53诱导的细胞凋亡也通过激活死亡受体途径或通过线粒体膜去极化来激活caspases[4]。因此,p53依赖性凋亡途径是癌症治疗的重要方向之一。另外,p53依赖性凋亡途径受到多条信号通路的调节,其中包括ERK-JNK-AKT[5,6]。ERK-JNK-AKT信号通路是重要的凋亡调节信号通路,参与多种癌细胞的增殖、凋亡的调节[7]。ERK、JNK和AKT之间存在交互作用,ERK-JNK-AKT信号通路的激活通过调控下游基因来抑制p53依赖性凋亡途径,从而抑制细胞凋亡[5-7]。
银杏(Ginkgo biloba L.)是一种古老的裸子植物,广泛分布于世界各地。银杏酚酸(ginkgolic acid,GA)是银杏叶和种皮中大量存在的主要生物活性成分[8]。银杏酚酸具有多种生物活性,如抗菌、抗炎等[9-11]。近年来,银杏酚酸潜在的抗肿瘤活性引起了广大学者的兴趣。已有研究表明,银杏酚酸对非致瘤细胞无细胞毒性作用,而对结肠癌和胰腺癌等多种癌细胞有明显的抑制作用[12,13]。此外,银杏酚酸通过抑制侵袭和迁移抑制肺癌进展[14]。银杏酚酸对乳腺癌也表现出抗增殖、抗迁移和促凋亡作用[15]。银杏酚酸还能抑制结肠癌细胞的侵袭[16]。目前银杏酚酸在前列腺癌中的应用报道较少。因此,本研究旨在揭示银杏酚酸对前列腺癌细胞增殖和凋亡的影响,并从p53依赖性凋亡途径和ERK-JNK-AKT通路探讨了其调节细胞存活的机制。
1 材料与方法
1.1 材料
1.1.1 实验试剂 青霉素、链霉素购自美国Sigma-Aldrich公司。胎牛血清、RPMI-1640培养基购自美国Gibco公司。银杏酚酸(HPLC>98%)购自滁州仕诺达生物科技有限公司。MTT购自美国Sigma公司。二甲基亚砜(DMSO)购自美国Sigma-Aldrich公司。RIPA裂解缓冲液、Annexin Ⅴ-FITC/碘化丙啶(PI)试剂盒、TUNEL试剂盒购自碧云天生物技术研究所。BCA蛋白质测定试剂盒购自美国Pierce公司。PVDF膜、ECL试剂购自美国Thermo Fisher Scientific公司;PD98059(ERK的选择性抑制剂)、SP600125(JNK的选择性抑制剂)和LY294002(AKT的选择性抑制剂)购自美国MedChemExpress(MCE)。链霉亲和素-生物素复合物购自美国Vector Laboratories公司。Bax、Bcl-2、cleaved-Caspase-3、p53、p-ERK、p-JNK、p-AKT、β-actin、HRP偶联羊抗兔IgG(H+L)购自英国Abcam公司。
1.1.2 细胞与实验动物 人前列腺癌(DU145)细胞系购自美国ATCC。6~7周龄无特异性病原体的雄性BALB/c裸小鼠购自西安交通大学实验动物中心,生产许可证号:SCXK(陕)2020-001,体质量为18~22 g。
1.2 方法
1.2.1 细胞培养 DU145细胞在添加10%胎牛血清、100 U/ml青霉素和100 mg/ml链霉素的RPMI-1640培养基(美国Gibco)中培养,培养环境为37 ℃和5% CO2。
1.2.2 细胞分组及处理 银杏酚酸首先溶解于DMSO,然后用培养基稀释至最终浓度。然后,将DU145细胞用不同浓度银杏酚酸(0,2.5,5,10,20,40,80,160 μmol/L)培养48 h。通过MTT法检测细胞活力,通过Annexin Ⅴ-FITC/PI染色法检测细胞凋亡。
其次,将DU145细胞分为对照组和80 μmol/L的银杏酚酸处理组(GA组),将DU145细胞用0,80 μmol/L的银杏酚酸培养48 h。通过Western blot检测了凋亡相关蛋白(Bax、Bcl-2、cleaved-Caspase-3和P53)的表达。
最后,使用0.5% DMSO将PD98059(ERK的选择性抑制剂)、SP600125(JNK的选择性抑制剂)和LY294002(AKT的选择性抑制剂)进行稀释。将DU145细胞分为8组(在同一批实验中进行),即正常对照组、银杏酚酸组(GA组)、PD98059组、银杏酚酸+PD98059组(GA+PD98059组)、SP600125组、银杏酚酸+SP600125组(GA+SP600125组)、LY294002组、银杏酚酸+LY294002组(GA+LY294002组)。对照组细胞不使用药物处理,GA组细胞使用80 μmol/L的银杏酚酸培养48 h,PD98059组细胞使用50 μmol/L的PD98059培养48 h,GA+PD98059组细胞使用80 μmol/L的银杏酚酸和50 μmol/L的PD98059共培养48 h,SP600125组细胞使用50 μmol/L的SP600125培养48 h,GA+SP600125组细胞使用80 μmol/L的银杏酚酸和50 μmol/L的SP600125共培养48 h,LY294002组细胞使用50 μmol/L的LY294002培养48 h,GA+LY294002组细胞使用80 μmol/L的银杏酚酸和50 μmol/L的LY294002共培养48 h,然后通过MTT法检测细胞活力,通过Annexin Ⅴ-FITC/PI染色法检测细胞凋亡。实验重复3次。
1.2.3 MTT法测定细胞存活率 通过MTT法测定细胞存活率。将DU145细胞以1×105的密度接种于96孔板中,然后用不同药物培养48 h。PBS洗涤细胞,使用100 μl MTT(0.5 mg/ml)室温染色4 h,除去培养基,加入150 μl DMSO,测量490 mm处吸光度。实验重复3次。
1.2.4 Annexin Ⅴ-FITC/碘化丙啶(PI)双重染色分析细胞凋亡 通过Annexin Ⅴ-FITC/碘化丙啶(PI)双重染色分析细胞凋亡。将DU145细胞以4×105的密度接种于6孔板中并培养过夜。用不同药物培养48 h后,PBS洗涤细胞,用Annexin Ⅴ-FITC/PI凋亡检测试剂盒检测细胞凋亡,使用Cytomics FC 500流式细胞仪分析凋亡率。实验重复3次。
1.2.5 动物分组及荷瘤小鼠模型的建立与指标检测 将BALB/c小鼠随机分为生理盐水组(NS组,n=6)、银杏酚酸低剂量组(GA-L组,10 mg/kg,n=6)、银杏酚酸中剂量组(GA-M组,50 mg/kg),n=6、银杏酚酸高剂量组(GA-H组,100 mg/kg,n=6)。BALB/c小鼠饲养在25 ℃、55%相对湿度、12 h光/暗周期的实验室内,不限制食物和水。对所有组小鼠皮下接种DU145细胞(4×105)建立荷瘤小鼠模型,接种第8天开始进行药物治疗。NS组小鼠腹腔注射生理盐水,GA-L组、GA-M组和GA-H组小鼠分别腹腔注射10,50,100 mg/kg的银杏酚酸,每周腹腔注射3次。每7 d用卡尺测量肿瘤大小。肿瘤体积计算公式:0.5×长度×宽度2。治疗28 d后,脱颈处死小鼠,切除肿瘤,通过TUNEL染色检测肿瘤组织中的细胞凋亡。通过免疫组化染色检测肿瘤组织中Bax和Bcl-2的蛋白表达。通过Western blot检测肿瘤组织中Bax、Bcl-2、cleaved-Caspase-3、P53、p-ERK、p-JNK和p-AKT的蛋白表达。
1.2.6 TUNEL染色检测肿瘤组织中的细胞凋亡 TUNEL法检测肿瘤组织细胞凋亡。肿瘤组织用4%多聚甲醛固定后,用Tris缓冲盐水(含3%牛血清白蛋白和20%正常胎牛血清)浸泡30 min。随后,加入50 μl TUNEL溶液,然后与试剂盒各组分在37 ℃下孵育60 min。最后,加入DAB底物,并在光学显微镜下观察和计数TUNEL阳性率。
1.2.7 免疫组织化学染色检测肿瘤组织中Bax和Bcl-2的蛋白表达 肿瘤组织在10%多聚甲醛中固定24 h,常规脱色、包埋、切成4 μm切片。将切片脱蜡并再水化,3%H2O2浸泡10 min,在柠檬酸缓冲液中煮沸3 min,室温下用5%牛血清白蛋白封闭60 min。然后将切片与Bax(1 ∶500)和Bcl-2(1 ∶500)一抗在4 ℃下孵育过夜,然后室温下将切片与二抗(1 ∶1 000)孵育30 min,然后与链霉亲和素-生物素复合物孵育30 min,用苏木精复染细胞核。显微镜拍摄照片并计数阳性染色细胞。
1.2.8 Western blot检测细胞和肿瘤组织中Bax、Bcl-2、cleaved-Caspase-3、P53、p-ERK、p-JNK和p-AKT的蛋白表达水平 细胞或肿瘤组织匀浆在冰RIPA裂解缓冲液和1 mmol/L苯甲基磺酰氟(蛋白酶抑制剂)中裂解。离心收集上清液,使用Pierce BCA蛋白质测定试剂盒测定蛋白质浓度。将蛋白质通过SDS-PAGE上电泳分离并转移到PVDF膜上,将膜在室温下用5%脱脂乳孵育1 h后,与Bax(1 ∶2 000)、Bcl-2(1 ∶2 000)、cleaved-Caspase-3(1 ∶3 000)、P53(1 ∶500)、p-ERK(1 ∶1 000)、p-JNK(1 ∶2 000)、p-AKT(1 ∶2 000)和β-actin(1 ∶5 000)一抗在4 ℃孵育过夜,然后将膜与HRP偶联羊抗兔IgG(H+L)二抗(1 ∶1 000)在室温下孵育1 h。使用ECL试剂显影。通过Image-Pro Plus 6.0软件计算目标条带灰度值。β-actin作为内部对照,将各组数据以对照组或NS组的倍数做归一化处理。
1.3 统计学分析
使用SPSS 18.0进行统计分析。所有计量数据表示为平均数±标准差,两组间比较采用t检验,多组间比较采用单因素方差分析和LSD检验。P<0.05表示差异有统计学意义。
2 结果
2.1 银杏酚酸对DU145细胞增殖的影响
MTT法检测显示,用不同浓度银杏酚酸(0,2.5,5,10,20,40,80,160 μmol/L)培养DU145细胞48 h后,与0 μmol/L比较,5,10,20,40,80和160 μmol/L处理后DU145细胞活力均降低,并且随着银杏酚酸浓度的升高,相对细胞活力逐渐降低,差异有统计学意义(P<0.05,见图1)。
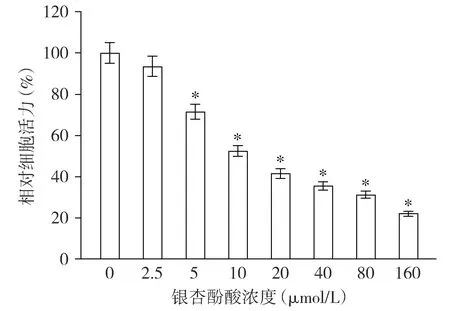
与0 μmol/L相比,* P <0.05图1 MTT法检测不同浓度银杏酚酸对DU145细胞增殖的影响 (n=3)Figure 1 Effect of different concentrations of ginkgolic acid on the proliferation of DU145 cells by MTT method (n=3)
2.2 银杏酚酸对DU145细胞凋亡的影响
Annexin Ⅴ-FITC/PI染色显示,用不同浓度银杏酚酸培养DU145细胞48 h后,与0 μmol/L比较,5,10,20,40,80,160 μmol/L处理后DU145细胞凋亡率显著升高,并且随着银杏酚酸浓度的升高,细胞凋亡率逐渐升高,差异有统计学意义(P<0.05,见图2)。Western blot检测了凋亡相关蛋白(Bax、Bcl-2、cleaved-Caspase-3和P53)的表达,与对照组比较,GA组DU145细胞中Bax、cleaved-Caspase-3和P53蛋白表达水平显著升高,而Bcl-2蛋白表达水平显著降低(P<0.05,见图3)。
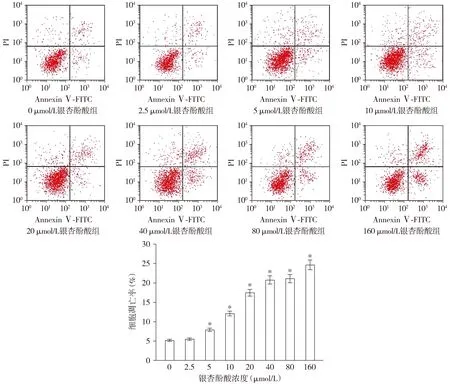
与0 μmol/L相比,* P <0.05图2 Annexin Ⅴ-FITC/PI染色检测不同浓度银杏酚酸对DU145细胞凋亡的影响 (n=3)Figure 2 Effect of different concentrations of ginkgolic acid on the apoptosis of DU145 cells by Annexin Ⅴ-FITC/PI staining (n=3)
2.3 银杏酚酸对DU145细胞中ERK、JNK和AKT激活的影响
Western blot检测结果显示,与对照组相比,GA组细胞中p-ERK、p-JNK和p-AKT蛋白表达水平均显著降低(P<0.05,见图3)。
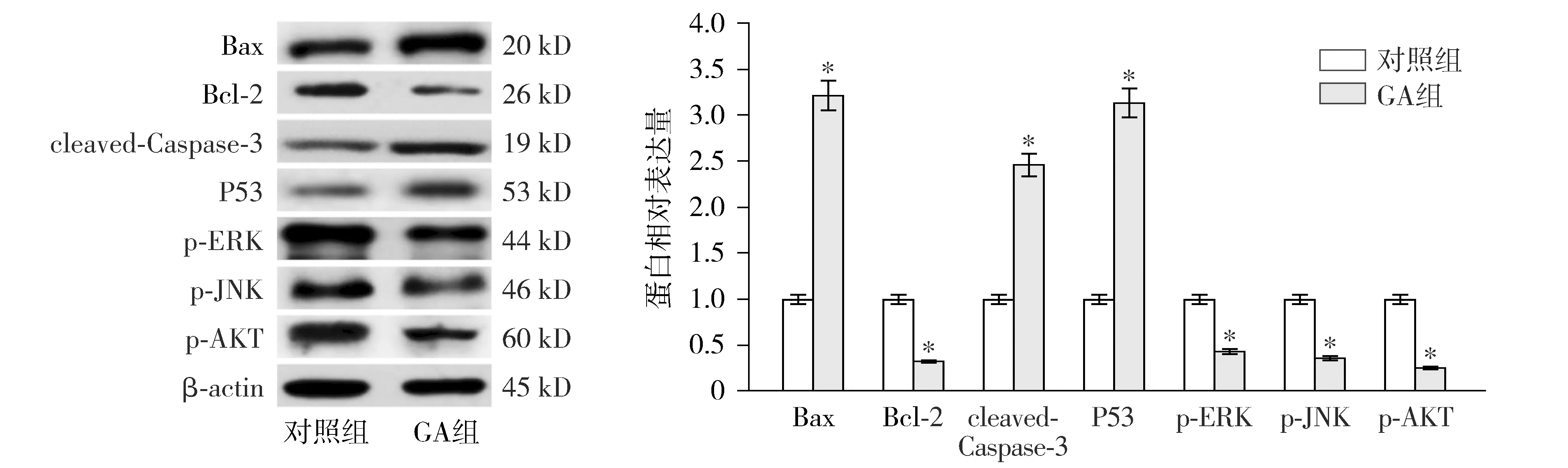
与对照组比较,* P <0.05图3 银杏酚酸对DU145细胞中Bax、Bcl-2、cleaved-Caspase-3、P53、p-ERK、p-JNK和p-AKT蛋白表达的影响 (n=3)Figure 3 Effect of ginkgolic acid on the protein expression levels of Bax, Bcl-2, cleaved-Caspase-3, P53, p-ERK, p-JNK and p-AKT in DU145 cells (n=3)
2.4 ERK、JNK和AKT介导银杏酚酸对DU145细胞的抗癌作用
与对照组相比,GA组、PD98059组、SP600125组和LY294002组细胞活力均显著降低(P<0.05);与GA组相比,GA+PD98059组、GA+SP600125组和GA+LY294002组细胞活力均进一步降低(P<0.05,见图4)。
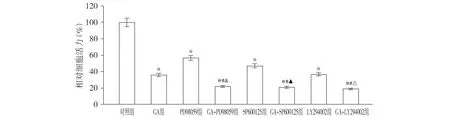
与对照组相比,* P <0.05;与GA组相比,#P <0.05;与PD98059组相比,&P <0.05;与SP600125组相比,▲P <0.05;与LY294002组相比,△P <0.05图4 银杏酚酸、PD98059、SP600125和LY294002对DU145细胞增殖的影响 (n=3)Figure 4 Effect of ginkgolic acid, PD98059, SP600125 and LY294002 on the proliferation of DU145 cells (n=3)
与对照组相比,GA组、PD98059组、SP600125组和LY294002组细胞凋亡率均显著升高(P<0.05);与GA组相比,GA+PD98059组、GA+SP600125组和GA+LY294002组细胞凋亡率均进一步升高(P<0.05,见图5)。
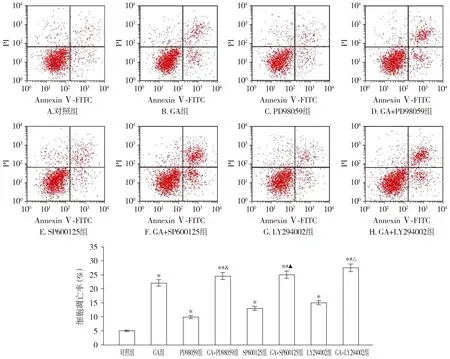
与对照组相比,* P <0.05;与GA组相比,#P <0.05;与PD98059组相比,&P <0.05;与SP600125组相比,▲P <0.05;与LY294002组相比,△P <0.05图5 Annexin Ⅴ-FITC/PI染色检测银杏酚酸、PD98059、SP600125和LY294002对DU145细胞凋亡的影响 (n=3)Figure 5 Effect of ginkgolic acid, PD98059, SP600125 and LY294002 on apoptosis of DU145 cells by Annexin Ⅴ-FITC/PI staining (n=3)
2.5 银杏酚酸抑制DU145荷瘤小鼠的肿瘤生长
NS组小鼠在接种第19天和第25天时各有1只死亡,GA-M组在第21天时有1只死亡。DU145荷瘤小鼠肿瘤体积测量结果显示,在接种第21天和第28天时,与NS组相比,GA-L组、GA-M组和GA-H组肿瘤体积均显著降低(P<0.05);与GA-L组相比,GA-M组和GA-H组肿瘤体积均显著降低(P<0.05);与GA-M组相比,GA-H组肿瘤体积显著降低(P<0.05,见图6)。
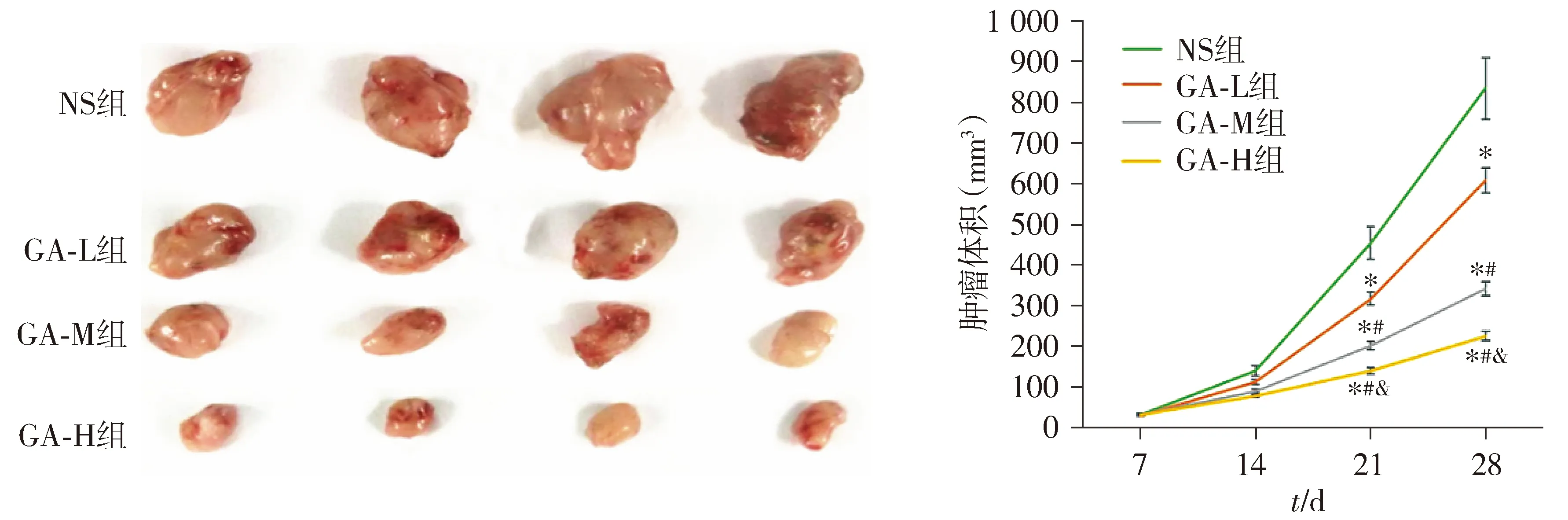
与NS组相比,* P <0.05;与GA-L组相比,#P <0.05;与GA-M组相比,& P <0.05图6 银杏酚酸对荷瘤小鼠肿瘤体积的影响 (n=6)Figure 6 Effect of ginkgolic acid on tumor volume in tumor-bearing mice (n=6)
2.6 银杏酚酸促进DU145荷瘤小鼠肿瘤组织中p53依赖性凋亡
TUNEL染色结果显示,与NS组相比,GA-L组、GA-M组和GA-H组TUNEL阳性率显著升高(P<0.05);与GA-L组相比,GA-M组和GA-H组TUNEL阳性率显著升高(P<0.05);与GA-M组相比,GA-H组TUNEL阳性率显著升高(P<0.05,见图7)。
免疫组化染色结果显示,与NS组相比,GA-L组、GA-M组和GA-H组Bax蛋白表达水平显著升高,而Bcl-2蛋白表达水平显著降低(P<0.05);与GA-L组相比,GA-M组和GA-H组Bax蛋白表达水平显著升高,而Bcl-2蛋白表达水平显著降低(P<0.05);与GA-M组相比,GA-H组Bax蛋白表达水平显著升高,而Bcl-2蛋白表达水平显著降低(P<0.05,见图8)。
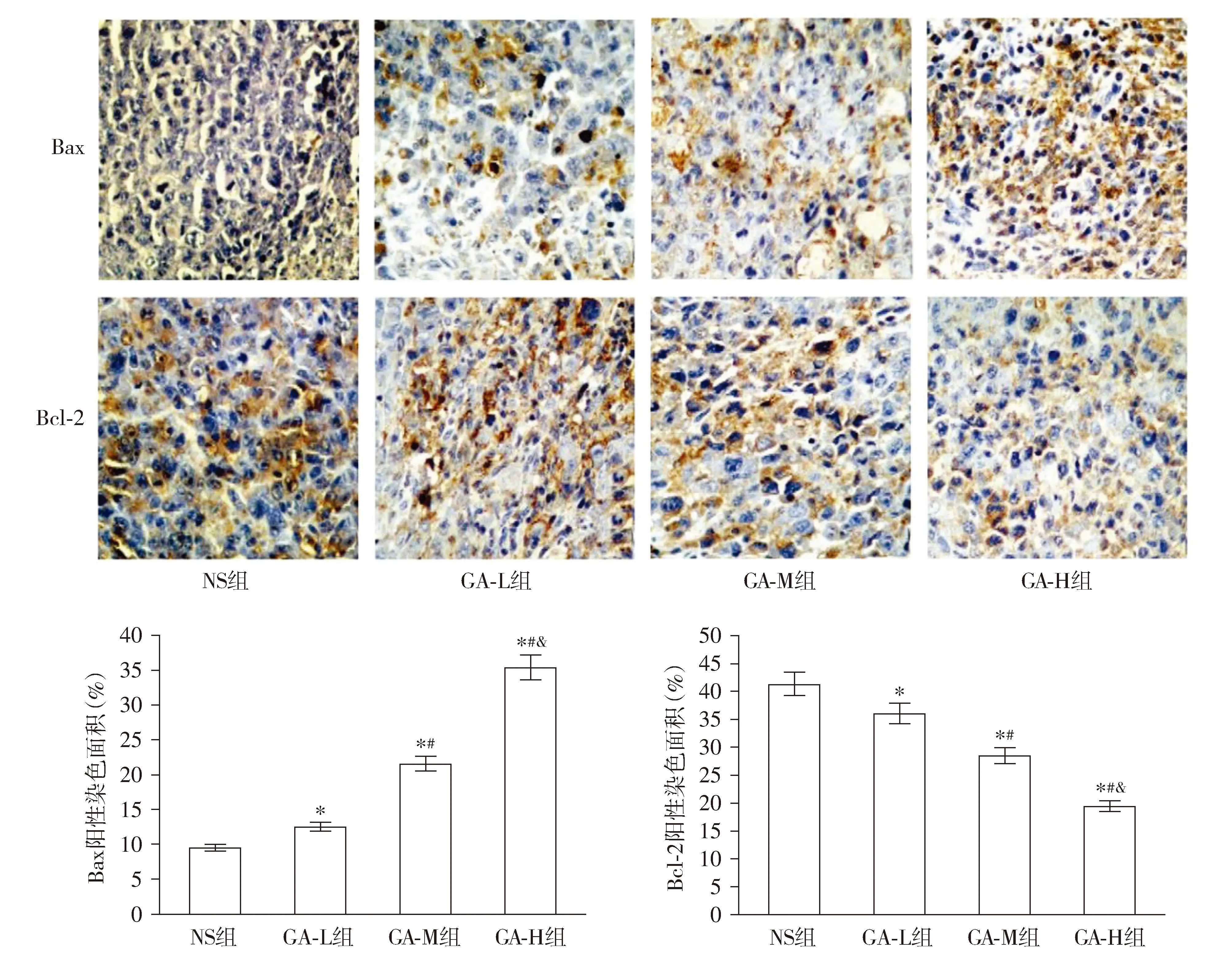
与NS组比较,* P <0.05;与GA-L组相比,#P <0.05;与GA-M组相比,& P <0.05图8 银杏酚酸对荷瘤小鼠肿瘤组织中Bax和Bcl-2蛋白表达的影响 (n=6,免疫组化染色,×200)Figure 8 Effect of ginkgolic acid on the expression of Bax and Bcl-2 protein in tumor tissues of tumor-bearing mice (n=6, immunohistochemistry,×200)
Western blot检测显示,与NS组相比,GA-L组、GA-M组和GA-H组肿瘤组织中Bax、cleaved-Caspase-3和P53蛋白表达水平显著升高,而Bcl-2显著降低(P<0.05);与GA-L组相比,GA-M组和GA-H组肿瘤组织中Bax、cleaved-Caspase-3和P53蛋白表达水平显著升高,而Bcl-2显著降低(P<0.05);与GA-M组相比,GA-H组肿瘤组织中Bax、cleaved-Caspase-3和P53蛋白表达水平显著升高,而Bcl-2显著降低(P<0.05,见图9)。
2.7 银杏酚酸抑制DU145荷瘤小鼠肿瘤组织中ERK、JNK和AKT的激活
Western blot检测结果显示,与NS组相比,GA-L组、GA-M组和GA-H组肿瘤组织中p-ERK、p-JNK和p-AKT蛋白表达水平显著降低(P<0.05)。与GA-L组相比,GA-M组和GA-H组肿瘤组织中p-ERK、p-JNK和p-AKT蛋白表达水平显著降低(P<0.05)。与GA-M组相比,GA-H组肿瘤组织中p-ERK、p-JNK和p-AKT蛋白表达水平显著降低(P<0.05,见图9)。
3 讨论
目前,多项文献报道了银杏酚酸的抗癌活性,并探讨了相关分子机制。例如,银杏酚酸可抑制肝癌HepG2细胞的迁移和侵袭能力、抑制侵袭相关分子(MMP-2和MMP-9)的表达,阻止上皮-间充质转化[17]。银杏酚酸通过失活EGFR信号通路抑制肾癌细胞生长[18]。银杏酸通过诱导细胞凋亡和抑制活性氧调节的STAT3/JAK2信号通路抑制胃癌生长[19]。目前尚无文献报道银杏酚酸在前列腺癌中的应用效果。本研究表明,银杏酚酸在体外和体内抑制了前列腺癌细胞生长,说明银杏酚酸也是治疗前列腺癌的候选天然药物。
肿瘤抑制基因p53可以在各种条件下被激活,包括缺氧、热休克和DNA损伤[20]。p53调控凋亡相关基因(如Bax、cleaved-Caspase-3和Fas)的转录[20]。因此,靶向p53依赖性凋亡是治疗癌症的关键。本研究结果显示,银杏酚酸在体外和体内均升高了前列腺癌细胞和肿瘤组织中Bax、cleaved-Caspase-3和P53的蛋白表达,但降低了Bcl-2的蛋白表达。已知癌细胞的凋亡是通过核酸内切酶和caspase级联的顺序激活来调节。在细胞凋亡过程中,可以观察到caspase活性的增加。这些caspase酶,特别是cleaved-Caspase-3,可引起一系列与细胞凋亡相关的特征性变化。这些变化包括细胞萎缩、染色质凝聚、碎裂和质膜起泡[20]。Bax通过破坏线粒体控制细胞死亡,线粒体破坏导致细胞色素c释放到胞浆中。其他文献[21]也报道,银杏酚酸抑制了结肠癌细胞的增殖、迁移和侵袭,通过G0/G1期阻滞导致细胞死亡,并激活自噬。此外,银杏酚酸还能诱导细胞色素c从线粒体释放到胞浆中,从而激活结肠癌细胞内在的细胞凋亡途径[21]。这些结果说明银杏酚酸的促凋亡作用至少部分是通过p53依赖性凋亡途径实现。
丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路的激活参与化疗药物在多种癌细胞中的抗增殖和促凋亡作用[22]。MAPK激活的效果取决于细胞类型以及激活的刺激和持续时间。MAPK信号通路包含在细胞分化、增殖和存活中起重要作用的蛋白激酶家族(ERK和JNK)[23]。越来越多的证据表明,MAPK的激活与细胞周期停滞和细胞凋亡的诱导有关。MAPK持续活化可诱导p21表达,导致细胞周期停滞和细胞衰老[24]。一些研究表明,氧化应激可以激活JNK并导致细胞凋亡[25]。JNK在激活由线粒体介导的内在凋亡途径以响应细胞应激中起重要作用,其在激活时促进促凋亡蛋白Bax易位至线粒体[26]。此外,ERK也被鉴定为参与细胞凋亡和PARP信号传导[27]。AKT是丝氨酸/苏氨酸激酶。它是调节对细胞死亡和存活很重要的细胞信号的关键参与者[28]。此外,AKT是参与抗凋亡蛋白Bcl-2转录调控的主要调节因子,其在预防细胞死亡中起关键作用[29]。ERK、JNK和AKT之间存在相互网络,ERK可以调节JNK的激活[30-32],而ERK和JNK均可调节AKT的激活[33-38]。值得注意的是,ERK、JNK和AKT均通过调控下游多种因子来影响p53依赖性凋亡途径,从而调节细胞增殖和凋亡[5-7]。本研究结果显示,银杏酚酸抑制了DU145细胞和荷瘤小鼠肿瘤组织中ERK-JNK-AKT途径的激活。为了进一步验证ERK-JNK-AKT途径是否介导银杏酚酸的抗癌活性,本研究使用PD98059(ERK的选择性抑制剂)、SP600125(JNK的选择性抑制剂)和LY294002(AKT的选择性抑制剂)处理DU145细胞,结果显示PD98059、SP600125和LY294002处理同样抑制了前列腺癌细胞的增殖并诱导了凋亡,间接证明了ERK-JNK-AKT途径介导银杏酚酸对DU145细胞的抗癌作用。其他文献报道,银杏酚酸通过抑制PI3K/Akt/mTOR信号通路抑制肺癌的侵袭和迁移,与本文结果一致[14]。还有文献报道,银杏酚酸抑制了胰腺癌细胞的集落形成、迁移和侵袭能力,增加癌细胞凋亡;此外,银杏酚酸通过诱导AMP活化蛋白激酶(AMPK)信号的激活抑制癌细胞的新生脂肪生成,并下调参与脂肪生成的关键酶(例如乙酰辅酶A羧化酶[ACC],脂肪酸合成酶[FASN])的表达,并抑制了肿瘤生长[12]。银杏酚酸可能通过诱导AMPK激活和抑制侵袭相关蛋白的表达而抑制SW480结肠癌细胞的增殖、迁移和侵袭[39]。这些结果说明,银杏酚酸的抗癌活性与多种机制有关。
综上所述,本研究表明银杏酚酸对前列腺癌具有良好的抗癌活性,银杏酚酸通过ERK-JNK-AKT途径诱导前列腺癌细胞p53依赖性凋亡。银杏酚酸有望成为前列腺癌治疗的候选天然药物。

