冬凌草甲素调控miR-200c/EZH2 轴抑制黑色素瘤细胞上皮-间质转化的机制研究
赵汴霞任 红晋佳路曹 杰∗
(1.河南医学高等专科学校药理学教研室,郑州 451191;2.山东省青岛市市立医院药剂科,山东 青岛 266000)
黑色素瘤主要发端于皮肤中称为黑色素细胞的含色素细胞,其发生率和死亡率逐年增加[1]。 尽管多数早期黑色素瘤患者通过外科手术的方式得到治愈,但由于其高转移性,晚期恶性患者的5 年生存率仅在5%左右,已知上皮间质转化(epithelialmesenchymal transition,EMT)在恶性肿瘤转移中具有关键作用,因此,阐明黑色素瘤的EMT 机制对有效控制肿瘤的发展及治疗十分重要[2-3]。 冬凌草甲素是从红景天中分离出来的活性成分,具抗炎、抗菌和抗肿瘤的作用,一些研究称其在皮肤黑色素瘤中显示出有效的抗癌活性[4]。 多项研究表明微小RNA(miRNA)以癌基因或抑癌基因的作用参与调控恶性肿瘤的发生和发展,促进或抑制肿瘤的EMT过程[2-3,5]。 miR-200c 作为miRNA 家族的成员,已被发现其在黑色素瘤细胞中过表达可抑制细胞增殖、迁移能力以及耐药性[6]。 组蛋白甲基化转移酶果蝇zeste基因增强子同源物2(enhancer ofzestehomolog 2,EZH2)在黑色素瘤中表达异常增加,还可作为重要的EMT 诱导剂,参与癌症的转移[7-8]。 有研究表明,miR-200c 能通过抑制EZH2 表达来抑制肾细胞癌的进展[9]。 因此,本研究旨在探究冬凌草甲素通过调控miR-200c/EZH2 轴对黑色素瘤EMT的影响机制,以期为黑色素瘤治疗机制研究及治疗靶点的寻找提供参考。
1 材料和方法
1.1 实验动物
24 只SPF 级7~8 周龄BALB/C 裸鼠(22~24 g)购买于河南省实验动物中心[SCXK(豫)2017-0001],于河南省中医药研究院[SYXK(豫)2019-0001]进行为期1 周的适应性饲养(自由饮水、采食、12 h 明暗周期、(24±2)℃)。 实验经河南医学高等专科学校实验动物福利伦理审查委员会批准通过(20190012),符合3R 原则。
1.2 主要试剂与仪器
冬凌草甲素(上海宝曼生物科技有限公司,货号:D0348-20 mg,HPLC≥98%标准品);A375 细胞系(武汉益普生物科技有限公司,货号:YCL-0014);LipofectamineTM2000 Transfection Reagent(北京百瑞极生物科技有限公司,货号:BN17003);BCA 蛋白含量检测试剂盒、双荧光素酶报告基因检测试剂盒(武汉纯度生物科技有限公司,货号:CDLG-5055、CDLG-4997);HRP 标记的山羊抗兔IgG 二抗抗体(Invitrogen Antibodies,货号:A-11001);兔抗β-actin抗体(Abcam,货号:ab8227);兔抗EZH2、神经型钙黏附蛋白(N-cadherin)、波形蛋白(Vimentin)、钙粘附蛋白 E ( E-cadherin) 抗体( Cell Signaling Technology,货号:5246、13116、5741、3195);MTT 检测试剂盒(上海泽叶生物科技有限公司,货号:ZY111105-500)。 BioSpectrum-美国UVP 凝胶成像系统购自上海天放实验仪器有限公司;实时荧光定量PCR 仪购自赛默飞世尔。
1.3 实验方法
1.3.1 A375 细胞培养
将黑色素瘤细胞(A375 细胞)培养于RPMI 1640 培养基中(含双抗和胎牛血清),放入恒温培养箱中培养(5% CO2、37℃)至细胞融合度约为80%时进行传代培养。
1.3.2 MTT 法检测A375 细胞活力
取对数生长期A375 细胞以每毫升1×105个浓度接种于96 孔板中(每孔100 μL)培养24 h 后,分别添加0、5、10、20、40、80 μmol/L 冬凌草甲素[10](按每毫升培养基添加29.16 μg 冬凌草甲素配置成80 μmol/L 浓度,依次梯度稀释为40、20、10、5 μmol/L,设置5 个复孔)培养48 h,弃培养基后添加20 μL MTT(5 μg/L)培养4 h,添加二甲基亚砜(200 μL)并震荡使结晶溶解,置于酶标仪490 nm 处检测吸光度(A490)值,计算细胞活力(%)= 处理组A490/对照组A490×100%。
1.3.3 实验分组
设置对照组、冬凌草甲素组(40 μmol/L 冬凌草甲素)、mimic control 组、miR-200c mimics 组、冬凌草甲素+inhibitor control 组、冬凌草甲素+miR-200c inhibitor 组;将对数生长期A375 细胞接种于6 孔板中培养至细胞融合度约为80%后按照试剂盒说明书操作,将miR-200c 模拟物、抑制剂及其相应阴性对照分别转至A375 细胞中,再按照分组情况添加40 μmol/L 冬凌草甲素进行培养48 h。
1.3.4 qRT-PCR 检测miR-200c、EZH2 mRNA 表达
用TRIzol 法提取转染后A375 细胞及肿瘤组织中总RNA 并检测浓度及纯度,后按反转录试剂盒说明书进行操作将RNA 反转录成cDNA,根据qRTPCR 试剂盒说明书进行扩增(重复3 次),通过GAPDH及U6 作为内参分别对EZH2 和miR-200c基因标准化后使用2-ΔΔCt计算两基因表达情况(表1)。

表1 miR-200c、EZH2 所用qRT-PCR 引物Table 1 qRT-PCR primers for miR-200c and EZH2
1.3.5 免疫印迹法检测EZH2 及EMT 相关蛋白表达情况
添加RIPA 裂解液(500 μL)于冰上将A375 细胞裂解提取总蛋白,并使用BCA 法定量蛋白后经10% SDS-PAGE 凝胶电泳将各蛋白分离,所得分离蛋白低温转膜后脱脂奶粉封闭(1 h),添加兔抗βactin、EZH2、N-cadherin、Vimentin 及E-cadherin(1 ∶1000)一抗并4℃过夜,于次日添加已经过稀释的二抗(1 ∶5000)1 h 孵育后ECL 试剂显影,于蛋白凝胶成像仪中观察条带,并使用Image J 分析条带灰度值,计算各个蛋白含量(重复3 次)。
1.3.6 黏附实验检测A375 细胞黏附能力
使用纤维粘连蛋白(fibronectin)5 μg/mL 包被盖玻片风干后放置到35 mm 培养皿中,添加1.5 mL各组A375 细胞悬液(每毫升3×105个)1 h 后弃培养基,添加200 μL 表皮细胞生长因子(10 ng/mL)30 min 后使用PBS 终止反应,多聚甲醛(4%)固定后于倒置显微镜下随机选取5 个视野观察细胞黏附数(每组重复3 个)。
1.3.7 Transwell 实验检测A375 细胞侵袭及迁移能力
迁移能力检测:将使用RPMI-1640 无血清培养基所制成的A375 细胞悬液(每毫升1×105个)接种到Transwell 上室中(100 μL),在下室中加入RPMI-1640 含血清培养基(600 μL),于5% CO2、37℃培养箱中培养24 h,使用棉球将上室未穿膜的残余细胞擦去,选取5 个视野对穿膜细胞计数;侵袭能力检测:使用经胶所包被的Matrigel Transwell 小室上室,其余步骤与上述迁移步骤相同(每组重复3 个)。
1.3.8 荧光素酶报告基因实验检测miR-200c 与EZH2 的靶向关系
首先通过生物信息学TargetScan 网址确定miR-200c 与EZH2 结合位点后构建野生型pmirGLOEZH2-wt 载体及突变型pmirGLO-EZH2-mut 载体,将二者分别与miR-200c mimics、miR-NC 进行相应转染,分为:pmirGLO-EZH2-wt+miR-200c mimics 组、pmirGLO-EZH2-wt+ miR-NC 组、pmirGLO-EZH2-mut+miR-200c mimics 组、pmirGLO-EZH2-mut+miR-NC组,48 h 后弃培养基,并经过PBS 清洗后加入细胞裂解液(200 μL),离心取上清转移至新EP 管中后根据双荧光素酶试剂盒说明书进行染色,检测荧光素酶相对活性。
1.3.9 构建移植瘤裸鼠模型及处理
将所购买的24 只BALB/C 裸鼠以6 只/组随机分为4 组,分为对照组、冬凌草甲素组、冬凌草甲素+inhibitor control 组、冬凌草甲素+miR-200c inhibitor 组,在裸鼠左侧腋窝外侧皮下注射0.2 mL 1.3.2 中对照组、冬凌草甲素组、冬凌草甲素+inhibitor control 组、冬凌草甲素+miR-200c inhibitor组细胞悬液(2×106个),饲养30 d 后将其处死,取出肿瘤组织并称取肿瘤质量(每组重复6 个),取3只裸鼠体内肿瘤组织,通过qRT-PCR 检测肿瘤组织中miR-200c、EZH2 表达情况,取其余3 只裸鼠体内肿瘤组织,免疫组化法分析EMT 相关蛋白表达情况。
1.3.10 免疫组化法分析EMT 相关蛋白表达情况
将所得各组肿瘤组织进行多聚甲醛固定,制作常规组织石蜡切片,二甲苯浸泡5 min 后脱蜡水化,EDTA 缓冲液修复抗原后添加兔抗N-cadherin、Vimentin 及E-cadherin 一抗,过夜孵育后添加二抗孵育0.5 h,DAB 显色、苏木精复染、封片、显微镜观察(每组重复3 个)。
1.4 统计学方法
采用SPSS 24.0 分析数据,以平均数±标准差(±s)描述计量资料,两组间比较行t检验,多组间比较行单因素方差分析,P<0.05 为差异具有统计学意义。
2 结果
2.1 冬凌草甲素对A375 细胞活力的影响
A375 细胞存活率随冬凌草甲素浓度的增加(0、5、10、20、40、80 μmol/L)而显著降低,其分为100%,(85.15 ± 8.22)%, (70.35 ± 6.63)%, (60.82 ±6.74)%,(47.26±5.70)%,(30.49±4.82)%(P<0.05),存在剂量依赖性,并选取40 μmol/L 冬凌草甲素进行后续实验。
2.2 冬凌草甲素对A375 细胞miR-200c、EZH2 mRNA 及EZH2 蛋白表达的影响
与对照组相比,冬凌草甲素组A375 细胞中miR-200c 表达水平显著增加,EZH2 mRNA 及EZH2蛋白表达水平显著降低(P<0.05),见图1、2。

注:与对照组相比,∗P<0.05。图1 冬凌草甲素对A375 细胞miR-200c、EZH2 mRNA及EZH2 蛋白表达的影响Note. Compared with control group, ∗P<0.05.Figure 1 Effect of oridonin on the expression of miR-200c,EZH2 mRNA, EZH2 protein in A375 cells

图2 冬凌草甲素对A375 细胞EZH2 蛋白表达的影响Figure 2 Effect of oridonin on EZH2 protein expression in A375 cells
2.3 冬凌草甲素对A375 细胞EMT 的影响
与对照组相比,冬凌草甲素组A375 细胞中Ncadherin 及Vimentin 表达水平、迁移细胞数、侵袭细胞数、黏附细胞数显著降低,E-cadherin 表达水平显著增加(P<0.05),见图3、4、5。
2.4 miR-200c 靶向调控EZH2 的表达
TargetScan 网址预测显示:miR-200c 与EZH2存在靶向结合位点(见图6);荧光素酶报告基因检测显示,与pmirGLO-EZH2-wt+miR-NC 组(0.91±0.12)相比,pmirGLO-EZH2-wt+miR-200c mimics 组荧光素酶活性(0.47±0.08)显著降低(P<0.05),而其余两组荧光素酶活性无显著性差异(0.89±0.11 vs 0.90±0.13,P>0.05);与对照组(1.30±0.24)、mimic control 组(1.29±0.22)相比,miR-200c mimics组EZH2 蛋白表达水平(0.68±0.10)显著降低(P<0.05),见图7。

图6 miR-200c 与EZH2 的靶向结合位点Figure 6 Targeted binding sites of miR-200c and EZH2
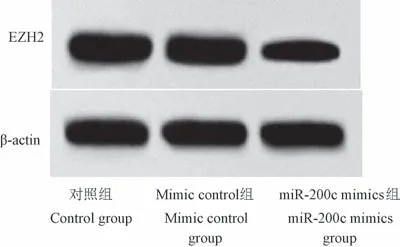
图7 miR-200c 过表达对A375 细胞中EZH2蛋白表达的影响Figure 7 Effect of miR-200c overexpression on EZH2 protein expression in A375 cells
2.5 miR-200c 过表达对A375 细胞EMT 的影响
与对照组相比,mimic control 组各指标无显著性差异(P>0.05),miR-200c mimics 组A375 细胞中N-cadherin 及Vimentin 表达水平、迁移细胞数、侵袭细胞数、黏附细胞数显著降低,E-cadherin 表达水平显著增加(P<0.05),见图8、9、10。

图8 miR-200c 过表达对A375 细胞EMT 相关蛋白表达的影响Figure 8 Effect of miR-200c overexpression on EMT related protein expression in A375 cells
2.6 miR-200c 表达沉默逆转冬凌草甲素对EMT的影响
与对照组相比,冬凌草甲素组A375 细胞中Ncadherin 及Vimentin 表达水平、迁移细胞数、侵袭细胞数、黏附细胞数显著降低,E-cadherin 表达水平显著增加(P<0.05);与冬凌草甲素组相比,冬凌草甲素+miR-200c inhibitor 组N-cadherin 及Vimentin 表达水平、迁移细胞数、侵袭细胞数黏附细胞数显著增加,E-cadherin 表达水平显著降低(P<0.05),见图11、12、13。
2.7 miR-200c 表达沉默逆转冬凌草甲素对肿瘤质量的影响
与对照组(0.54±0.10)相比,冬凌草甲素组(0.15±0.03)肿瘤质量显著降低(P<0.05);与冬凌草甲素组相比,冬凌草甲素+inhibitor control 组(0.16±0.05)无显著变化,冬凌草甲素+miR-200c inhibitor 组(0.48±0.12)肿瘤质量显著增加(P<0.05),见图14。
2.8 miR-200c 表达沉默逆转冬凌草甲素对体内肿瘤中EMT 相关蛋白表达的影响
与对照组相比,冬凌草甲素组N-cadherin 及Vimentin 蛋白表达水平显著降低,E-cadherin 蛋白表达水平显著增加(P<0.05);与冬凌草甲素组相比,冬凌草甲素+miR-200c inhibitor 组N-cadherin 及Vimentin 蛋白表达水平显著增加,E-cadherin 蛋白表达水平显著降低(P<0.05),见图15。

注:与对照组相比,∗P<0.05。图3 冬凌草甲素对A375 细胞EMT 的影响Note. Compared with control group, ∗P<0.05.Figure 3 Effect of oridonin on EMT of A375 cells

图4 冬凌草甲素对A375 细胞EMT 相关蛋白表达的影响Figure 4 Effect of oridonin on EMT related protein expression in A375 cells

图5 冬凌草甲素对A375 细胞侵袭及迁移的影响Figure 5 Effect of oridonin on invasion and migration of A375 cells

图15 miR-200c 表达沉默逆转冬凌草甲素对肿瘤组织中EMT 相关蛋白表达的影响Figure 15 miR-200c expression silencing reverses the effect of oridonin on the expression of EMT-relatedproteins in tumor tissues
2.9 miR-200c 表达沉默逆转冬凌草甲素对体内肿瘤中miR-200c、EZH2 mRNA 表达的影响
与对照组相比,冬凌草甲素组EZH2 mRNA表达水平显著降低,miR-200c 表达水平显著增加(P<0. 05);与冬凌草甲素组相比,冬凌草甲素+miR-200c inhibitor 组EZH2 mRNA 表达水平显著增加,miR-200c 表达水平显著降低(P<0. 05),见图16。

注:与对照组相比,∗P<0.05。图9 miR-200c 过表达对A375 细胞EMT 的影响Note. Compared with control group, ∗P<0.05.Figure 9 Effect of miR-200c overexpression on EMT of A375 cells

图10 miR-200c 过表达对A375 细胞侵袭及迁移的影响Figure 10 Effect of miR-200c overexpression on invasion and migration of A375 cells

注:与对照组相比,∗P<0.05;与冬凌草甲素组相比,#P<0.05。图11 miR-200c 表达沉默逆转冬凌草甲素对EMT 的影响Note. Compared with control group, ∗P<0.05. Compared with oridonin group, #P<0.05.Figure 11 miR-200c silencing reverses the effect of oridonin on EMT

注:A:对照组;B:冬凌草甲素组;C:冬凌草甲素+inhibitor control组;D:冬凌草甲素+miR-200c inhibitor 组。图13 miR-200c 表达沉默逆转冬凌草甲素对EMT 相关蛋白表达的影响Note. A, Control group. B, Oridonin group. C, Oridonin+inhibitor control group. D, Oridonin+miR-200c inhibitor group.Figure 13 miR-200c silencing reverses the effect of oridonin on EMT related protein expression

注:A:对照组;B:冬凌草甲素组;C:冬凌草甲素+inhibitor control组;D:冬凌草甲素+miR-200c inhibitor 组。图14 肿瘤形态观察Note. A, Control group. B, Oridonin group. C, Oridonin + inhibitor control group. D, Oridonin + miR-200c inhibitor group.Figure 14 Tumor morphology observation

注:与对照组相比,∗P<0.05;与冬凌草甲素组相比,#P<0.05。图16 miR-200c 表达沉默逆转冬凌草甲素对肿瘤组织中miR-200c、EZH2 mRNA 表达的影响Note. Compared with control group, ∗P<0.05. Compared with oridonin group, #P<0.05.Figure 16 miR-200c expression silence reverses the effect of oridonin on the expression of miR-200c and EZH2 mRNA in tumor tissues
3 讨论
黑色素瘤近年来发病率不断增加,尽管采用标准疗法和新疗法在疾病治疗中取得了很大的进展,但患者预后仍不理想[11-13]。 上皮细胞转化为间充质细胞的EMT 过程在肿瘤侵袭和转移中具有关键作用,是肿瘤进展必要事件之一[4]。 因此,需要迫切寻找用于抑制黑色素瘤EMT 过程的新的治疗手段,而目前低毒性新的治疗药物是研究重点[11]。
冬凌草甲素是从红景天中提取的一种重要的中药活性成分之一,至今,其抗癌活性已得到了广泛研究,一些报告称其在黑色素瘤中通过诱导癌细胞凋亡抑制来损害黑素瘤细胞的存活和增殖能力[4,12,14]。 冬凌草甲素可通过抑制EMT 及基质金属蛋白酶表达来有效抑制A375 细胞的侵袭及转移能力[10]。 冬凌草甲素可通过抑制粘着斑激酶(focal adhesion kinase, FAK)-细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK1/2)信号通路激活达到抑制小细胞肺癌细胞(H1688)的迁移和EMT 的目的[15]。 冬凌草甲素可通过抑制蛋白激酶B(protein kinase B,AKT)/信号转导和转录激活因子3(signal transducer and activator of transcription 3,STAT3)通路来抑制EMT[16]。 本研究发现,冬凌草甲素以剂量依赖性的方式显著降低A375 细胞存活率,与前人研究结果相一致,该结果表明冬凌草甲素对黑色素瘤具有有效抑癌作用。 肿瘤在侵袭、转移过程中可对宿主的组织成分产生黏附作用,因此其黏附能力与癌细胞转移具有密切联系[10]。 在EMT 过程中E-cadherin 表达异常降低,而Vimentin和N-cadherin 表达异常增加[17]。 本研究还发现,冬凌草甲素可显著增加E-cadherin 表达水平,显著降低N-cadherin 及Vimentin 表达水平、迁移细胞数、侵袭细胞数、黏附细胞数,该结果与前人研究结果相一致,这表明冬凌草甲素能通过增加E-cadherin 表达,降低N-cadherin 及Vimentin 表达来抑制A375 细胞的EMT,以此达到抑制肿瘤转移的目的,提示冬凌草甲素有作为黑色素瘤靶向治疗药物的潜能。
miRNA 通过与靶mRNA 的3’UTR 结合来诱导mRNA 的翻译抑制或降解,已成为各种真核生物中基因表达的有效调节剂,并且已被证实是黑色素瘤发生发展的关键调节因子,参与调控肿瘤的EMT 过程[18]。 原发性皮肤黑色素瘤中miR-200c 表达下调预示患者预后不良[19]。 上调miR-200c 的表达可通过抑制E 盒结合锌指蛋白1 和Vimentin 表达来抑制乳腺癌MDA231 细胞迁移及EMT[20]。 本研究发现,EZH2 是miR-200c 的潜在靶基因。 已有研究表明,EZH2 在黑色素瘤中表达异常上调,促使肿瘤的生长方式更具侵略性、恶性程度更高、预后更差[21]。miR-200c 表达沉默可促进EZH2 的表达,从而促进HCC 细胞的致瘤性[22]。 本研究发现,本研究发现,冬凌草甲素可显著增加miR-200c 表达水平,降低EZH2 表达水平;miR-200c 过表达可显著降低A375细胞中N-cadherin 及Vimentin 表达水平、迁移细胞数、侵袭细胞数、黏附细胞数,增加E-cadherin 表达水平,与前人研究结果相似,该结果表明miR-200c过表达可显著抑制A375 细胞EMT 发生,提示,miR-200c/EZH2 轴有作为黑色素瘤潜在治疗靶点的可能。 除此之外本研究还发现,miR-200c 表达沉默则可逆转冬凌草甲素对A375 细胞EMT 的抑制,上述结果表明,冬凌草甲素能够增加E-cadherin 表达,降低N-cadherin 及Vimentin 表达,以此对A375 细胞EMT 起到抑制作用,该机制可能与其促进miR-200c表达、降低EZH2 表达有关。
综上,冬凌草甲素可能通过促进miR-200c/EZH2 轴来增加E-cadherin 表达,降低N-cadherin及Vimentin 表达,以此抑制A375 细胞的EMT 过程,从而达到抑制肿瘤侵袭和转移的目的。 本研究不仅为黑色素瘤治疗靶点的寻找提供依据,还为冬凌草甲素在裸鼠体内抑制A375 肿瘤侵袭和转移或小鼠体内对抑制黑色素瘤侵袭和转移的研究提供基础。

