生长猪结肠炎腹泻及其日粮调控措施
■徐运杰 苏双良 刘曰清 邓 敦 孙丙勇
(1.山东和美集团有限公司,山东 惠民 251700;2.唐人神集团股份有限公司,湖南 株洲 412000;3.滨州市农业技术推广中心,山东 滨州 256600)
复合结肠炎腹泻(colitis-complex diarrhea,CCD)是一种由结肠炎症引起的腹泻,通常发生在断奶后4~16周龄的生长期。CCD对养猪业来说是一个挑战,因为它与治疗性抗生素的大量使用以及养猪场的生物安全和经济成本有关。CCD可能由饲料因素、管理或多种病原体引起(如猪痢疾短螺旋体、伤寒沙门氏菌、大肠杆菌、胞内劳森菌和猪鞭虫)。受CCD 影响的猪饲料转化效率降低、生长速度减慢、死亡率提高,并增加对其他疾病的易感性。从致病原因来说,CCD通常分为两类:①由一种或多种特定病原体引起的特异性结肠炎(specific colitis,SC);②非特异性结肠炎(non-specific colitis,NSC),主要由日粮因素引起,而未涉及已识别的病原体。由于生长猪的CCD 是一种多因素疾病,因此更好地了解其病因有助于促进预防和治疗策略。因此,文章详细论述了与CCD有关的病原体和日粮因素,并提出用于判定CCD 的生物标记物,旨在预防或减轻6 周龄以上生长猪CCD,从而提高生猪养殖的经济效益,降低抗生素的终端使用量。
1 结肠上皮的功能
1.1 结肠离子交换
CCD是一种多因素疾病。因此,了解结肠中的离子吸收和分泌机制以及炎症介质对上皮转运功能的影响非常重要。一般来说,正常粪便中Cl-含量较低,Na+和K+含量较高,因为Na+的重吸收和K+的分泌(主动和被动)在结肠中发生。正常粪便中Cl-含量低的原因是结肠中产生的短链脂肪酸(SCFA)可以替代Cl-[1]。在结肠中,Na+通过SCFA 的刺激作用和远端结肠上皮Na+通道对醛固酮的敏感性被吸收,以及在近端结肠中与Cl--HCO3-平行的Na+-H+交换,负责电中性Na+-Cl-的吸收。SCFA 是结肠管腔中的主要阴离子,有助于通过顶端Na+-H+交换、Cl-SCFA 交换和SCFA-HCO3-交换吸收Na+,这种类型的Na+吸收不受环腺苷一磷酸(cAMP)的阻碍[2]。次级信使[如cAMP、环鸟苷一磷酸(cGMP)、细胞内Ca2+浓度和神经体液物质],可以影响Na+-H+交换基因的表达,如钠氢交换因子3(NHE3),后者参与Na+的中性吸收[3]。然而,结肠中增加的黏膜cAMP 和细胞内Ca2+浓度可抑制细胞顶端Na+-H+和Cl--HCO3-交换并减少Na+和Cl-的吸收,从而降低了吸水率[2]。
在动物研究中,发现一些细菌病原体,如鼠伤寒沙门氏菌、痢疾志贺菌毒素Ⅰ型和空肠弯曲杆菌,可以增加细胞内Ca2+浓度,从而抑制Na+-H+交换基因NHE3 的表达,并刺激Na+和Cl-的过度分泌[3]。因此,Na+吸收障碍和Ca2+分泌刺激可导致腹泻。由于病原体首先刺激肠神经系统,然后增加神经递质的释放,最终促进Ca2+的分泌,因此细胞内Ca2+的过度分泌可能是微生物发病机制的第三级效应[4]。在病原体或饲料诱导的炎症介质破坏结肠黏液层后,抑制Na+和Cl-的吸收,刺激Cl-的过度分泌,管腔中离子水平升高。因此,定量分析腹泻猪粪便中Cl-的含量可以作为判定结肠炎的一个重要生物指标。
1.2 细胞因子与管腔功能
细胞因子是一种小肽分子,在调节上皮细胞、内皮细胞和成纤维细胞产生的免疫和炎症反应中起着重要作用。干扰素-γ(IFN-γ)等细胞因子可直接改变上皮紧密连接,增加跨上皮通透性[5]。在发炎的结肠中,细胞因子,如白细胞介素(IL-1β)、IFN-γ和肿瘤坏死因子-α(TNF-α),干扰Na+和Cl-吸收,影响水吸收,是导致粪便含水量增加的罪魁祸首,这些细胞因子在结肠黏膜中的过度表达也会导致黏膜损伤和功能障碍,从而导致腹泻[6]。因此,管腔中离子水平的增加会以两种不同的方式干扰吸收和分泌平衡并导致腹泻:①通过诱导不平衡电荷进一步增加离子的分泌;②通过增加细胞外渗透压,导致更多的水从肠细胞向肠腔扩散。
除了离子转运外,肠上皮通过肠细胞及其环绕的紧密连接发挥屏障功能,从而限制管腔内容物被动流入血液和淋巴管,反之亦然。结肠对紧密连接的限制高于小肠,并且这种限制从近端到远端结肠逐步增加。在克罗恩氏病(Crohn's disease,CD)患者中,炎症肠段上皮的特征是紧密连接链减少、链断裂以及紧密连接蛋白的含量和组成发生改变;在溃疡性结肠炎(ulcerative colitis,UC)患者中,由上皮细胞凋亡上调以及claudin-2显著增加引起的微侵蚀是早期上皮渗漏的主要原因[7]。可见,UC的黏膜炎症通过改变紧密连接增加结肠上皮的通透性,这可能是结肠炎症引起腹泻的原因之一。
1.3 黏蛋白
除了上皮完整性和共生细菌的存在外,非免疫性肠道屏障是由黏液产生的。黏蛋白是形成凝胶的高分子量糖蛋白,由杯状细胞合成和分泌,也是肠道屏障功能的重要特征。在肠道中,黏蛋白2(MUC2)是主要的分泌型黏蛋白,是结肠黏液层的主要结构成分。杯状细胞干扰黏蛋白的合成和分泌,以响应肠黏膜的病理生理改变,导致黏液凝胶的变化。在没有炎症的情况下,黏液层厚约700 μm,而暴露于特定的生物活性因子,包括激素、炎症介质和微生物因子[如脂多糖(LPS)、鞭毛蛋白A和脂磷壁酸],可上调黏蛋白的产生,特别是MUC2[8]。黏蛋白(如MUC5AC 和MUC4)的上调以及杯状细胞的黏液高分泌也被证明与上皮炎性疾病有关[9]。
2 特异结肠炎和非特异性结肠炎
炎症是机体对于刺激的一种防御反应,表现为红、肿、热、痛和功能障碍。结肠炎是指各种原因引起的结肠炎症性病变,是一种复杂的生物防御机制抵御有害刺激的结果。当结肠炎症反应超出了危及管腔完整性的程度,则可能通过增加肠道通透性并损害其吸收功能而导致腹泻。腹泻是结肠炎急性期出现的一种非特异性症状。这类腹泻通常为非出血性(严重情况下为出血性)黏液性腹泻,且在断奶后4~16周龄生长猪发炎的结肠中有中性粒细胞浸润[10]。
然而,在小猪中(例如在保育和断奶后阶段),腹泻的主要原因是由F4 和F18 型菌毛的肠毒素性大肠杆菌引起的[11]。如果上皮细胞的屏障功能因上皮细胞的丢失或紧密连接的破坏而受损,则会诱发CCD;在这种情况下,血管和淋巴管中的静水压力将导致水和电解质吸收减少;黏液和蛋白质,在某些情况下,还有红细胞和白细胞在管腔内积聚,发生渗出性腹泻,排泄物中炎症产物增加。与小肠不同,结肠的吸收功能与上皮间叶表面有关,而不是与绒毛有关,隐窝的未成熟上皮细胞与小肠一样发挥分泌功能。结肠炎诊断的瓶颈是死后病变的检查和结肠上皮的组织学检查(苏木精和伊红染色)。
2.1 特异性结肠炎
特异性结肠炎是指由一种或多种特定病原体引起的结肠炎症。表1简要介绍了常见形式的SC。
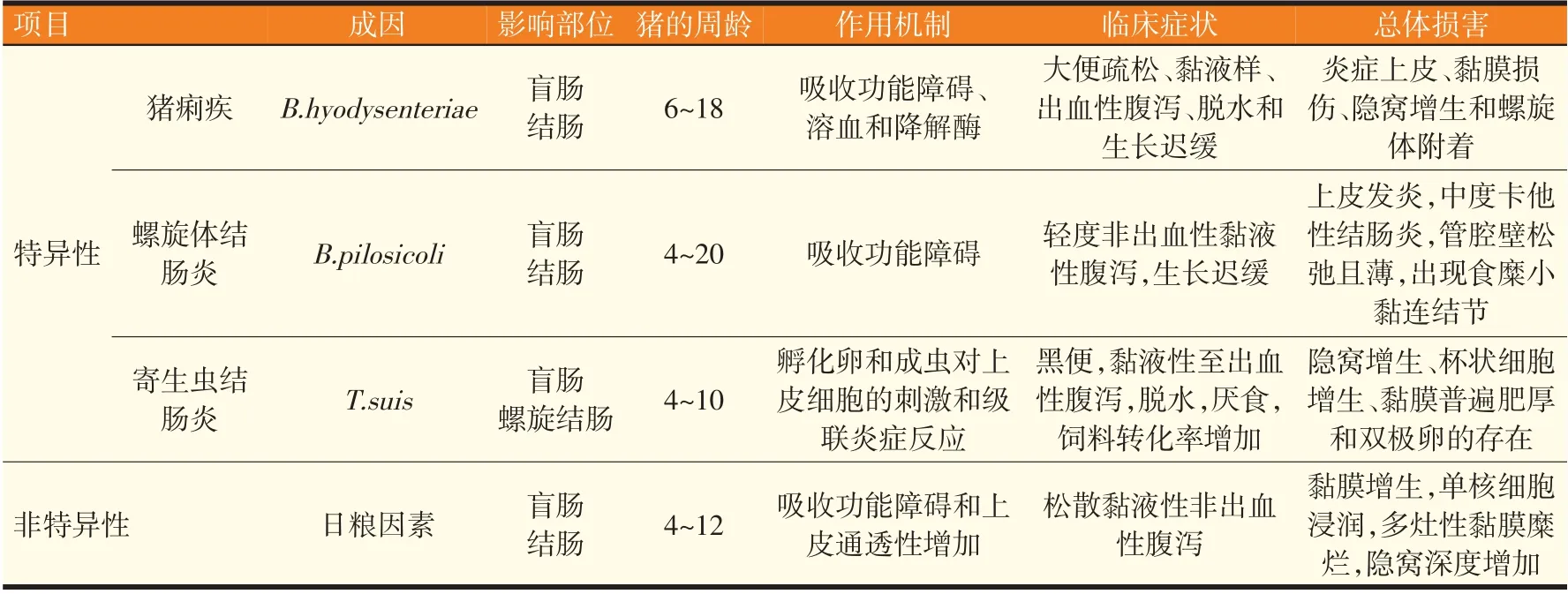
表1 生长猪常见的CCD
2.1.1 猪痢疾
猪痢疾(swine dysentery,SD)是一种由猪痢疾短螺旋体(B.hyodysenteriae)引起的严重的黏液出血性腹泻性结肠炎。以前称为猪痢疾密螺旋体(Treponema hyodysenteriae)和猪痢疾蛇形螺旋体(Serpulina hyo⁃dysenteriae),一种革兰氏阴性和鞭毛厌氧螺旋体[12]。大肠中丰富的杯状细胞(作为基质和营养来源)和厌氧环境共同为猪痢疾短螺旋体创造了有利的环境。猪痢疾短螺旋体在大肠(盲肠和结肠)中的定植导致细菌毒性因子(如溶血素和蛋白酶、降解酶和炎症因子)溶解黏膜细胞。据报道,细菌蛋白酶通过使刷状缘的低聚糖酶失活而使碳水化合物吸收不良,同时,肠壁的损伤也有助于其他病原体的增殖[13]。SD 发生在6~18 周龄的猪身上,第一个临床症状是排出水样或半固体粪便,进而发展为带有大量黏液和不同数量血液的腹泻粪便。从生理学上讲,SD还与脱水、酸中毒和高血钾症有关,严重时还会导致死亡。因此,由于吸收功能的破坏,酸中毒和血清K+的增加常被用作SD的诊断因子。
猪痢疾短螺旋体与产生细胞毒性溶血素有关,溶血素作为一种毒性决定因子,与其他厌氧结肠细菌(如坏死梭杆菌或普通拟杆菌)同时存在,可协同促进生长猪SD 的发生[12]。具有严重SD 临床症状的猪的结肠杯状细胞,MUC2 黏蛋白水平和MUC5AC黏蛋白的从头表达显著增加,并增加猪痢疾短螺旋体与上皮黏液的结合能力[14]。这表明由猪痢疾短螺旋体诱导的结肠黏蛋白生成增加等形态学变化是通过增加病原体附着的结合位点促进进一步感染的机制。因此,结肠中MUC2 表达水平的增加以及随后粪便中MUC2 水平的升高可能是判定和诊断结肠炎症的另一个重要生物标记物(见表2)。然而,在感染胞内劳森菌的猪的隐窝细胞中,编码MUC2 的基因显著下调,这是一种专性的细胞内革兰氏阴性微需氧病原体,可感染回肠上皮细胞[9]。因此,猪结肠黏蛋白表达变化的特征可以被认为是炎症性肠道疾病的诊断工具,并可区分回肠炎和结肠炎。

表2 与结肠炎症相关的生物标记物
另外,由于葡萄糖、半乳糖和氨基酸与Na+协同转运到结肠细胞中,它们会因SD而在肠腔中积聚,从而引起渗透压梯度变化,更多的水分扩散,感染猪的腹泻进一步加剧。由于SD 对小肠没有破坏作用,为了防止病猪脱水,口服葡萄糖电解质补充液将是恢复SD相关细胞外液流失的一种实用方法[22]。
2.1.2 螺旋体结肠炎
螺旋体结肠炎或猪结肠螺旋体病通常影响4~20 周龄的生长猪,临床症状通常在混群并将饲料改为生长猪饲料或颗粒饲料后10~14 d 出现。短螺旋体(B.pilosicoli)是螺旋体结肠炎的致病病原体,其作用方式与B.hyodysenteriae对结肠细胞吸收功能的影响相同,但组织病理学损伤较轻,且以轻度非出血性腹泻为主,有时出现水便和黏液样粪便,剖检可见结肠壁松弛、变薄,肠管充满水和轻微黏液,肠黏膜轻度红肿,甚至出现脓斑,黏膜表面覆盖着小的黏附性食糜结节,镜检表现为轻度至中度卡他性结肠炎,表面上皮糜烂,结肠上皮螺旋体定植[23]。B.pilosicoli一端附着在结肠上皮上,并以与黏膜和固有层相关的原生动物结肠小袋虫(Balantidium coli)联合感染为特征,引发中性粒细胞胞外分泌和隐窝细胞有丝分裂指数增加。
LPS是革兰氏阴性细菌外膜的一部分,可诱导炎症反应。短螺旋体LPS含有10~16 ku的脂质A-糖核心,这是与其他种类LPS 的主要区别,并且推测这些由B.hyodysenteriae产生的脂多糖参与了结肠损伤。体内研究表明,由于促炎细胞因子(如TNF-α、IL-1β和IL-6)的刺激增加,给予LPS 的猪出现急性期反应(APR)和肝脏产生急性期蛋白,例如CRP、HP 和pig-MAP[15]。因此,血清中LPS、CRP、HP 和pig-MAP 的测定值也可作为判定结肠炎的生物标记物。
2.1.3 寄生虫性结肠炎
猪鞭虫可在室内和室外生产中感染幼猪和生长猪,引起盲肠和螺旋结肠的炎症,导致严重黏液性至出血性腹泻、脱水、厌食、增重减少和饲料系数增加。寄生虫的卵通过受感染动物的粪便传播,一旦被采食,它们可以通过消化道传播,在小肠和盲肠中,幼虫孵化并通过远端回肠、盲肠和结肠的李氏腺(Lieberkühn)隐窝穿透黏膜[24]。成虫除了通过大量释放一氧化氮(NO)和上调巨噬细胞精氨酸酶活性诱导受感染猪的免疫抑制特性外,还具有高度的级联炎症反应能力。异常情况下过量产生NO 会导致结肠炎症[25]。预防虫卵粪口传播的卫生措施包括定期清除粪便和有机碎屑,一旦感染,可使用驱虫药进行治疗。
2.2 非特异性结肠炎
当结肠炎无法确定特定病原体时就被称为非特异性结肠炎(NSC)。NSC 主要影响4~12 周龄生长猪,影响率达40%~80%。NSC 的特征是亚急性、黏膜增生、单核细胞浸润、多灶性黏膜糜烂、隐窝深度增加和生长速度减慢,主要原因是吸收功能受损和腹泻引起脱水。据报道,结肠相关淋巴组织增生和肠系膜淋巴结增生(粪便样本中未检测到任何相关病原体)被视为NSC 的总体病理学特征[26]。如前所述,由于级联炎症反应,SC 和NSC 均诱导结肠的形态学改变。炎症产物钙卫蛋白和乳铁蛋白是从活化的中性粒细胞中提取的蛋白质,由于它们在粪便中非常稳定,并且可以通过定量ELISA 检测,因此它们被认为是人类结肠炎的廉价和非侵入性生物标记物[17]。然而,采用这种方法鉴定猪结肠炎的研究很少。
3 日粮因素与非特异性结肠炎之间的关系
关于NSC 的确切病因和流行病学了解甚少。然而,一些日粮因素似乎与NSC 的发生有关,如VC、VE、谷胱甘肽、有机硒、泛醌、多酚、β-胡萝卜素和必需氨基酸不足,蛋白质水平、可溶性非淀粉多糖(NSP)、抗性淀粉(RS)和胰蛋白酶抑制剂含量过高等(见表3)。这些日粮因素也可能促进大肠的致病性感染,并协同引发SC。据报道,NSC 在喂食高营养浓度日粮的快速生长猪中更为普遍[27]。为了从色氨酸生物合成烟酸,日粮中需要有足够的核黄素、VB6和铁。尿中N-甲基烟酰胺的排泄是烟酸缺乏的生化指标。据报道,在日粮中补充足够的烟酸(≥15 μg/g 饲料)可以预防NSC 的发生,也可以逆转病猪的状况[10]。

表3 与CCD相关的日粮因素
3.1 日粮蛋白质与NSC
对患有NSC 的猪的结肠进行组织学检查,显示微绒毛丧失、隐窝深度增加和表面上皮细胞凋亡,这可能是由生物胺、NH4+、吲哚和酚的浓度增加所致,而这些副产物都来源于细菌发酵未降解的日粮蛋白质。通过粪便样本的回收率分析,它们可被视为蛋白质发酵诱导的结肠炎的潜在生物标记物。Wu 等[18]研究表明,将5 周龄猪的日粮粗蛋白含量从17%提高到23%,发现肠道紧密连接基因(如闭锁连接蛋白-1 和闭合蛋白)的表达减少,导致肠道通透性增加和腹泻;NSC 的发生率也与日粮中粗蛋白含量增加导致远端结肠中促炎细胞因子IL-1β、IFN-γ和囊性纤维化跨膜电导调节因子(CFTR)的表达增加有关;喂食含23%粗蛋白日粮的仔猪中,结肠上皮通透性增加,Cl-分泌过多,结肠末端食糜中Cl-和CFTR 浓度增加;血浆尿素氮水平升高。因此,定量分析粪便样本中Cl-和CFTR 的含量可作为蛋白质相关NSC 的生物标记物,血浆尿素氮水平是判定结肠中蛋白质是否过度发酵的另一个间接指标。另外,猪近端结肠中炎症细胞因子如IL-1β和IL-6 的基因表达上调也可通过改变紧密连接蛋白和破坏上皮完整性而增加肠上皮通透性[28]。这反映了这些细胞因子与结肠炎症的发生密切相关,可作为猪NSC 和SC 的生物标记物。
3.2 日粮纤维与NSC
尽管结肠中纤维发酵通常被认为对宿主动物具有积极作用,但大肠中膳食纤维(DF)发酵的程度对NSC 的发展有影响。例如,细菌在结肠中发酵纤维素和不溶性阿拉伯木聚糖与NSC 的发生有关。DF 对NSC 发展的影响在很大程度上取决于其物理化学性质(如木质化程度和溶解性)。因为不溶性纤维可通过刺激结肠蠕动,从而减少消化剩余物在大肠中的平均停留时间,减少发酵、吸收和微生物群的总体多样性[29]。日粮中的可溶性纤维与更高级的结肠发酵和更多的微生物定植有关。虽然其确切的潜在机制尚不清楚,但据推测,可溶性纤维可以增加大肠中食糜的黏度,为非共生微生物提供底物和附着基质[30]。
另外,NSC 的发生与日粮中非淀粉多糖(NSP)的含量存在密切关系。有研究表明,日粮中高NSP和低聚糖会导致大肠中的细菌发酵增加,为B.hyodysenteri⁃ae和B.pilosicoli在4周龄仔猪肠道中的增殖提供了最佳环境[23]。另外,饲喂NSP 含量高的日粮,通过减少可用于微生物生长的底物和回盲口大肠菌群的多样性,从而导致机体对“入侵病原体”的抵抗力降低[31]。日粮中外源添加特异性酶,例如β-木聚糖酶、β-葡聚糖酶和它们的组合,可提高NSP在前肠中的消化利用率,在控制6周龄猪NSC的发生方面有好处。
3.3 颗粒饲料与NSC
颗粒饲料是另一种与NSC 发病率增加相关的日粮因素,制粒过程中的热处理被认为是结肠炎发生的病因因素[32]。猪是单胃动物,依赖一系列内源性和外源性酶进行饲料消化。制粒过程中施加的热量可能完全或部分地使饲料成分中存在的酶失活[33]。这可能导致某些营养素(例如蛋白质)在小肠中的消化利用率降低,从而为大肠中细菌发酵提供了底物。这可以推断,通过为病原体繁殖提供所需的底物,日粮因素在CCD 的发展和早期断奶后腹泻的发生中起着至关重要的作用。
4 预防或缓解结肠炎的营养措施
4.1 多不饱和脂肪酸和多酚
Pistol等[19]报道,日粮中添加8%葡萄籽[含有高剂量多不饱和脂肪酸(PUFAs)和多酚],通过抑制丝裂原活化蛋白激酶(MAPKs)、降低核因子卡巴B(NF-κB)基因和蛋白质表达,改善了右旋糖酐硫酸钠(dextran sulfate sodium,DSS)攻击的3 周龄猪的结肠炎症,与对照组相比,显著减少促炎细胞因子和趋化因子的产生。PUFAs对结肠炎症具有调节作用,是因为ω-3和ω-6 PUFAs 可以减少嗜中性粒细胞在肠道血管系统和上皮间的迁移,抑制促炎性细胞因子过度表达,阻止促炎细胞因子的释放。由B.hyodysenteriae诱导结肠炎之前,在猪的日粮中补充共轭亚油酸,可减少黏膜损伤,并将细胞因子IFN-γ和IL-10 维持在与对照组相同的水平,表明ω-6 PUFAs 对结肠炎(例如SD)的发病率具有明确的预防作用[34]。
葡萄籽多酚和葡萄渣提取物对猪的抗炎作用归因于它们对NF-κB 和核因子红细胞2 相关因子2(Nrf2)的调节能力,它是一种氧化还原敏感转录因子,调节多种抗氧化反应元件,保护身体免受氧化应激[16,35]。活性氧(ROS)的积累和抗氧化剂的缺乏可引起氧化应激,导致猪的肠道组织受损,细菌易位和屏障功能障碍。炎症结肠的巨噬细胞和上皮细胞中NF-κB的激活是对增加的IL-1β、TNF-α、ROS和细菌LPS的反应,反映了NF-κB在炎症起始过程中的重要性。由于TNF-α、病原体黏附和吞噬细胞激活等因素可导致ROS过度产生和氧化损伤,因此评估患有腹泻的生长猪的氧化应激也可作为确定结肠炎症反应的一种方法。
4.2 蛋白质和必需氨基酸
如前所述,未消化日粮蛋白质在结肠中发酵提高了猪NSC和CCD发生的风险。据报道,将日粮粗蛋白从23%降低到19%,可降低有毒微生物代谢产物(如NH4+)的含量,维持3 周龄猪的肠道健康[36]。其实,降低日粮粗蛋白水平,外源添加必需氨基酸,对体重6~15 kg 仔猪的生长性能没有影响。例如,必需氨基酸的苏氨酸参与维持肠道屏障功能,因为它是合成肠道糖蛋白(如黏蛋白MUC2)的前体。结肠炎症与黏蛋白产生增加有关,因此,对MUC2 生物合成前体的需求会增加。在DSS 诱导的结肠炎大鼠模型中,增加必需氨基酸(如苏氨酸、半胱氨酸和脯氨酸)的摄入,增加了炎症期间黏蛋白的合成[37]。综上所述,对啮齿动物的研究表明,黏蛋白具有直接的抗菌功能,并且能够调理微生物,有助于肠道的清除。Nichols 等[38]研究了肠腔苏氨酸浓度对仔猪肠黏膜蛋白和黏蛋白合成的影响,结果表明,将苏氨酸水平提高至56 mg/g 总氨基酸(比要求量高18 mg),可显著增加6 周龄猪肠道中黏蛋白的从头合成。
4.3 膳食纤维
不管上述提到的日粮DF与结肠炎之间的关系如何,SCFA对结肠上皮的有益作用不容忽视。SCFA在结肠中的抗菌作用强度与SCFA 的绝对量无关,而是与未解离SCFA 分子的比例有关。该比例随pH 降低(pH<6.0)而增加,随pH 升高(pH 7.0)而减少,SCFA的抗菌活性也是如此。大肠中的DF 发酵可促进肠道成熟,为结肠黏膜提供SCFA,并阻止病原菌黏附到肠道黏膜。在结肠厌氧条件下,DF 由形成SCFA的微生物进行发酵。SCFA 可通过降低肠道pH 而产生杀菌作用。但是,Siba 等[39]认为,通过给猪喂食高消化率的饲料,增加了结肠食糜的pH 并降低了总SCFA 含量,将减少B.hyodysenteriae定植的机会,降低SD 结肠炎的发病率。Pluske 等[40]通过营养对猪几种主要肠道细菌性疾病影响的试验,进一步证实了饲喂高度易消化的日粮,可以减少一些特定肠道细菌的增殖。
结肠细胞的能源物质除了血管来源的葡萄糖和谷氨酰胺外,还可以代谢SCFA。SCFA 对结肠内的血液流动、液体和电解质吸收具有刺激作用,在维持肠道内环境稳定方面发挥重要作用,并构成猪可用能量的相当一部分,占身体能量需求的11%~25%。其中,丁酸尤其重要,它是结肠细胞的首选底物,有助于维持其正常表型,并具有选择性抗菌作用。结肠细胞对丁酸的利用是一种氧化反应,在结肠上皮细胞中消耗O2,产生大量酮体(乙酰乙酸和β-羟基丁酸)和CO2。丁酸盐通过促进消化酶的分泌以及消化酶的基因表达,因此,被称为结肠消化和营养吸收的促进剂。如前所述,SD 和螺旋体结肠炎导致肠腔中Na+和Cl-分泌增加,而SCFA 可以通过增加Cl-的重吸收以及顶端Na+-H+和Cl--SCFA 交换触发Na+吸收来增强管腔的吸收功能。因此,通过纤维发酵增加结肠丁酸盐产量和减少结肠微生物群的蛋白质供应是维持猪结肠健康、减少炎症和腹泻的有力策略。
4.4 抗性淀粉
抗性淀粉(resistant starch,RS)是直链淀粉与支链淀粉比例高、小肠消化率低的淀粉部分,它是一种大肠高度可发酵的纤维来源。给猪饲喂抗消化木薯淀粉(对小肠消化具有高达50%的抵抗力)可提高结肠中SCFA水平,增加健康肠道相关产丁酸菌Faecali⁃bacterium prausnitzii的数量,并抑制大肠杆菌等致病菌的数量[41]。总的来说,日粮中适当的RS含量,能够调节肠道微生物群、肠腔结构、肠道生物化学、细胞信号和循环炎症介质。
5 总结
综上所述,生长猪结肠炎是一种多因素疾病,其特征是结肠发炎、发炎部位中性粒细胞浸润、上皮完整性受损和肠道通透性增加,通常与腹泻有关,并导致所谓的CCD。尽管CCD 的确切病因尚不清楚,但是,B.hyodysenteriae、B.pilosicoli、T.sui和日粮因素是诱发猪CCD 的主要原因。所以,CCD 分为SC 和NSC。实际生产中,调整日粮营养策略有助于预防和减轻CCD,包括降低粗蛋白水平、设置适宜的膳食纤维水平和各种纤维间比例、颗粒饲料和粉料交替使用、提高天然抗氧化剂水平、添加丁酸盐和酶制剂、平衡脂肪酸(ω-3和ω-6 PUFAs)等,同时保持必需氨基酸和条件性必需氨基酸(如Lys、Met、Cys、Thr、Trp、Arg、Gln和Glu)的充足。

