不同错配修复蛋白检测组合对子宫内膜癌患者预后判断的价值及意义
郭璐璐 王翔宇 付广明 李贝贝 王蓁
(青岛大学附属医院,山东 青岛 266071 1 妇科; 2 病理科)
子宫内膜癌是一组上皮性恶性肿瘤,近年来发病率呈上升趋势并有年轻化倾向。由于子宫内膜癌的异质性大,传统组织学分类有时不能完全满足临床对于预测患者预后和精准治疗的需求[1]。临床上根据其分子特征将子宫内膜癌分为POLE突变型、微卫星不稳定性(MSI)、低拷贝型和高拷贝型[2]。有效对各类型子宫内膜癌的分子生物标志物进行正确识别,有利于采取针对性的措施对患者进行治疗,并改善患者预后。微卫星是由单核苷酸或多核苷酸重复序列组成的DNA序列,重复单位的拷贝数决定了微卫星的长度[3]。MSI是由错配修复系统缺失导致的[4]。错配修复功能的缺失,致使基因组中短串联重复序列改变无法及时修复,大量原癌基因或抑癌基因的突变不断累积,致细胞调控失衡和肿瘤发生[5]。目前检测MSI的方法主要有PCR法和免疫组化法[6]。免疫组化法是指通过检测错配修复蛋白(MMR)系统中4种MMR,如MLH1、MSH2、MSH6和PMS2表达情况来判定微卫星状态。免疫组化法较PCR法操作简单、成本低,在临床中应用比较广泛。本研究通过免疫组化方法检测不同MMR组合判定肿瘤组织中MSI情况,并进一步探讨MSI对子宫内膜癌患者预后的影响,以期能够降低检测成本,为基层医院及偏远山区对子宫内膜癌患者预后的判断及治疗提供新的思路。
1 对象与方法
1.1 研究对象
收集2017年1月—2019年12月于青岛大学附属医院妇科行手术治疗的子宫内膜癌患者144例的临床资料及病理标本。患者纳入标准:①诊断为原发性子宫内膜癌的患者;②具备手术治疗指征的患者;③术前未经过放、化疗治疗及内分泌治疗的患者;④临床病理资料完整的患者。收集所有患者的临床资料,包括年龄、BMI、肿瘤组织分化程度、肿瘤肌层浸润深度、肿瘤病理分期、雌激素受体(ER)与孕激素受体(PR)免疫组化检测结果以及盆腔淋巴转移情况等。
1.2 免疫组化法检测患者标本中MLH1、MSH2、MSH6和PMS2蛋白表达情况
采用免疫组化法检测每例标本当中的MLH1、MSH2、MSH6和PMS2蛋白表达情况,严格按照试剂盒说明书要求的步骤来进行操作。按照不同的MMR检测组合进行分组,检测MLH1、MSH2定义为A组,检测MSH6、PMS2定义为B组,同时检测MLH1、MSH2、MSH6和PMS2定义为C组。当蛋白呈阳性时,肿瘤细胞核呈棕褐色或者淡黄色染色[7-8],整张切片>10%目标细胞阳性即判定为该切片阳性,根据各蛋白阳性结果不同,将患者诊断为微卫星稳定性(MSS)与微卫星不稳定性(MSI)两种结果。当A组或B组中2种蛋白均呈阳性时为MSS,当其中任意一种蛋白缺失时为MSI;当C组中4种蛋白均呈阳性时为MSS,4种蛋白中其中任意一种蛋白缺失时为MSI。
1.3 统计学方法
应用SPSS 26.0软件进行统计分析。计数资料以例(χ/%)表示,组间比较采用卡方检验或Fisher确切概率法。以P<0.05为差异有统计学意义。
2 结 果
2.1 A组MSI与患者临床特征的相关性
A组免疫组化检测结果显示,MSI患者30例,MSS患者114例,分析显示,MSI与患者的ER、PR表达有关(χ2=7.587、6.935,P<0.05);而与患者的年龄、BMI及肿瘤分化程度、浸润深度、病理分期以及盆腔淋巴结有无转移无关(P>0.05)。见表1。

表1 A组MSI与患者临床特征的相关性[例(χ/%)]
2.2 B组MSI与患者临床特征的相关性
B组免疫组化结果显示,MSI患者28例,MSS患者116例,分析显示MSI与肿瘤组织分化程度及ER、PR表达有关(χ2=6.566~8.765,P<0.05),而与患者年龄、BMI及肿瘤浸润深度、病理分期及盆腔淋巴结转移有无转移无关(P>0.05)。见表2。

表2 B组MSI与患者临床特征的相关性[例(χ/%)]
2.3 C组MSI与患者临床特征的相关性
C组的免疫组化检测结果显示,MSI患者37例,MSS患者107例,分析显示MSI与肿瘤组织分化程度及ER、PR表达有关(χ2=6.774~11.600,P<0.05)。与患者年龄、BMI、肿瘤浸润深度、病理分期、盆腔淋巴结有无转移无关(P>0.05)。见表3。
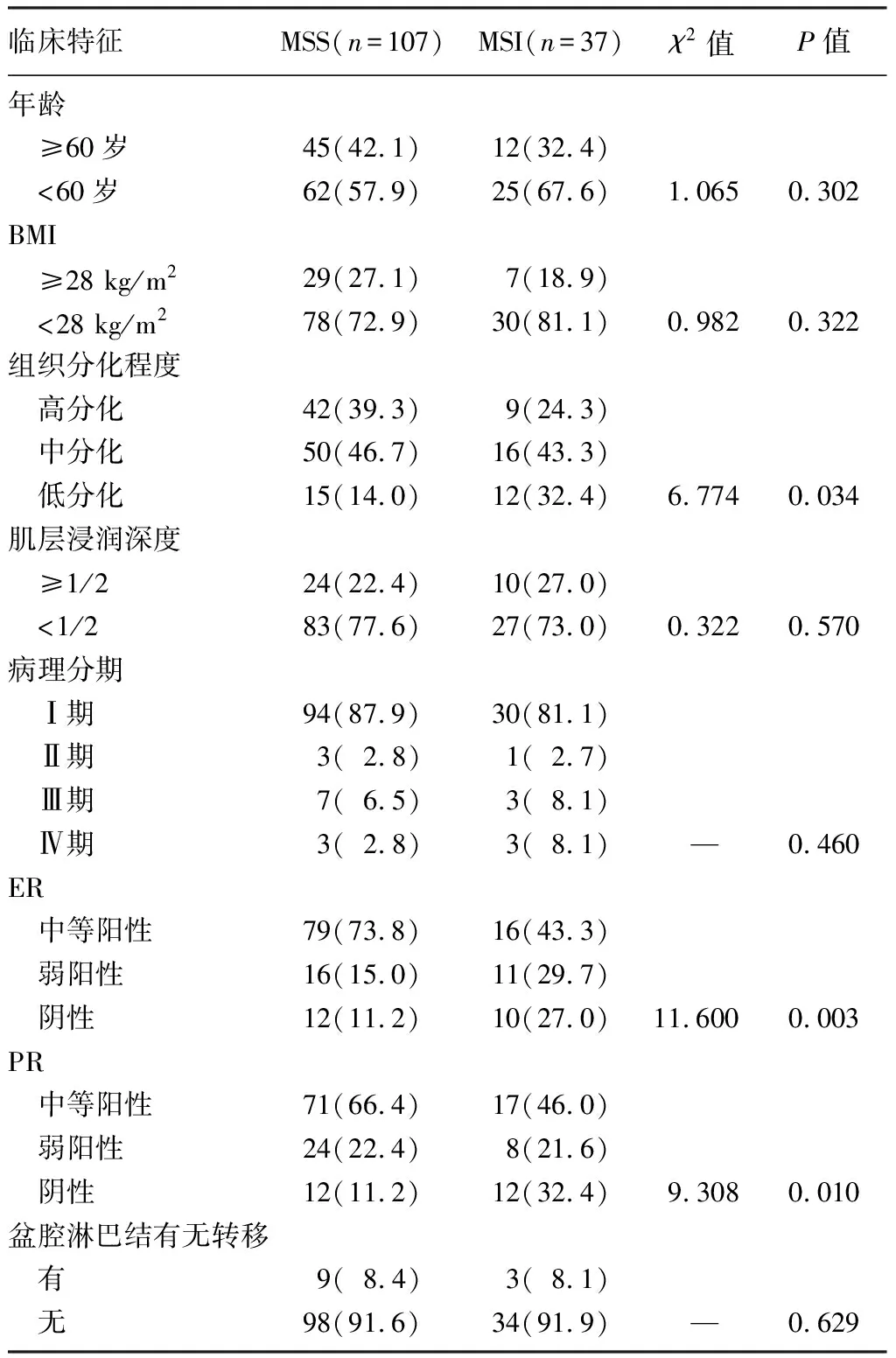
表3 C组MSI与患者临床特征的相关性[例(χ/%)]
3 讨 论
微卫星区是由简单重复序列的核苷酸排列而成,当微卫星区内的短DNA链进行复制时,往往由于DNA聚合酶不能正确地结合DNA母链,以致无法发挥其校对及切除修复等作用,导致错误地复制、转录微卫星区,MMR系统则负责识别和纠正这些错误[9]。MMR系统是一种人体内的安全保障体系,有利于维持遗传物质的完整性和准确性,而当MMR系统出现故障时,即MMR基因突变(缺失、插入等),会导致错配修复功能异常,使微卫星区域的复制、转录错误不能被及时识别、纠正,进而导致MSI;同样当原癌基因与抑癌基因突变时,MMR系统未能及时识别与纠正,导致癌突变基因不断累积,以上因素可能会促使肿瘤的发生[10]。
研究表示,临床中大约30%的子宫内膜癌患者表现出MSI,主要是由MLH1启动子的高甲基化或MMR基因的遗传突变导致的[11]。MSI不仅对子宫内膜癌患者的预后产生不良影响,还会上调子宫内膜癌组织中程序性死亡受体配体1(PD-L1)蛋白的表达,因此检测子宫内膜癌组织中的MSI对指导患者进行免疫治疗及评估患者预后等方面均具有重要的意义[12]。
MMR系统在参与DNA修复时,是由多种错配修复蛋白共同参与完成的,错配修复蛋白主要分为MutS群和MutL群,其中MutS群主要由MSH2、MSH3和MSH6等组成,MutL群主要由MLH1、MLH3、PMS1和PMS2等组成。当体内DNA复制出现错误时,MutS群可起到总体识别并进行精准定位的作用,同时可结合MutL群,从而活化核酸酶,进而水解错配的DNA区域[13-14]。
目前用于判断MSI的MMR主要包括MLH1、MSH2、MSH6和PMS2,其中MSH2、MSH6是组成MutS主要蛋白,MLH1、PMS2是组成MutL主要蛋白。在早期研究中,主要利用免疫组化法测定MLH1、MSH2以判定MSI[15-16]。近期,RAFFONE等[17]提出以PMS2和MSH6判断子宫内膜癌组织中的MSI,与检测MLH1、MSH2、MSH6和PMS2的组合判断子宫内膜癌组织中的MSI相比,其准确性以及特异性并无明显差异。2019年相关指南中提出MMR蛋白中PMS2和MSH6的表达分别与MLH1和MSH2明显相关,其中蛋白表达与否受彼此影响,即MLH1的表达缺失通常伴有PMS2的表达缺失,而MSH2的表达缺失通常伴有MSH6的表达缺失[18]。
子宫内膜癌组织病理分期及病理类型相同时,肿瘤分化程度越高,预后越好。本研究结果显示,在B、C两组中MSI与肿瘤组织分化程度有关,且MSI在低分化子宫内膜癌当中占比较大,也进一步反映出MSI对子宫内膜癌预后具有不良影响。
目前对子宫内膜癌患者癌组织进行ER、PR检测已经常规化,当子宫内膜癌组织中ER、PR表达呈阴性时,预示肿瘤恶性程度升高、侵袭性增强等,与ER、PR呈阴性者相比较,ER、PR呈阳性的患者预后较好[19]。本研究结果显示,A、B、C组中MSI与ER、PR表达均有关,且MSI在ER、PR中阴性占比较大,间接反映出MSI对子宫内膜癌患者预后有不良影响。有研究采用PCR法判定出子宫内膜癌组织中MSI,并利用免疫组化法测定组织中ER、PR的表达,结果显示MSI与ER、PR水平有关[20]。以上研究结果与本实验的结果相一致。
本研究通过检测不同MMR组合判定MSI,判断出MSI对子宫内膜癌临床病理特征的影响具有一致性,这与RAFFONE等[17]认为MSH6-PMS2的检测组合判定子宫内膜癌MSI,可以在不降低诊断准确性的情况下降低成本的结论相一致。这一结论为基层医院及偏远地区的临床医师在判断子宫内膜癌预后的基础上,进一步降低医疗成本提供了新的思路。换言之,可以检测其中两种蛋白的组合判定MSI,既为患者节约了医疗成本,又为相关医疗机构减少了成本损耗,具有一定的临床意义和社会经济价值。

