6种杀菌剂对2种草莓炭疽病菌室内毒力测定
唐冬兰 唐泉 蒋立奔 宋芹芹 曹荣祥









摘要:从江苏省南京地区草莓病株上分离的2株炭疽病致病菌,经多基因系统发育分析,确定为胶孢炭疽复合种中的暹罗炭疽菌和果生刺盘孢。为筛选有效防治草莓炭疽病药剂,测定了6种杀菌剂对这2个菌株菌丝生长和分生孢子萌发的抑制活性。结果表明,不同杀菌剂对2种炭疽病菌的抑制效果不同,各杀菌剂在试验浓度下对2种菌的菌丝生长和分生孢子萌发均有不同程度地抑制作用,相对抑制率与药剂浓度呈正相关。根据对病原菌菌丝生长和分生孢子萌发抑制效果的综合表现,75%肟菌·戊唑醇和10%苯醚甲环唑的EC50值在供试药剂中是相对较小的,在推荐使用浓度下对2种病菌相对抑制率均可达80%以上,可作为南京地区草莓炭疽病防治候选药剂。
关键词:草莓;炭疽病;多基因序列分析;杀菌剂;室内毒力测定;抑制作用
中图分类号:S436.68+4 文献标志码: A
文章编号:1002-1302(2022)12-0106-08
收稿日期:2021-08-10
基金项目:江苏省农业科技自主创新资金[编号:CX(20)3017];亚夫科技服务项目[编号:KF(20)1021];江苏现代农业产业技术体系建设项目(编号:JATS[2021]008)。
作者简介:唐冬兰(1983—),女,江苏淮安人,博士,助理研究员,主要从事果树病理学及生物技术研究。E-mail:dofthmlhm@163.com。
通信作者:曹荣祥,副研究员,主要从事草莓栽培与生理研究。E-mail:3060601887@qq.com。
草莓(Fragaria×ananassa Duch.)为蔷薇科(Rosaceae)草莓属(Fragaria)多年生草本植物。因其独特的风味深受消费者欢迎。近年来,我国草莓产业发展迅速,为主产区带来巨大的经济效益和社会效益。但由于品种单一、连作及病菌抗药性等,病害问题日益突出。
炭疽病是草莓生产中最具威胁性的病害之一。草莓整个生长期均可受此病危害,尤以育苗期和促成栽培前期发病最重,最严重时,病菌直接侵染根颈,可导致整个植株萎蔫死亡[1]。目前药剂防治仍是生产上该病最常用且最有效的方法。但国内外研究表明,不同地区发生为害的炭疽病菌种类不尽相同[2-3]。常见的有胶孢炭疽菌[Colletotrichum gloeosporioides (Penz.) Penz. et Sacc.]、尖孢炭疽菌(C. acutatum Simmonds)、草莓炭疽菌(C. fragariae Brooks.)和束状炭疽菌[C. dematium (Pers.) Vuill],其中胶孢炭疽菌被鉴定為多地草莓炭疽病的优势种群[4-5]。事实上,胶孢炭疽菌是包含多个隐存种的复合种[6],但不同隐存种对不同药剂的敏感性差异目前尚未见报道。另一方面,随着杀菌剂使用频率与剂量的不断增加,草莓炭疽病病原菌已对多种杀菌剂产生抗药性。有研究表明,杭州市草莓炭疽病致病菌已存在高比例的多菌灵和乙霉威双抗菌系[7];林婷对浙江省不同地区的草莓炭疽病菌菌株进行室内毒力测定发现,供试68个菌株中有67个对甲基硫菌灵表现出高水平抗药性[8]。
本研究对从南京地区草莓炭疽病病株上分离的2株致病菌,采用多基因系统发育分析进行分子物种鉴定,并选择6种生产上常用且相对低毒低残留的杀菌剂,比较其对2种草莓炭疽病菌的菌丝生长和分生孢子萌发的室内抑菌活性,以期筛选出适用于南京地区草莓炭疽病防治的药剂,从而延缓抗药性的产生,提高药剂使用的针对性,为生产上有效防治草莓炭疽病提供参考。
1 材料与方法
1.1 供试菌株
本研究所用2株草莓炭疽病菌(BT-3-2和BH-3-1),于2020年7月从江苏省南京市设施栽培的草莓炭疽病发病植株上采用组织分离法获得。按照科赫氏法则验证致病性后,菌株于4 ℃下保存于马铃薯葡萄糖琼脂(PDA)培养基斜面上备用。
1.2 菌株分子物种鉴定
挑取适量保存的菌种接入PDA液体培养基中,25 ℃、180 r/min条件下,振荡培养5~7 d,经无菌纱布过滤去除液体培养基,再用无菌水清洗2~3次,将得到的菌丝用无菌滤纸吸干水分,取适量菌丝,加液氮研磨成粉末,用基因组提取试剂盒[DP320,天根生化科技(北京)有限公司]提取基因组总DNA。利用文献中报道的引物扩增各菌株的ITS区、肌动蛋白(actin gene,ACT)、钙调蛋白(calmodulin gene,CAL)和β-微管蛋白(β-tublin gene,TUB2)片段[9]。PCR反应总体积25 μL,内含12.5 μL ×PCR Master Mix(康为世纪生物科技有限公司),引物各0.4 μmol/L,模板DNA 40~50 ng。PCR扩增程序:94 ℃预变性5 min;94 ℃ 变性30 s,退火30 s(不同引物退火温度见表1),72 ℃延伸 90 s,30次循环;72 ℃延伸10 min。PCR反应结束后,取5 μL扩增产物用1%琼脂糖凝胶进行电泳检测。对确定有目的条带的PCR产物送样测序,测序工作交由南京擎科生物科技有限公司完成。
使用DNAStar软件包中的SeqMan序列拼接软件进行序列拼接。从GenBank数据库中下载相关序列(表2),主要是炭疽菌属的序列,将各菌株的DNA片段按ITS-ACT-CAL-TUB2的顺序首尾相连,在MEGA 6.0软件中,对序列进行Clustal W比对,然后进行Model test分析选出最优碱基替换模型,再用最大似然法构建多基因系统发育树,并进行重复1 000次的自展分析[15]。
1.3 供试药剂
共6种供试药剂,分别为250 g/L吡唑醚菌酯乳油[巴斯夫植物保护(江苏)有限公司]、450 g/L咪鲜胺水乳剂(苏州富美实植物保护剂有限公司)、75%肟菌·戊唑醇水分散粒剂(德国拜耳股份公司)、10%苯醚甲环唑水分散粒剂(先正达南通作物保护有限公司)、80%代森锰锌可湿性粉剂[陶氏益农农业科技(中国)有限公司]、70%丙森锌可湿性粉剂(德国拜耳股份公司)。各药剂均用无菌水配制成10 000 μg/mL母液。根据供试药剂的使用说明,以推荐的最高使用浓度为初始浓度,逐步稀释成5个浓度梯度开展试验(表3)。
1.4 不同药剂对病菌菌丝生长的影响
不同药剂对2个菌株菌丝生长的影响采用菌丝生长速率法[16]进行测定。方法为将保存的菌种在PDA培养基上培养3~5 d(25 ℃),待菌落长到合适大小时,用无菌打孔器在菌落边缘切出直径8 cm的菌块,然后将菌块转入含不同浓度药剂的PDA培养基上,25 ℃培养5~7 d,每个处理重复3次。含药培养基的制作为将上述6种药剂的母液依次稀释成一系列浓度,使稀释后的浓度为试验浓度的10倍,再将5 mL药液与45 mL熔化的PDA培养基混匀,分装到3~4个无菌培养皿中,以无菌水作空白对照(CK)。待对照菌落快长满培养皿时,进行统计,采用十字交叉法测量各药剂不同浓度下的菌落直径,取平均值。菌丝生长抑制率=(对照菌落直径-药剂处理菌落直径)/(对照菌落直径-菌饼直径)×100%。
1.5 不同药剂对病菌分生孢子萌发的影响
采用凹玻片法测定不同药剂对2种病菌分生孢子萌发的影响[17]。将保存的菌种,挑取适量接入100 mL PDA液体培养基中,25 ℃、180 r/min振荡培养5~7 d,经无菌纱布过滤去除菌丝,将得到的孢子液在4 000 r/min下离心10 min,去除上清液后用无菌水重悬浮,再离心,重复1~2次,进行镜检、计数、稀释,将孢子悬浮液的浓度调整至1×106个孢子/mL,再用无菌水清洗2~3次;将上述6种药剂的母液依次稀释成一系列浓度,使稀释后的浓度为试验浓度的3倍;配制1.5%葡萄糖溶液,灭菌;将1.5%葡萄糖溶液、菌悬液和药液按体积比1 ∶1 ∶1混匀,以无菌水作空白对照(CK),滴在双孔凹玻片上,置于25 ℃保湿培养,当对照孢子萌发率达到90%以上时(判断孢子萌发标准为芽冠长度超过孢子最大直径长度1/2),对各处理进行拍照,统计不同浓度下的孢子萌发率,并计算孢子萌发抑制率。孢子萌发抑制率=(对照孢子萌发数-处理孢子萌发数)/对照孢子萌发数×100%。
1.6 数据分析
利用DPS 7.5软件对数据进行处理分析,求出毒力回归方程,计算各供试药剂的相关系数(r)和抑制中浓度EC50值,分析比较不同杀菌剂对2种草莓炭疽病菌菌丝生长和分生孢子萌发的抑制作用。
2 结果与分析
2.1 病原菌的多基因分子分析与鉴定
对分离纯化后,经致病性鉴定确定为草莓炭疽病致病菌的2个菌株的ITS、TUB2、CAL和ACT序列进行测序,菌株BT-3-2得到的4个片段长度分别为242、732、535、732 bp,菌株BH-3-1的4个片段长度分别为249、732、536、731 bp。通过MEGA 6.0构建的ITS-TUB2-CAL-ACT多基因系统发育树(图1)可以看出,BT-3-2和BH-3-1分别与已登录的暹罗炭疽菌(C. siamense,ICMP17795)和果生刺盘孢(C. fructicola,ICMP18613)聚在一起,支持率分别为72%、98%。结合形态特征,将供试菌株分别鉴定为胶孢炭疽复合种中的暹罗炭疽菌和果生刺盘孢。
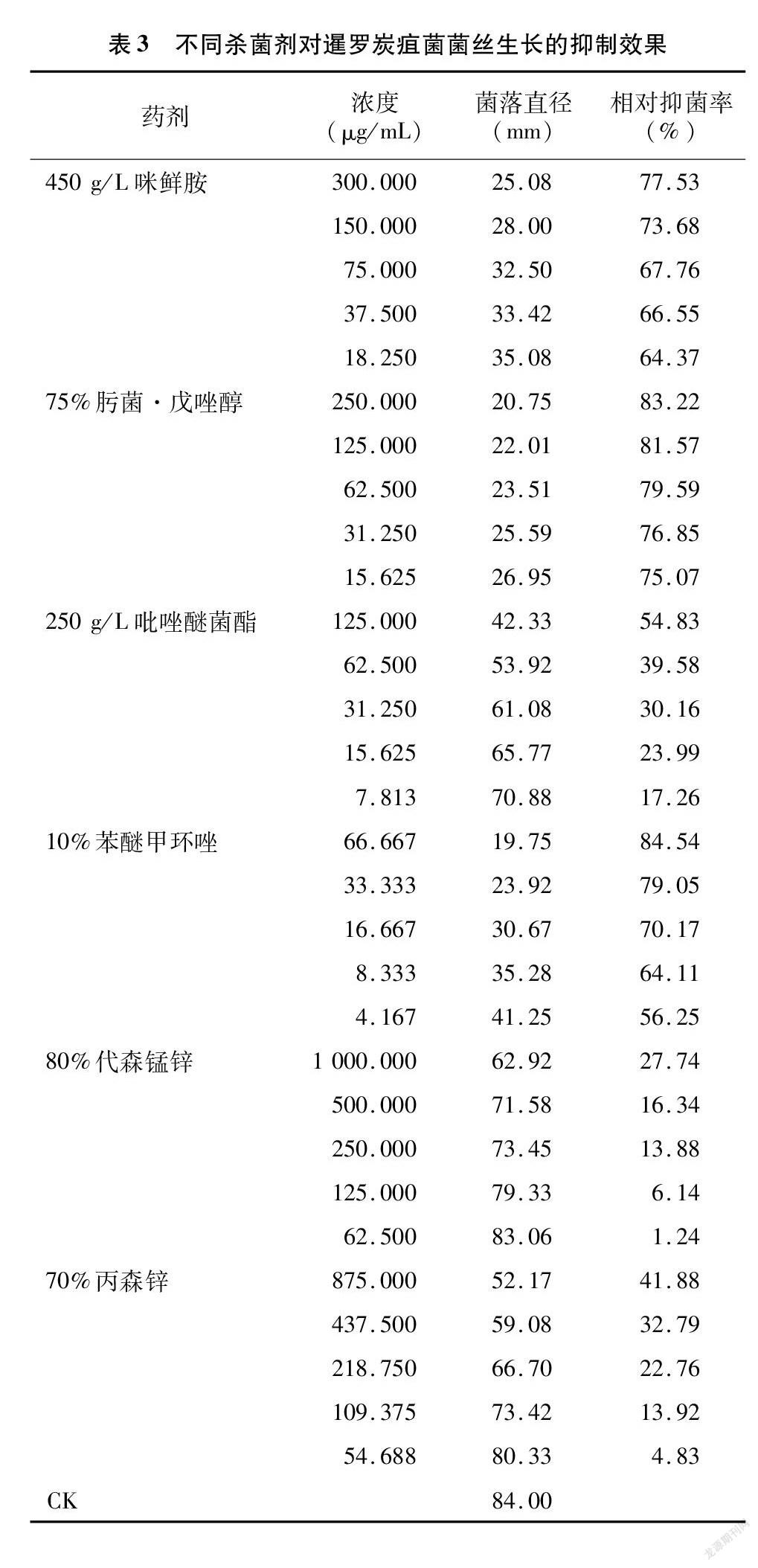
2.2 不同药剂对暹罗炭疽菌菌丝生长的抑制作用
由表3可以看出,在各供试药剂所设定的浓度范围内,暹罗炭疽菌的菌丝生长均受到不同程度的抑制,与药剂浓度呈正相关,相对抑制率在1.24%(62.500 μg/mL 80%代森锰锌)~84.54%(66.667 μg/mL 10%苯醚甲环唑)之间。不同杀菌剂在推荐使用浓度下,66.667 μg/mL 10%苯醚甲环唑的相对抑制率最高(84.54%),250 μg/mL 75%肟菌·戊唑醇表现次之(83.22%),1 000.000 μg/mL 80%代森锰锌相对抑制率最低(27.74%)。毒力分析结果(表4)表明,6种杀菌剂对暹罗炭疽菌的EC50值从低到高依次为0.028 μg/mL(75%肟菌·戊唑醇)、1.718 μg/mL(450 g/L咪鲜胺)、2.650 0 μg/mL(10%苯醚甲环唑)、108.672 8 μg/mL(250 g/L吡唑醚菌酯)、1 102.274 1 μg/mL(70%丙森锌)和2 514.316 5 μg/mL(80%代森锰锌)。
2.3 不同药剂对果生刺盘孢菌丝生长的抑制作用
由表5可以看出,6种杀菌剂在供试浓度范围内,对果生刺盘孢的相对抑制率在3.38%(62.500 μg/mL 80%代森锰锌)~100.00%(300 μg/mL 450 g/L咪鲜胺)之间。在推荐使用浓度下,300 μg/mL 450 g/L咪鲜胺相对抑制率最高(100.00%),66.667 μg/mL10%苯醚甲环唑表现次之(92.57%),875.000 μg/mL 70%丙森锌相对抑制率最低(53.00%)。毒力分析结果(表6)表明,6种杀菌剂对果生刺盘孢的EC50值从低到高依次为0.025 6 μg/mL(75%肟菌·戊唑醇)、1.649 9 μg/mL(10%苯醚甲环唑)、22.424 1 μg/mL(450 g/L咪鲜胺)、45.091 9 μg/mL(250 g/L吡唑醚菌酯)、315.770 1 μg/mL(80%代森锰锌)和618.082 6 μg/mL(70%丙森鋅)。除450 g/L咪鲜胺,其他5种杀菌剂对果生刺盘孢的EC50值均低于暹罗炭疽菌。
2.4 不同药剂对暹罗炭疽菌分生孢子萌发的影响
由表7可以看出,暹罗炭疽菌分生孢子在6种杀菌剂供试浓度范围内其萌发均受到不同程度的抑制,相对抑制率在55.07%(54.688 μg/mL 70%丙森锌)~100.00%(1 000.000 μg/mL 80%代森锰锌)之间。各种杀菌剂在推荐使用浓度下均表现出较高的抑制效果,相对抑制率从高到低依次为100.00%(1 000.000 μg/mL 80%代森锰锌)、99.36%(300 μg/mL咪鲜胺)、98.91%(875.000 μg/mL 70% 丙森锌)、85.95%(66.667 μg/mL 10%苯醚甲环唑)、84.23%(125.000 μg/mL 50 g/L吡唑醚菌酯)和84.02%(250.000 μg/mL 75%肟菌·戊唑醇)。毒力分析结果(表8)表明,6种杀菌剂的EC50值从低到高依次为0.336 9 μg/mL(250 g/L吡唑醚菌酯)、0.754 7 μg/mL(75%肟菌·戊唑醇)、2.129 3 μg/mL(10%苯醚甲环唑)、14.929 5 μg/mL(450 g/L咪鲜胺)、51.763 1 μg/mL(70%丙森锌)、77.662 4 μg/mL(80%代森锰锌)。
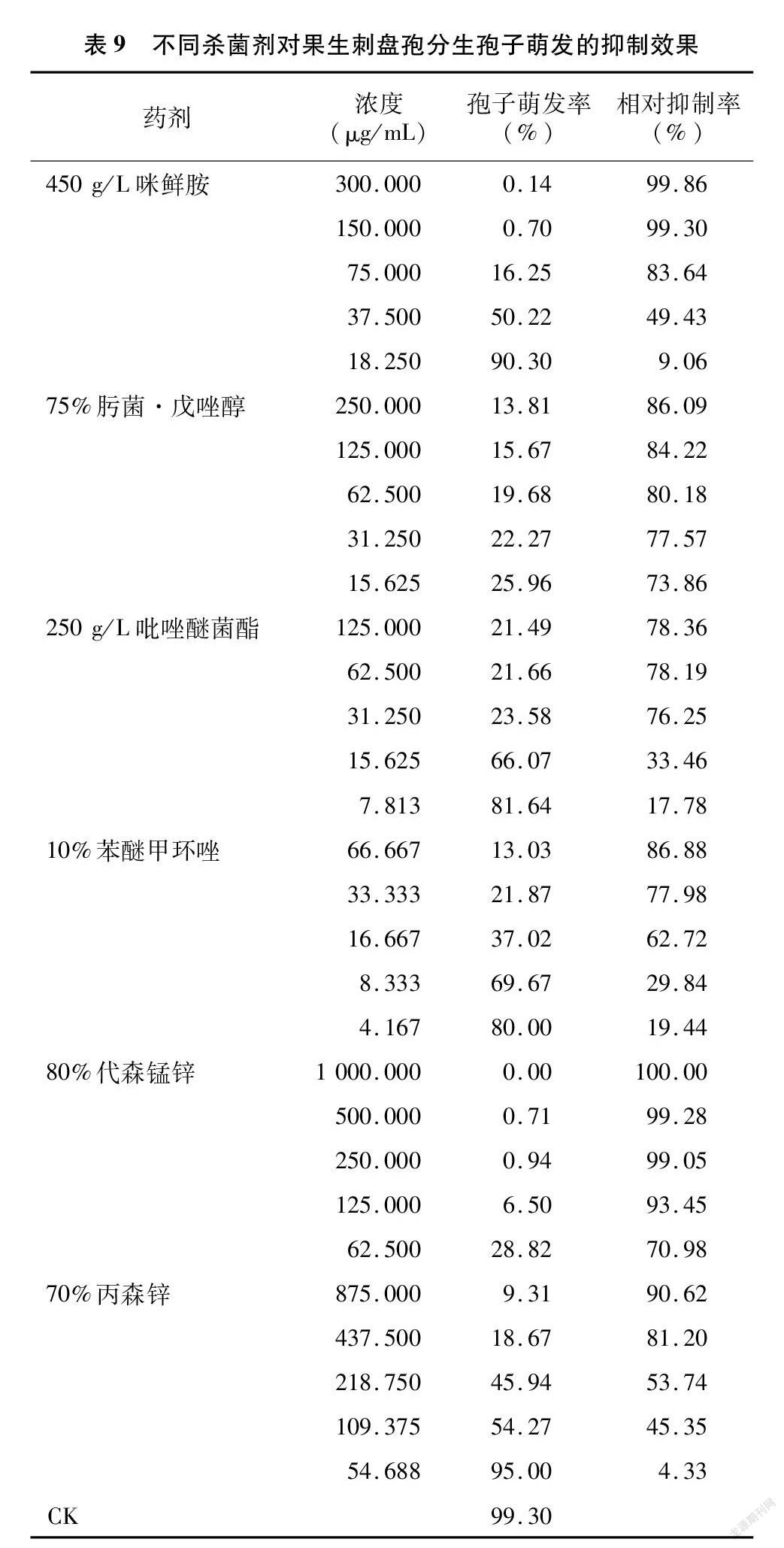
2.5 不同药剂对果生刺盘孢分生孢子萌发的影响
由表9可以看出,6种杀菌剂在供试浓度范围内对果生刺盘孢分生孢子萌发的相对抑制率在4.33%(54.688 μg/mL 70%丙森锌)~100.00%(1 000.000 μg/mL 80%代森锰锌)之间。各种杀菌剂在推荐使用浓度下均表现出较高的抑制效果,对果生刺盘孢菌的抑制效果排名与在暹罗炭疽菌上基本一致,除75%肟菌·戊唑醇的效果稍好于 50 g/L 吡唑醚菌酯。毒力分析结果(表10)表明,6种杀菌剂的EC50值从低到高依次为0.316 6 μg/mL(75%肟菌·戊唑醇)、13.409 8 μg/mL(10%苯醚甲环唑)、23.669 8 μg/mL(250 g/L吡唑醚菌酯)、39.447 μg/mL(450 g/L咪鲜胺)、46.980 μg/mL(80%代森锰锌)和199.617 1 μg/mL(70%丙森锌)。
3 讨论
胶孢炭疽菌是国内报道最多的引起草莓炭疽病的致病菌,虽然有很多研究表明它是一个复合种,但由于复合种内各隐存种的形态非常相似、形态性状受培养条件的影响很大,对真菌物种进行鉴定有很强的经验依赖性,以及常用作真菌分类鉴定的ITS片段多态性位点有限,国内研究很少将草莓炭疽病鉴定到复合种内的具体隐存种。目前,只有韩永超等曾报道胶孢炭疽复合种内的暹罗炭疽菌可引起湖北省武汉市草莓根颈腐烂病[9]。近年来,学者多采用多基因系统分析进行分类鉴定[18-19]。Weir等结合形态学方法和多基因系统进化分析发现胶孢炭疽菌复合种可分成22个种[12]。不同隐存种的致病性强弱、侵染部位、分布情况及对药剂的敏感程度是否有差异尚未见报道。能对草莓炭疽病的病原进行准确鉴定,对草莓炭疽病的防治具有重要意义。前期,笔者所在课题组在草莓炭疽病发病组织中分离到2株形态有细微差异的菌株,经致病性鉴定确定对草莓具有致病性,本研究通过构建多基因(ITS、CAL、ACT、TUB2)系统发育树,将其分别鉴定为胶孢炭疽复合种中的暹罗炭疽菌和果生刺盘孢。
目前,已有很多关于草莓炭疽病防治药剂筛选的报道,与过往研究相比本研究首次对胶孢炭疽复合种内的暹罗炭疽菌和果生刺盘孢的室内毒力进行了比较,结果表明在推荐浓度下,大部分药剂对2种炭疽病菌的菌丝生长和孢子萌发均能起到较明显的抑制效果,相对抑制率与药剂浓度成正比。值得注意的是,有些药剂对菌丝生长抑制效果不是太明显,但对分生孢子萌发却表现出明显的抑制作用。在各药剂推荐使用浓度下,对暹罗炭疽菌菌丝生长和孢子萌发相对抑制率最强的分别是10%苯醚甲环唑和80%代森锰锌,对果生刺盘孢菌丝生长和孢子萌发相对抑制率最强的为450 g/L咪鲜胺和80%代森锰锌。从EC50值比较结果来看,对暹罗炭疽菌菌丝生长毒力最强的3种药剂依次为75%肟菌·戊唑醇、450 g/L咪鲜胺和10%苯醚甲环唑;对暹罗炭疽菌分生孢子萌发毒力最强的3种药剂依次为250 g/L吡唑醚菌酯、75%肟菌·戊唑醇和10%苯醚甲环唑;对果生刺盘孢的菌丝生长毒力最强大3种药剂依次为75%肟菌·戊唑醇、10%苯醚甲环唑和450 g/L咪鲜胺;对果生刺盘孢分生孢子萌发毒力最强的3种药剂依次为75%肟菌·戊唑醇、10%苯醚甲环唑和250 g/L吡唑醚菌酯。从供试杀菌剂对病原菌菌丝生长和分生孢子萌发抑制效果及药剂使用量的综合表现来看,暹罗炭疽菌和果生刺盘孢均对75%肟菌·戊唑醇和10%苯醚甲环唑表现较为敏感。王国君等比较了5种杀菌剂对草莓炭疽病的田间防治效果,从防治效果、对草莓的安全性及抗药性等方面综合考虑,也认为75%肟菌·戊唑醇水分散粒剂是防治草莓病害较理想的药剂[20]。
4 结论
6种杀菌剂在试验浓度下对2种致病菌的菌丝生长和分生孢子萌发均有不同程度的抑制作用,相对抑制率与药剂浓度呈正相关。根据供试杀菌剂对病原菌菌丝生长和分生孢子萌发抑制效果及药剂使用量的综合表现,暹罗炭疽菌和果生刺盘孢均对75%肟菌·戊唑醇和10%苯醚甲环唑表现较为敏感,可作为南京地区草莓炭疽病防治的候选药剂。但本试验的毒力测定是在室内进行的,室内环境与田间环境存在较大差异,在推广应用前,还需进一步开展田间药效试验。
参考文献:
[1]忻 雅,马华升,阮松林,等. 草莓炭疽病抗性室内快速鉴定方法研究及应用[J]. 果树学报,2013,30(6):1072-1076.
[2]van Hemelrijck W,Debode J,Heungens K,et al. Phenotypic and genetic characterization of Colletotrichum isolates from Belgian strawberry fields[J]. Plant Pathology,2010,59(5):853-861.
[3]任海英,蔣桂华,方 丽,等. 浙江省草莓炭疽病菌鉴定及生物学特性研究[J]. 浙江农业学报,201 3(5):937-941.
[4]梁钰平.草莓炭疽病检测及防治之研究 [M]. 台北:台湾大学,2015:4-10.
[5]杨敬辉,陈宏州,肖 婷,等. 草莓炭疽病病原鉴定及其对12种杀菌剂的毒力测定[J]. 西南农业学报,2015,28(6):2527-2531.
[6]Damm U,Cannon P F,Woudenberg J H C,et al. The Colletotrichum acutatum species complex[J]. Studies in Mycology,2012,73:37-113.
[7]韩国兴,礼 茜,孙飞洲,等. 杭州地区草莓炭疽病病原鉴定及其对多菌灵和乙霉威的抗药性[J]. 浙江农业科学,2009,50(6):1169-1172.
[8]林 婷. 胶孢炭疽菌杀菌剂抗药性的机制、检测技术及治理研究 [D]. 浙江:浙江农林大学,2015.
[9]韩永超,向发云,曾祥国,等. 草莓根颈腐烂病的病原鉴定[J]. 中国农业科学,2014,47(1):53-60.
[10]White T J,Bruns T,Lee S,et al. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics [M]//Innis M A,Gelfand D H,Sninsky J J,et al. PCR protocols:a guide to methods and applications. San Diego:Academic Press,1990:315-322.
[11]Carbone I,Kohn L M.A method for designing primer sets for speciation studies in filamentous ascomycetes[J]. Mycologia,1999,91(3):553-556.
[12]Weir B S,Johnston P R,Damm U. The Colletotrichum gloeosporioides species complex[J]. Studies in Mycology,2012,73:115-180.
[13]ODonnell K,Cigelnik E.Two divergent intragenomic rDNA ITS2 types within a monophyletic lineage of the fungus Fusarium are nonorthologous[J]. Molecular Phylogenetics and Evolution,1997,7(1):103-116.
[14]Glass N L,Donaldson G C.Development of primer sets designed for use with the PCR to amplify conserved genes from filamentous ascomycetes[J]. Applied and Environmental Microbiology,1995,61(4):1323-1330.
[15]Tamura K,Stecher G,Peterson D,et al. MEGA6:molecular evolutionary genetics analysis version 6.0[J]. Molecular Biology and Evolution,2013,30(12):2725-2729.
[16]中華人共和国农业部.农药室内生物测定试验准则 杀菌剂 第2部分:抑制病原真菌菌丝生长试验 平皿法:NY/T 1156.2—2006[S]. 北京:中国标准出版社,2006.
[17]中华人共和国农业部.农药室内生物测定试验准则 杀菌剂 第1部分:抑制病原真菌孢子萌发试验 凹玻片法:NY/T 1156.1—2006[S]. 北京:中国标准出版社,2006.
[18]Hassan O,Jeon J Y,Chang T,et al. Molecular and morphological characterization of Colletotrichum species in the Colletotrichum gloeosporioides complex associated with persimmon anthracnose in south Korea[J]. Plant Disease,2018,102(5):1015-1024.
[19]李 河,周国英,徐建平,等. 一种油茶新炭疽病原的多基因系统发育分析鉴定[J]. 植物保护学报,2014,41(5):602-607.
[20]王国君,陈利军,宁万光.几种杀菌剂对草莓炭疽病的田间防治效果[J]. 中国农技推广,2016,32(11):56-57.

