底泥疏浚生态环境效应的后评价研究
杨春懿 马广翔 顾俊杰 顾佳艳 何国富 孔维鑫 杨根森

关键词:底泥疏浚;水质;沉积物;底栖生物;微生物多样性
0引言
底泥是众多污染物的汇聚地,在一定条件下,底泥污染会再次向水体释放,带来二次污染[1].当外源污染物得到有效控制时,内源污染物的释放已经成为水体富营养化的主要原因之一[2].底泥疏浚作为降低底泥污染的一种工程措施,可以有效去除内源污染物.这一工程学措施已经在很多国家和地区进行了实践[3].但疏浚工程会受到水体条件、施工季节、疏浚方式以及现场操作等因素的影响,可能造成沉积物再悬浮、污染物释放、底栖动物群落结构受损、微生物多样性降低等问题,对水体生态系统带来不利影响.
为此,国内外开展了大量的研究,主要包括底泥疏浚适宜深度的探讨[4]、疏浚后水体水质的变化[5]、内源污染物释放的过程机理[6-7]等方面.从工程效益来看,底泥疏浚对污染水体的治理效果是疏浚研究与应用的重点,但国内外学者就疏浚治理后能否长期改变水体污染状况的问题仍存在争议[8].研究表明,疏浚效果保持时间最长可达20年,若没有严格的外源污染控制手段,效果可能只保持几个月,而大部分工程实践结果显示,疏浚效果大约可保持1~2年[9].
目前,针对底泥疏浚效果的后评价工作尚不多见,此外,从研究对象来说,国内底泥疏浚大多以湖泊为主,尤其是浅水湖泊,对河道疏浚的关注也相对较少.基于此,本研究以山东省某河段底泥疏浚工程为研究对象,对其2年后的疏浚效果进行跟踪监测,开展后评价.通过分析水质变化、新生沉积物营养状态、底栖动物和微生物多样性变化等,探讨该河段整治效果的保持情况,为其后续长效维护提供依据,同时补充国内现有河道底泥疏浚工程效果评价的案例.
1材料与方法
1.1 研究区域与布点
河段整治及疏浚示范工程于2015年9月竣工,工程清淤长度约1km,河宽350~500m,疏浚深度约10cm,处置总方量约4104m3(水下方).根据《地表水和污水监测技术规范》(HJ/T91—2002),共设11个采样点,分布如图1所示.
1.2 样品采集与测定
采样时间为2017年11月至2019年11月,每隔半年取样1次,共5次,共采集水样55个.于水下0.5m处采集水样,采样时要求船体处于下游,采样人员在船体前部且尽量远离船体处采样,水样装于500mL聚乙烯采样瓶中,4℃下暗处保存带回实验室.采用XDB0201抓斗式采泥器采集表层约5~10cm的样品,采样后将样品分别装入10号聚乙烯密封袋,并排尽空气,样品风干后研磨过筛.采样点位均采用GPS手持机进行定位,此外,为确保采集、运输、储存过程中的样品质量,每10个样品设置1个平行样.
水样测定总氮(TN)、氨氮(NH4+-N)、总磷(TP)、化学需氧量(CODCr)4项指标;沉积物中测定TN、TP、总有机碳(TOC)、有机氮4项指标,测定方法均参照《水和废水监测分析方法》(第4版),同一断面采样点的测定结果取平均值.沉积物样品中底栖生物的采集使用XDB0201抓斗式采泥器采集表层约5~10cm的泥沙样品,1次采样量为5L,采样面积为1/16m2.采集的泥样先倒入40目的铜丝分样筛中,然后将筛底放在水中轻轻摇荡,洗去样品中的污泥,最后将筛中的渣滓倒入塑料袋中,并贴上标签,将袋口缚紧带回实验室分检.
微生物多样性分析采用高通量测序法,对沉积物原样进行细菌基因组DNA提取和检测.通过0.8%琼脂糖凝胶电泳检测DNA提取质量,同時采用紫外分光光度计对DNA进行定量,以16SrRNA基因的双V区(V3—V4高变区)片段细菌通用引物进行PCR扩增,读取核苷酸种类,在IlluminaMiseq平台测序,此部分委托派森诺生物科技有限公司完成.
2结果与讨论
2.1 水质评价结果
根据《山东省地表水环境功能区划(第二次征求意见稿)》(山东省环保厅,2010年12月),本研究河段定位为“景观娱乐用水区(Ⅴ)”,执行Ⅳ类标准(《地表水环境质量标准》GB3838—2002).
图2为不同采样时段CODCr、TP、TN、NH4+-N在各监测点的含量变化.2.1节分析了支流A、上游和中游(疏浚区)中各污染物含量的变化关系.其中,CODCr和TN含量的变化较为一致,前两次采样结果显示,疏浚区的CODCr含量明显低于上游来水(p<0.05),且能够达到地表水Ⅳ类水质标准.2018年11月起,疏浚区的CODCr含量开始高于上游来水,但总体差异不大,能够达到水质要求,这可能是受到支流带来的污染物影响.方差分析显示,各时期疏浚区的TN含量与未疏浚区均无显著差异(p>0.05),但疏浚区的TN含量高于上游来水,且均远高于地表水Ⅳ类的要求,反映出疏浚对该河段TN污染的控制效果未达预期.这是因为底泥疏浚在短期内可能对营养盐有较好的控制作用,但长期观察效果有可能减弱[10].
5次采样结果显示,疏浚区的TP含量均低于未疏浚区(p<0.05),且同样伴随有支流A的较高浓度TP输入,但仍能维持在0.15~0.2mg·L–1,表明疏浚对维持河段的TP含量具有较好的作用.Ryding[11]对瑞典某湖泊疏浚后进行了长期跟踪,发现疏浚后初期水体中的总磷和溶解性磷分别下降了50%和73%,但在2年后又恢复到疏浚前的水平.但本研究中疏浚两年后,即便TP在支流和上游水体汇入的影响下,仍能达到地表水Ⅳ类的标准.且2019年6月起,差距减小,这可能是受到此次采样前下游橡胶坝(图1)排水工程的影响.
NH4+-N含量的变化没有明显规律,这可能与NH4+-N的去除主要通过硝化作用进行有关,且往往在较短时间内就能完成,主要受到光照、水流流速等因素的影响.童敏等[12]在研究温州市牛桥底河底泥疏浚工程对水环境的影响时发现,工程结束后,水中TP、TN及NH4+-N的含量随时间推移“先升高,后降低”.本研究中的NH4+-N含量在2018年6月达到最高,随着疏浚工程结束逐渐降低,但较上游并未有显著降低(p>0.05).
总体来说,该河段疏浚区水质在疏浚后3年出现水质指标(CODCr、TN)高于未疏浚区的情况.疏浚河段水质出现反复的原因一方面与疏浚工程效果维持时效性有关,另一方面也与源源不断的外源(本研究中主要为支流A)输入有关,同时也印证了疏浚河段的长效维护必须以截断外源污染为前提.
2.2 新生沉积物环境效应
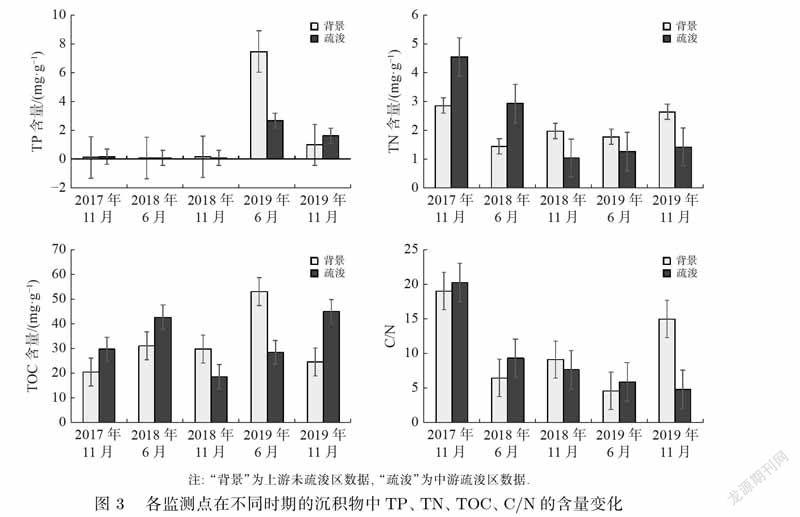
疏浚工程残留的污染物、疏浚过程中沉积物的再悬浮、新生表层沉积物污染物的释放以及外源污染物的持续汇入等都会影响底泥疏浚的效果.因此,在疏浚实施后分析新生沉积物的环境影响是十分必要的.不同采样时段疏浚区和未疏浚区的TP、TN、TOC含量和碳氮比(C/N)变化如图3所示.
疏浚区沉积物的TP含量为0.06~3.10mg·g–1,未疏浚区为0.07~7.84mg·g–1.前3次采样中,疏浚区及未疏浚区沉积物的TP含量均处于较低水平,但在2019年6月出现激增.现场调研发现,在此次采样前,当地有关部门曾打开河段下游橡胶坝进行排水作业,给疏浚区带入了大量上游较远区域的沉降物,造成沉积物中的TP含量激增.
疏浚区沉积物的TN含量为1.29~4.94mg·g–1,未疏浚区为1.46~4.75mg·g–1,两者的TN含量并无明显差别(p>0.05).在生态系统结构较完善的水土界面,死亡的动植物残体中的氮经过氨化、硝化及反硝化等一系列反应,一部分可重新回到水体中,一部分以气态形式逸散到大气中,还有一部分仍留在残体中,因此,沉积物的TN含量能够维持平衡.而在进行底泥疏浚过程中可能会破坏水土界面的生态系统,导致沉积物中死亡动植物的分解受到影响,这可能是沉积物的TN含量不稳定的原因之一[13].
疏浚区沉积物的TOC含量为8.58~66.62mg·g–1,未疏浚区为5.13~40.66mg·g–1.疏浚区新生沉积物的TOC含量随着时间推移表现为先下降后升高.需要注意的是,在前两次采样中,即疏浚工程结束后2~2.5年,疏浚区沉积物的TOC含量高于未疏浚区,但随着时间推移逐渐下降,并在2018年11月低于未疏浚区,此后,虽然疏浚区新生沉积物的TOC含量有上升趋势,但始终低于未疏浚区.
疏浚区沉积物的C/N为3.02~23.03;未疏浚区为1.80~20.89.2019年11月前,疏浚区新生沉积物的C/N均未显著区别于未疏浚区(p>0.05),但总体上,其比值随着时间呈明显下降趋势.一般来说,C/N值越高,有机质越难被降解.当比值为5~6时,一般被认为是新鲜的或易降解的有机质组分;当比值高于10时,则被认为是难降解的有机物[14].因此,该研究河段C/N值的下降在一定程度上指示著疏浚区新生沉积物中的有机质随着时间推移从较难降解的外源性有机质逐渐向着易降解的水体自身有机质转化.王若冰等[15]对丹江口库区的研究发现,氮矿化速率受沉积物含水率和C/N的影响.赵彤等[16]指出沉积物中的氨化作用潜力也可以用C/N进行表征,C/N值较高则氨化作用受到抑制,沉积物潜在硝化速率(PNR)较低.这说明,随着疏浚区沉积物C/N值的下降,河段新生沉积物中氮的矿化速率可能逐渐提升,一定程度上降低了沉积物中营养盐的负荷水平.
2.3 生物环境效应
2.3.1底栖动物生物量分析
底栖生物及微生物的生长与繁殖与沉积物联系密切[17],沉积物中的污染物质会显著影响底栖生物及微生物的种群数量及群落分布[18].而底栖动物长期生存在水体底部,并且由于其较差的移动性,故只能被动地接受环境的变化.疏浚对水生生物有短期和长期的影响,特别是对底栖生物影响显著[19].疏浚对水生生物的短期影响表现为生物多样性、密度和生物量的降低或减小.
本研究共采集底栖生物隶属5科8种.其中寡毛纲颤蚓科包括霍普水丝蚓(LimnodrilusHoffmeisteri)、瑞士水丝蚓(LimnodrilushelveticusPiguet)、苏氏尾鳃蚓(BranchiurasowerbyiBeddard);双翅目摇蚊科包括红裸须摇蚊幼虫(Propsilocerusakamusi)、伪施密摇蚊幼虫(Pseudosittiasp.);毛翅目原石蚕科包括白条石蚕(Apsilochoremasutchanum);鞘翅目长角泥甲科包括长角泥甲科幼虫(Elmidae);广翅目大蜻科包括大蜻科稚虫(Macromidae).
根据鉴定结果,沉积物中大型底栖动物基本消失,主要为摇蚊科及颤蚓科.姜苹红等[20]研究底泥疏浚对月湖的底栖生物的影响时也有类似结果.摇蚊科主要为红裸须摇蚊幼虫(Propsilocerusakamusi),长15mm左右,广泛分布于河流及湖泊等有机污染严重的水体中;颤蚓科主要为霍普水丝蚓(Limnodrilushoffmeisteri),属于环节动物,在水体中呈红色,体长35~55mm,常在污染最严重的水体中形成优势种群,因此常作为重度污染水体的指示生物[21].
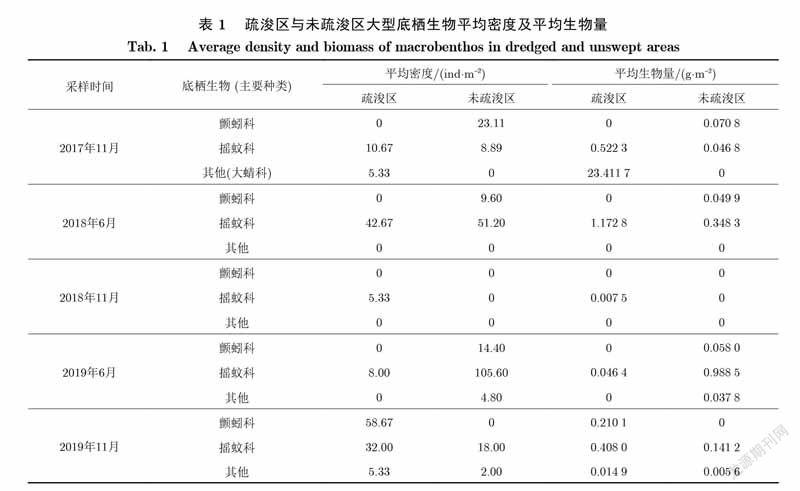
表1为疏浚区与未疏浚区大型底栖生物平均密度及生物量.前4次采样中,疏浚区均未发现颤蚓科底栖动物,直到第5次采样时即疏浚工程结束后第4年在表层沉积物中发现了颤蚓科底栖生物.该河段底泥疏浚工程显著降低了表层沉积物中颤蚓科的平均生物量及密度,一定程度上改善了河段的水质状况.戴雅琪等[22]研究发现,疏浚后底栖动物的种类增加,但生物量和密度减少,可能是由疏浚后优势种的适合度减低,其他种的适合度相对上升造成的.
未疏浚区夏季摇蚊类增殖较快,密度比达到55.5%;秋季摇蚊类的比例有所下降,原因可能是夏季温度较高,摇蚊大量增殖,而秋季蚊类发育成熟后羽化,造成其密度减少了24.2%.疏浚区各季节摇蚊类的密度比都很低,在5.9%~21.7%.这可能是因为,底泥疏浚后对原有沉积物环境造成破坏,不利于其生存和繁殖[23].
生物量方面,未疏浚区沉积物含有丰富的氮、磷和有机质,浮游生物的数量和生物量相对较多,有利于底栖动物的生存和繁殖,疏浚区的生物量明显低于未疏浚区[23].但由于本次底泥疏浚工程为表层沉积物的10cm,并未完全破坏沉积物的理化环境,这可能导致了本研究河段疏浚区和未疏浚区的生物量相当,甚至由于疏浚改善了河段的沉积物环境,出现疏浚区生物量高于未疏浚区的情况.这也表明了,当疏浚深度控制在一定范围时,能够创造出适宜底栖生物生存的环境,有利于底栖生物生物量的恢复.
底泥疏浚后,疏浚区寡毛类的种类和数量与未疏浚区未见明显差别,这可能是因为其适应性和再生能力很强,因此也常成为受干扰系统恢复过程中的先锋种类[24].而疏浚对摇蚊类和软体动物的影响较大,有关月湖[20]和太湖东部[25]的研究也有类似结果.
有研究指出,有些河段疏浚4年后底栖动物仍受到干扰,群落结构还未恢复[26].Newell[27]指出对于不稳定的环境,如河海岸和淤泥的沉积物来说底栖生物的恢复时间为6~8个月;对沙质的沉积物来说群落的恢复要2~3年的时间;但是对于比较复杂的生物群落来说要5~10年的恢复过程.因此,该河段底泥疏浚后的水体中底栖生物的生物量和密度可能还需要更长时间的恢复.
2.3.2微生物多样性分析
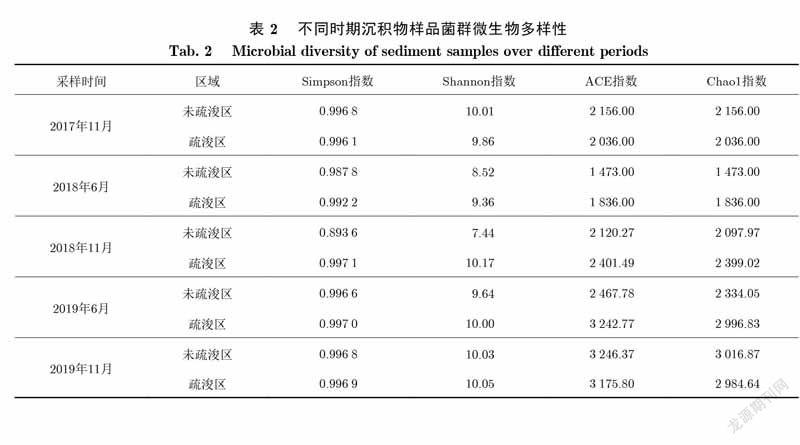
在水生生态系统中,微生物不仅是底栖生物群落的重要组成部分,而且在整个系统中,在物质降解、转化及能量流动中起着关键控制作用.微生物主要聚集在表层沉积物中,底泥疏浚工程会改变微生物的生境,从而影响微生物群落的分布[28].分析5次该河段表层沉积物中微生物群落特征,10个样品共检测到666888个有效序列.表2为不同时期疏浚区和未疏浚区表层沉积物中菌群微生物多样性.
由表2可知,疏浚2年半后,疏浚区的微生物多样性高于未疏浚区,并一直维持到2019年6月,但此时疏浚区和未疏浚区的Simpson指数和Shannon指数未有明显差异,这可能仍然与人为排水作业影响有关.沉积物的人为迁移首先对Simpson指数和Shannon指数造成影响,而对ACE指数、Chao1指数的影响可能滞后.2019年11月采样结果显示,疏浚区和未疏浚区的4类多样性指数均无明显差异,甚至出现未疏浚区多样性高于疏浚区的情况.钟继承等[28]进行的底泥疏浚模拟实验发现,未疏浚区沉积物中微生物的活性及多样性显著高于疏浚区,这是因为,疏浚后原本生物量较低的深层沉积物变为表层沉积物,进而影响了水体生态系统中生源要素的循环.
总体而言,在没有强力人为干扰下,疏浚2年后,疏浚区的微生物多样性逐渐恢复,因为疏浚去除了最表层的污染沉积物,并带走了一部分优势种属,给其他微生物和底栖生物创造了机会.所以在一定影响下,疏浚能够提高沉积物中的微生物多样性.
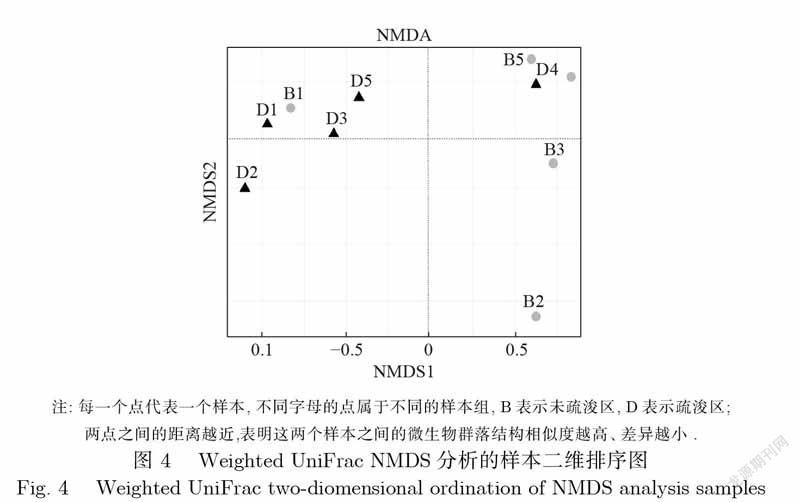
图4为WeightedUniFracNMDS分析的样本二维排序图.由图可知,2017年11月份采样时,即距离疏浚工程约2年后,疏浚区与未疏浚区的微生物群落结构仍有一定相似性,但自2018年6月采样起,两者差异变大.直到2019年6月两者差距又变小,这与现场开展了排水作业,导致沉积物迁移的情况吻合.而经过半年的恢复后,两者差异又增加,虽然从多样性指数上并不明显,但从样本二维排序图中能看出差异.由此表明,此时微生物群落结构基本已经恢复,即便是受到突发的外界干扰也能在较短时间内恢复,体现出疏浚区对微生物群落结构多样性提升的重要作用.
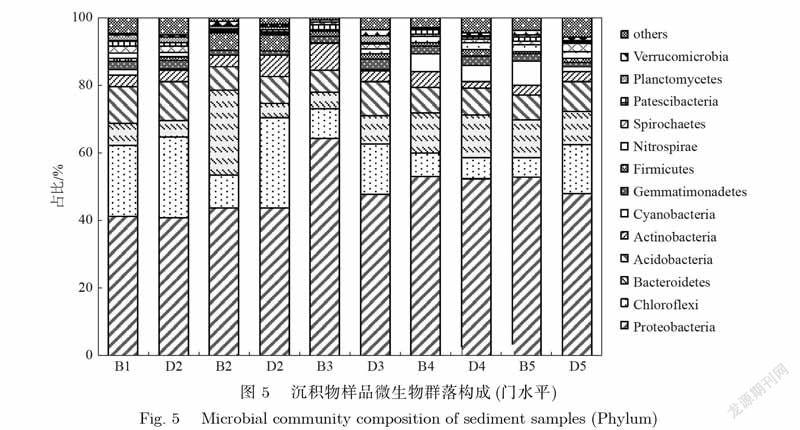
图5为河段沉积物样品中的微生物在门水平上的群落构成.疏浚区与未疏浚区沉积物中微生物的优势菌门均为变形菌门(Proteobacteria)、绿弯菌门(Chloroflexi)、拟杆菌门(Bacteroidetes)、酸杆菌门(Acidobacteria),在门水平上并未出现显著差异.这可能是因为该河段清淤深度为10cm,主要去除的是表层沉积物及其中的生物.而一般来说,当清淤≥30cm时才可能对原有的生物群落结构造成根本性影响[28].此外,河段沉积物中与硝化作用有关的硝化螺旋菌门(Nitrospirae)占比0.4%~2.0%,平均为1.3%,不同时期疏浚区及未疏浚区沉积物样品中硝化螺旋菌门(Nitrospirae)的占比均无明显差异.因此,该河段底泥疏浚工程对河段沉积物中微生物群落结构的长期影响较小.
3結论
(1)研究河段底泥疏浚有效降低了水中的CODCr、TP含量,但对TN及NH4+-N含量的影响较小.
(2)疏浚区新生沉积物中的C/N值逐渐降低,有利于微生物及底栖生物群落的恢复.
(3)疏浚可在一定程度上降低表层沉积物中颤蚓科的平均生物量及密度,而摇蚊科的密度受疏浚影响较小,并且夏季明显高于秋、冬季.
(4)疏浚并未对河段沉积物中的微生物群落结构带来显著改变,这可能与疏浚深度有关.
(5)外源污染物的输入、人为排水作业等均可影响疏浚河段的水质及沉积物污染物含量,但当微生物群落基本构建完成后,这种影响可能在较短时间内恢复.
综上所述,该河段底泥疏浚工程可以快速去除CODCr、TP等内源污染物,改善水质和沉积物污染状况,缓解水体富营养化趋势;工程所取疏浚深度(10cm)有利于底栖动物和微生物生境的维持和多样性的恢复;疏浚总体工程效果在研究开展期间(即疏浚后2~4年)有持续体现,但随着时间的推移以及人为干扰的影响,水质维持效果有所下降.

