带叔胺的两亲嵌段共聚物的合成及其载光敏剂胶束用于光疗抗菌
王佩文,欧阳耀文,刘原铖,周良芹,罗祥林,2
(1.四川大学高分子科学与工程学院;2. 高分子材料工程国家重点实验室(四川大学),四川 成都 610065)
近年来,光动力(PDT)-光热(PTT)治疗开始应用于抗微生物感染。PDT 和PTT 杀菌是光敏剂经近红外光照射后产生大量的热与活性氧分子(ROS),通过物理方式PTT 或化学损伤PDT 对细菌进行杀伤。而且,光动-光热联合治疗比单一方式具有更好的治疗效果[1]。光照杀菌因其独特的杀菌机理,杀菌过程并不会使细菌产生耐药性[2];并且具有精准可控等优点,因而受到研究者们的广泛关注。
细菌细胞壁带有负电荷,细菌感染的部位通常呈微酸性,最低可达pH 5.5 左右[3]。当聚合物载体中有可以质子化的官能团,如叔氨基单元,在细菌感染部位的微酸环境中质子化后转变为正电基团,与表面带负电的细菌细胞壁之间产生正负电荷作用,从而靶向细菌,这样的载体可以提高杀菌效率[4]。因此,本文设计并合成了带叔氨官能团的pH 敏感两亲嵌段聚合物,聚乙二醇单甲醚-b -聚(2-(二乙氨基)甲基丙烯酸乙酯)和聚乙二醇单甲醚-b-聚(甲基丙烯酸羟乙酯-co-甲基丙烯酸二乙氨基乙酯)(分别记为PD 和PHD),选用IR780 碘化物为模型光敏剂进行光照杀菌研究。IR780 吸收近红外光后可进行光热转化并释放ROS,常用于PDT、PTT 治疗和荧光成像[5]。目前,以IR780 为光敏剂进行光照杀菌的研究较少。另外,在光照过程中IR780 存在光漂白现象[6]。因此,在使用PD 和PHD 胶束包载IR780的同时引入一种能清除自由基的白藜芦醇(RES)[7~9]来保护光敏剂的分子结构,使IR780 具有更多次的光响应效果[10]。
1 实验部分
1.1 原料与试剂
聚乙二醇单甲醚(mPEG,Mn=5000)、甲基丙烯酸羟乙酯(HEMA)、2-溴异丁酰溴(BIBB)、甲基丙烯酸二乙氨基乙酯(DEA)、白藜芦醇(RES):均购于Aladdin;3-[4,5-二甲基噻唑-2-基]-2,5-二苯基四唑溴化铵(MTT):购自Sigma(美国);IR 780 碘化物(Alfa Aesar)、2,2- 联 吡 啶(Bpy, 99%)、溴 化 铜(CuBr2, 99%)、二苯基异苯并呋喃(DPBF):分析纯,购于成都科龙化学试剂有限公司;四氢呋喃(THF):在使用前通过钠回流纯化,购于成都科龙化学试剂有限公司;三乙胺(TEA)、二氯甲烷(CH2Cl2):经CaH2减压蒸馏提纯后使用,购于成都科龙化学试剂有限公司;金黄色葡萄球菌(S.aureus,ATCC 29213)和 大 肠 杆 菌(E.coli,ATCC 25922):均来自华西医院;L929 细胞和HUVEC 细胞:均来自华西医院,分别在RPMI 1640 培养基和DMEM 培养基中加入10 %胎牛血清(FBS)和1 %青霉素/链霉素溶液并于37 ℃含5 % CO2的培养箱中培养。
1.2 材料的合成
以mPEG-Br 为大分子引发剂引发HEMA 和DEA 混合物或DEA 反应合成PHD 和PD。
1.2.1 mPEG-Br的合成:将60 ℃真空干燥的mPEG-OH(10.0 g,2.0 mmol)溶解于12 mL CH2Cl2中,在氮气保护下加入三乙胺(0.556 mL,2.0 mmol),置于冰-乙醇浴中充分搅拌。通过恒压滴液漏斗加入溶解于4 mL 干燥CH2Cl2的BIBB(0.494 mL,2.0 mmol),滴加速度为每秒1~2 滴。滴加完后继续搅拌30 min。移除冷却浴后继续反应36 h。滤去不溶性盐,然后用旋转蒸发器浓缩溶液。产物用冰乙醚沉淀纯化,真空干燥。
1.2.2 PHD 和PD 的合成:大分子引发剂mPEG-Br通过ATRP 反应引发HEMA 与DEA 共聚合成PHD。在Schlenk 瓶 中 加 入mPEG-Br(1.0 g,0.192 mmol),单 体DEA(0.355 g,1.192 mmol),HEMA(0.249 g,1.192 mmol)和 Bpy(46.5 mg,0.298 mmol)。抽真空-通氮气转换3 次后,加入混合溶剂(甲醇、水的体积比1:1)7 mL,通入氮气20 min 除去氧气。最后在氮气气氛下向Schlenk 瓶中加入CuBr(0.017 g,0.192 mmol),迅速密封瓶口,常温搅拌。24 h 后混合物移入截留分子量3500 的透析袋,纯水透析48 h,冷冻干燥24 h 得到产物。合成PD 的过程和步骤完全与上面一致,只是不加单体HEMA。
1.3 聚合物的表征
核磁共振氢谱在德国Bruker 核磁共振波谱仪上测定(400 Hz),采用V(CDCl3)∶V(CD3OD)= 1:1 为溶剂。红外测试采用溴化钾压片法,在美国Nicolet Magna560 傅里叶变换红外光谱仪上测得,扫描波长范围为500~4000 cm-1,分辨率为4 cm-1。
1.4 聚合物胶束的制备
采用透析法制备胶束。将10 mg PHD 或PD 溶解于2 mL THF 中,将其逐滴加入6 mL 超纯水中。加入完毕后摇匀,超声30 min 并将其装入截留分子量为3500 的透析袋中,透析24 h。定容至10 mL,以3500 r/min 离心10 min,取上层清液保存于4 ℃冰箱中备用。载药胶束的制备方法基本同上,只是在材料溶解的过程中加入IR780 和RES 形成均匀溶液,并保持透析过程避光。
1.5 胶束测试和表征
1.5.1 胶束粒径及粒径分布和载药量分析:胶束粒径和粒径分布采用动态光散射法(DLS)检测(Malvern Zetasizer Nano Series),测试角度173 °,温度25 ℃。
用紫外光谱法测定载药量(DLC)。将200μL载药胶束添加到1.8 mL THF 溶剂中并通过式(1)、式(2)进行计算
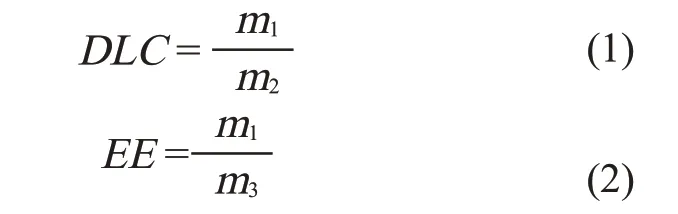
式中:EE—包封率,%;m1—载药胶束中药物的质量, g;m2—载药胶束的总质量, g;m3—投递药物的总质量, g。
由于IR780除了在780 nm有强吸收外,在300~400 nm也存在一定程度上的紫外吸收,与RES(310 nm)在此处的紫外吸收有部分重叠。故需用紫外分光光度计测定IR780 在310 nm 和780 nm 的标准曲线,由IR780 在780 nm 处的紫外拟合曲线测算出IR780 的浓度后,反推算出IR780 在310 nm 处的紫外吸收强度。由总的紫外吸收强度减去IR780 在310 nm 处的紫外吸收强度后,再由RES 的紫外吸收强度-浓度拟合曲线换算出RES 的浓度。
1.5.2 胶束的形貌表征:胶束形貌采用透射电子显微镜(TEM)观察。将浓度1 mg/mL 的胶束滴加在铜网上,待其蒸发后,滴加磷钨酸染色2.5 min 后即可测试。
1.6 载药胶束光热-光动测试
1.6.1 光热测试:用超纯水将载药的PD 及PHD 胶束稀释至IR780 浓度为50μg/mL 的溶液,取100μL上述溶液加入离心管中并使用2 W/cm2的808 nm 激光器照射30 s,同时用红外探头检测温度变化。照射结束后冷却至室温,重复上步实验步骤。分别将100μL上述溶液在离心管中直接照射5 min,并记录温度变化。
1.6.2 光动测试:取400μL上述2 种胶束溶液加入离心管中,每种胶束分成3 组并逐个加入30μL DPBF溶液,分别记为L1,L3,L4,于常温避光条件下分别用808 nm 激光器照射1 次、3次和4次,每次持续30 s。加入超纯水定容至2 mL,用紫外分光光度计测量其在350~950 nm 范围的紫外吸收变化。
1.7 RES 清 除ROS 检 测
配制IR780:RES 浓度比为1:2/1:4/1:10/1:20 的系列溶液,并设定其中的IR780 浓度为50μg/mL。将DPBF 6 mg 溶解于2 mL DMF 中,在上述的IR780:RES 溶液400μL中加入30μL DPBF 溶液。在室温避光条件下,使用808 nm 激光器分别对IR780:RES系列溶液光照30 s 和60 s。然后加入DMF 定容至2 mL,用紫外分光光度计测量其在350~950 nm 范围的紫外吸收变化。
1.8 R780 及RES 的π-π堆叠效应验证
取200μL PD 及PHD 载药胶束分别以THF 及超纯水稀释至2 mL,用紫外分光光度计检测250~950 nm 范围的紫外吸收变化。

Fig.11H-NMR spectra of mPEG-Br(A),PHD(B)and PD(C)in V(CDCl3):V(CD3OD)=1:1,and their infrared spectra(D)
配制10μg/mL 的IR780 及RES 的THF 溶液及其两者的混合溶液。采用荧光分光光度计检测,激发波长为730 nm。
1.9 平板抗菌测试
使用106CFU/mL 的金黄色葡萄球菌液和大肠杆菌液,采用平板计数法计算抗菌率。 将PD@IR780&RES 和PHD@IR780&RES 用超纯水稀释至IR780 的浓度为50μg/mL 的溶液,每种胶束分成3组,记为L-1,L2-1,L3-1(L2-1 和L3-1 在与菌液混合前分别进行2 次和3 次808 nm 激光器照射30 s,每次照射结束后冷却5~10 min 再进行下一次的光照。然后将L-1,L2-1 和L3-1 分别与同体积的106CFU/mL 的菌液混合,并用808 激光器照射30 s)。取光照后的溶液10μL加至琼脂板上涂匀,培养12 h,检验杀菌效果。同时以空白胶束、载药非光照胶束以及106CFU/mL 的菌液与无菌水同体积混合液作为对照。
2 结果与讨论
2.1 聚合物表征
两亲嵌段聚合物PHD 及PD 的合成是以mPEG-Br为大分子引发剂,通过原子转移自由基聚合(ATRP)引发HEMA 和DEA 混合物或DEA 反应合成的。目标产物和大分子引发剂的核磁共振波谱和红外光谱如Fig.1 所示。
相比于大分子引发剂的谱图(Fig.1A),Fig.1B中δ3.80 处c 峰(—COOCH2CH2OH)和δ4.08 处d 峰(—COOCH2CH2OH)的出现,表明HEMA 的ATRP 反应成功。同时,δ2.65 处g 峰(—CH2N(CH2CH3)2)和δ1.11 处h 峰(—CH2N(CH2CH3)2)的出现,表明DEA 也成功共聚到产物中。δ3.40 处a 峰(CH3OCH2CH2O—)分别与δ3.80 处c 峰(—COOCH2CH2OH)和δ1.11 处h 峰(—CH2N(CH2CH3)2)积分,积分比为1∶50∶56,换算后得HEMA 聚合度为76,DEA 聚合度为28。Fig.1C 中,δ2.70 处d 峰(—COOCH2CH2N—),δ2.57处e 峰( —CH2N(CH2CH3)2)以 及δ1.04 处f 峰(—CH2N(CH2CH3)2)的出现表明PD 的合成成功,DEA 的聚合度为28。
红外谱图中,1726 cm-1处—C=O 伸缩振动吸收峰归属于聚乙二醇单甲醚酯;在3446 cm-1处—OH的伸缩振动吸收峰的出现,以及1281 cm-1处—C—N伸缩振动吸收峰的出现,表明以mPEG-Br 为大分子引发剂的HEMA 和DEA 的ATRP 反应成功。同理,PD 也出现了1281 cm-1处—C—N 伸缩振动吸收峰。综上,目标产物合成成功。
2.2 聚合物胶束性质
PHD 及PD 胶束的粒径及其分布、TEM 及其临界胶束浓度(CMC)曲线如Fig.2 所示。
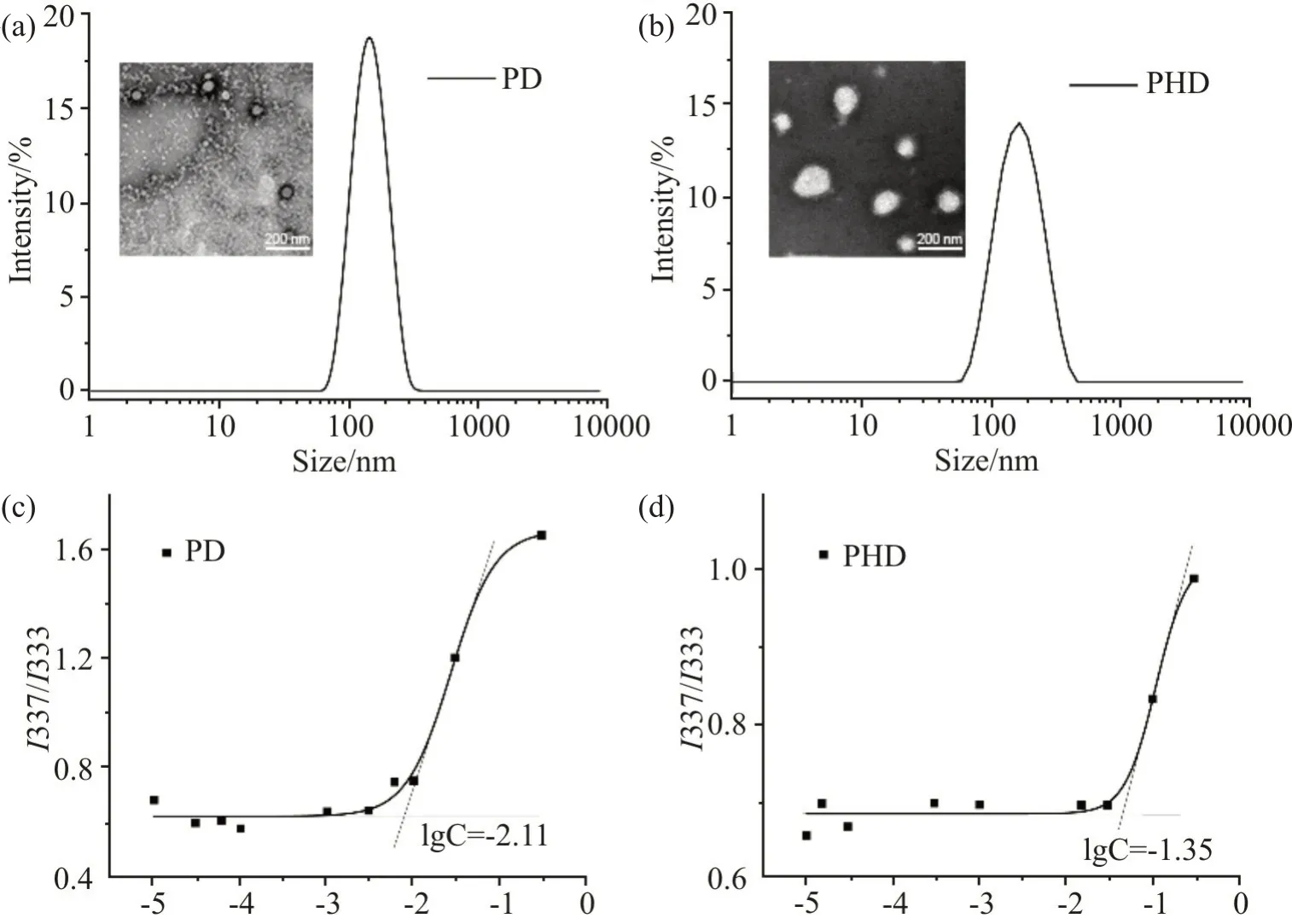
Fig.2 Particle size distribution and TEM (a, b), CMC curves (c, d) of PD and PHD micelles
DLS 结 果 显 示,PD 和PHD 为 单 峰 分 布。TEM显示,2 种胶束都具有类球形典型的壳核结构,但它们的粒径大小与DLS 测得的结果(Tab.1)有所不同。CMC 结果显示,PD 胶束的CMC 值比PHD 胶束的CMC 值小,分别为7.76μg/mL 和44.67μg/mL,这可能是因为HEMA 与DEA 无规共聚使胶束结构中的疏水部分P(HEMA-DEA)的疏水性降低,因而胶束PHD 不 如PD 稳 定。
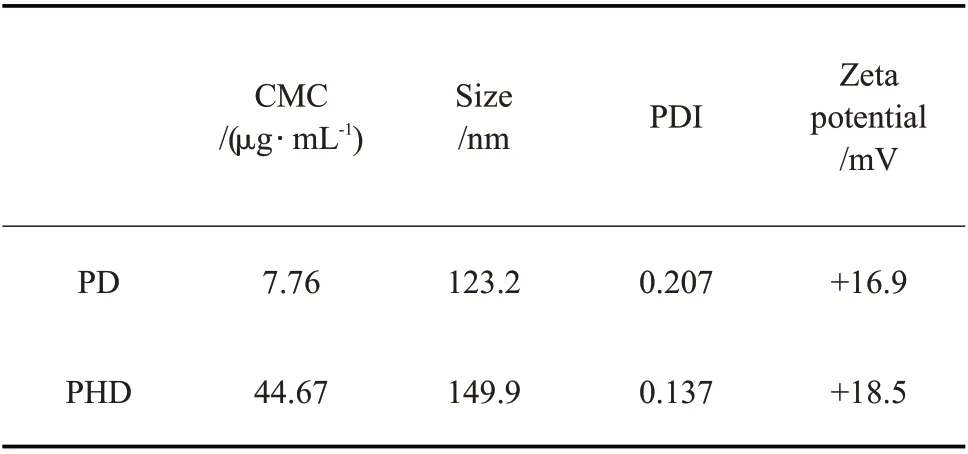
Tab. 1 Properties of blank micelles
如Tab.1所示,PD和PHD的平均粒径在120~150 nm,且粒径分布较窄,PDI 均在0.21 以下;pH 7.4 的表面电荷为+16~+19。正Zeta 电位是由于DEA 部分质子化,与文献报道相符[11,12]。胶束表面正电荷有利于胶束通过静电相互作用靶向细菌以及被细菌摄入。DLS 测得的是胶束的水合粒径,PD 和PHD 是水溶性较好的聚合物,所以水合粒径大于TEM 观察到的粒径。
实验中发现,PD 或PHD 单独包载IR780 或RES时,其载药量均较低。例如,PD 包载IR780(投药量为1 mg),IR780 的浓度仅有6.54μg/mL。当同时载IR780 和RES,则表现出不同的性质,如Tab.2 所示。当IR780:RES=1: 4 时,2 种药物在PD 胶束中的浓度接近1: 1,而在PHD 胶束中IR780 的浓度高于RES。随着RES 投药量增大,在胶束溶液中IR780药物浓度略微增加并在IR780 与RES 的比例为1:10时达到最大。该比例下,2 种胶束中RES 的药物浓度比为1: 4 比例时RES 的药物浓度的4 倍还多。2种载药胶束也在1: 10 呈现出IR780 和RES 最高载药量和包封率,此时的PDI 分别为0.27 和0.17。2 种药物不同投药比得到的载药胶束的粒径及其分布如Fig.3 所示。可以看到,IR780 与RES 比例为1: 4 或1: 10 时,2 种载药胶束均为单峰分布。1:10 的TEM 显示,2 类载双药胶束均呈现球形结构。故选取该比例时的2 种载药胶束用于后续实验。
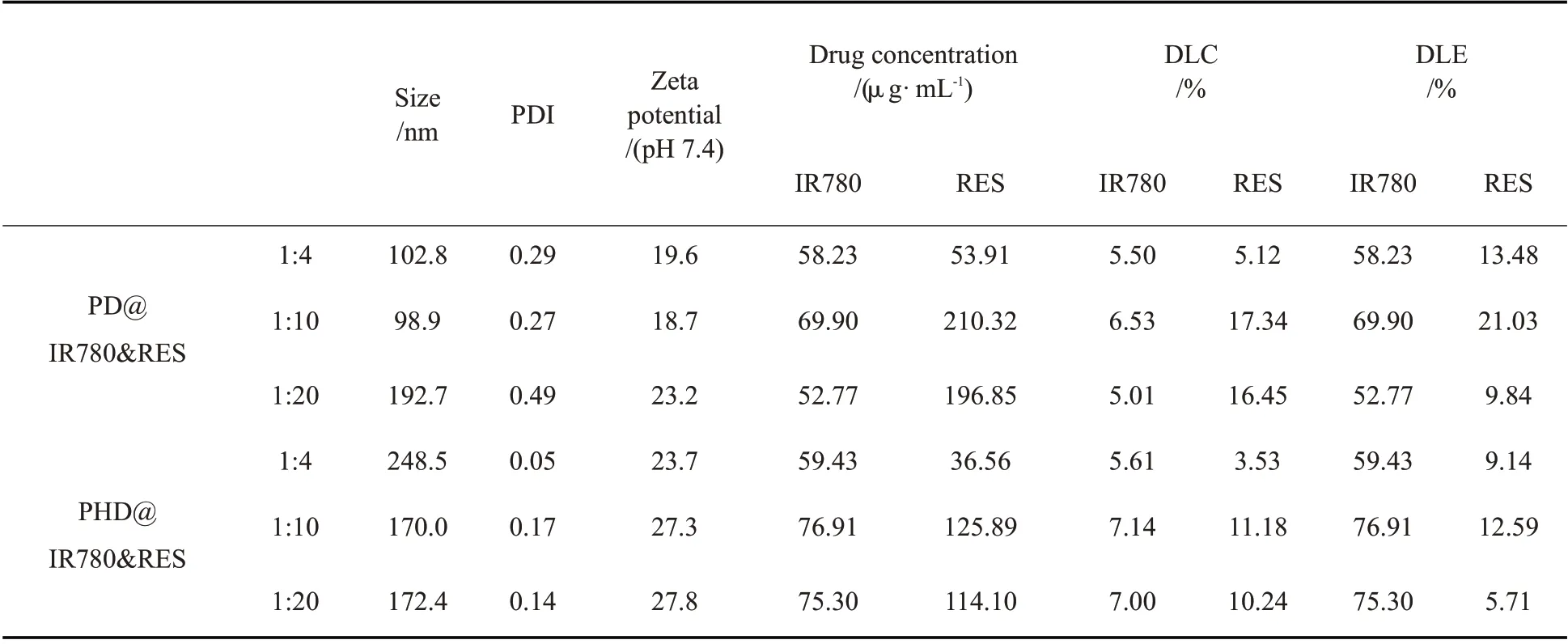
Tab. 2 Properties of two kinds of micelles with different dosage ratios
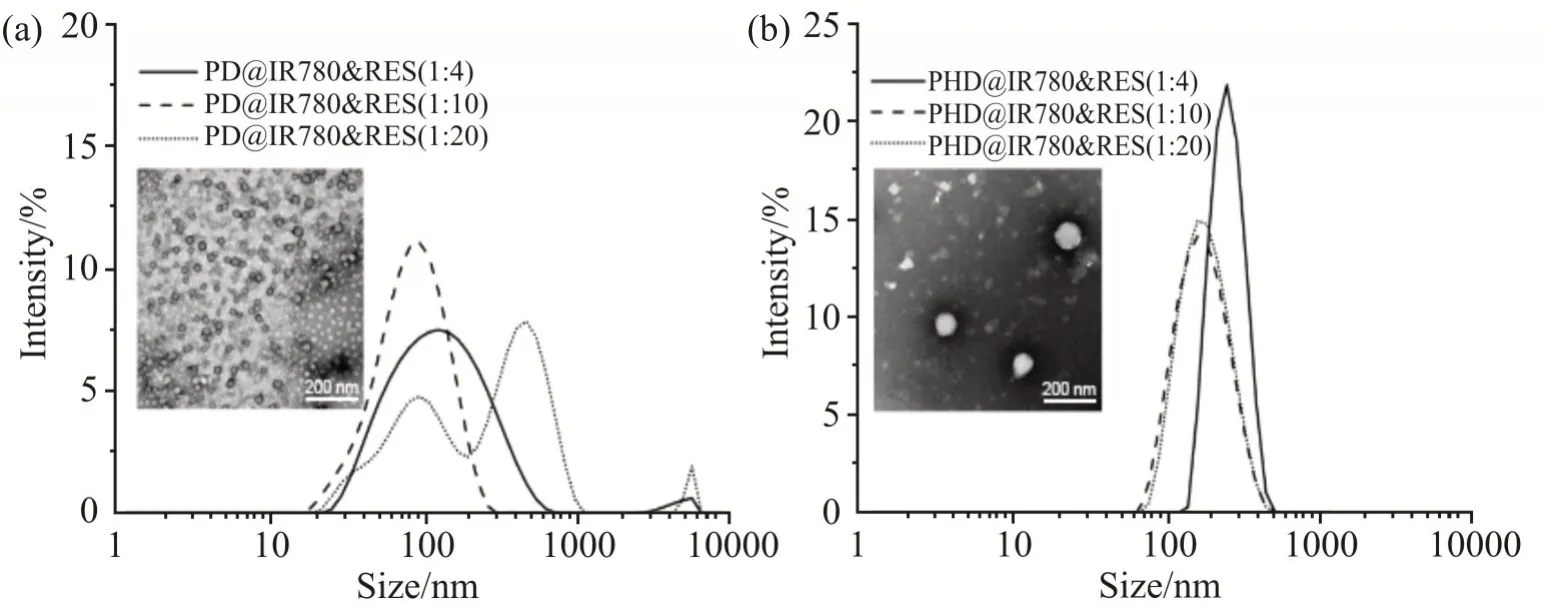
Fig.3 Particle size distribution curves of (a) PD@IR780&RES and (b) PHD@IR780&RES drug loaded micelles with different dosage ratios TEM showed the morphologies of two kinds of micelles with the ratio of 1:10
2.3 IR780 及RES 的 验 证
双载药胶束载药量显著提高可能是IR780 与RES 之间存在π-π堆叠效应。为了验证这种推测,将胶束分别用超纯水和THF 稀释并以IR780 的THF溶液为对照,测定紫外和荧光光谱(Fig.4)。结果显示,π-π堆叠效应PD@IR780&RES 在THF 中紫外吸收有蓝移现象,但是在水溶液中与IR780 的THF 溶液相比并没有位移,只是峰型变宽(Fig. 4a)。PHD@IR780&RES 则在THF 中并没有明显的位移现象,而水溶液中则表现出一定的红移,峰型同样也变宽(Fig. 4b)。这些位移现象表明RES 与IR780 具有π-π堆叠效应。RES 与IR780 在THF 中混合后的荧光效果如Fig.4C 所示,在780 nm 处的吸收峰相比于纯IR780 明显蓝移,说明两者间确实存在π-π堆叠。
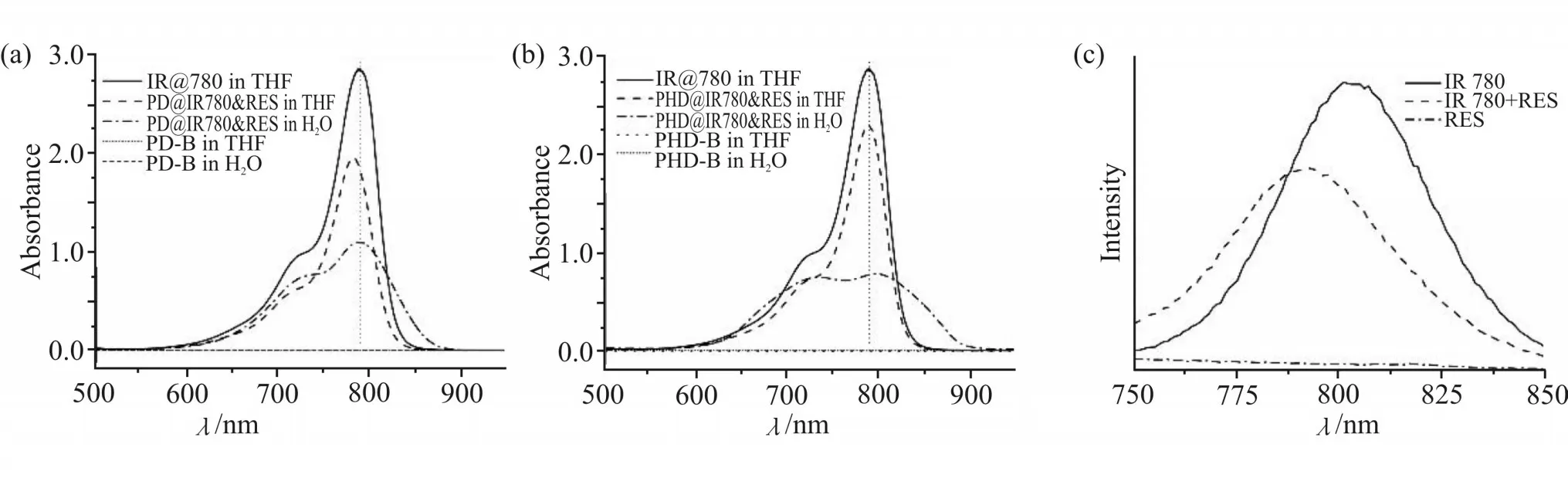
Fig.4 UV absorption spectra of IR780,blank micelles and drug loaded micelles(a,b);fluorescence spectra of IR780,RES and IR780+RES(c)
2.4 光照过程中ROS 的产生和清除
为了验证RES 清除ROS 的能力,加入活性氧探针DPBF 至不同比例的RES/IR780 溶液中,测定光照30 s 的紫外吸收,结果如Fig.5 所示。
冰浴、光照IR780/RES 溶液,各图谱的紫外吸收峰峰值没有发生太大变化,说明IR780 的分子结构未被破坏。文献报道[6],IR780 的光漂白机理是光照产生的ROS 加成至IR780 分子的双键上形成中间体,然后在热的作用下分解。由于没有热,光照的条件即使产生了ROS,也基本不会造成IR780 分子结构破坏。而室温下,IR780/RES 组在DPBF 的415 nm 处的峰以及IR780 在780 nm 处的吸收峰均比纯IR780 溶液的峰值更大,且随着RES 量的增大,效果越好(Fig.5b)。当光照时间从30 s 变为60 s,纯的IR780 溶液在415 nm 处的吸收峰进一步降低,表明光照产生了更多ROS(Fig.5c)。同时,780 nm 处的紫外吸收峰均比纯的IR780 溶液高,表明RES 确实能够通过吸收一部分ROS 来保护IR780 的分子结构。

Fig. 5 UV absorption spectra of different proportions of IR780/ RES solution under illumination
2.5 载药胶束ROS 测试
在载药胶束溶液中加入DPBF,测定不同光照次数后的紫外波谱图(Fig.6)。随着光照次数的增加,DPBF 和IR780 的吸收峰降低,说明产生的ROS更多(DPBF 峰下降),同时更多IR780 分子被破坏(IR780 峰下降)。2 种载药胶束相比,光照后PD@IR780&RES 在415 nm 处的DPBF 吸收峰强度仍然略高于PHD@IR780&RES,L3 和L4 时,有较为明显的差异,这表明胶束包载了更多的RES 的确更有利于清除ROS。
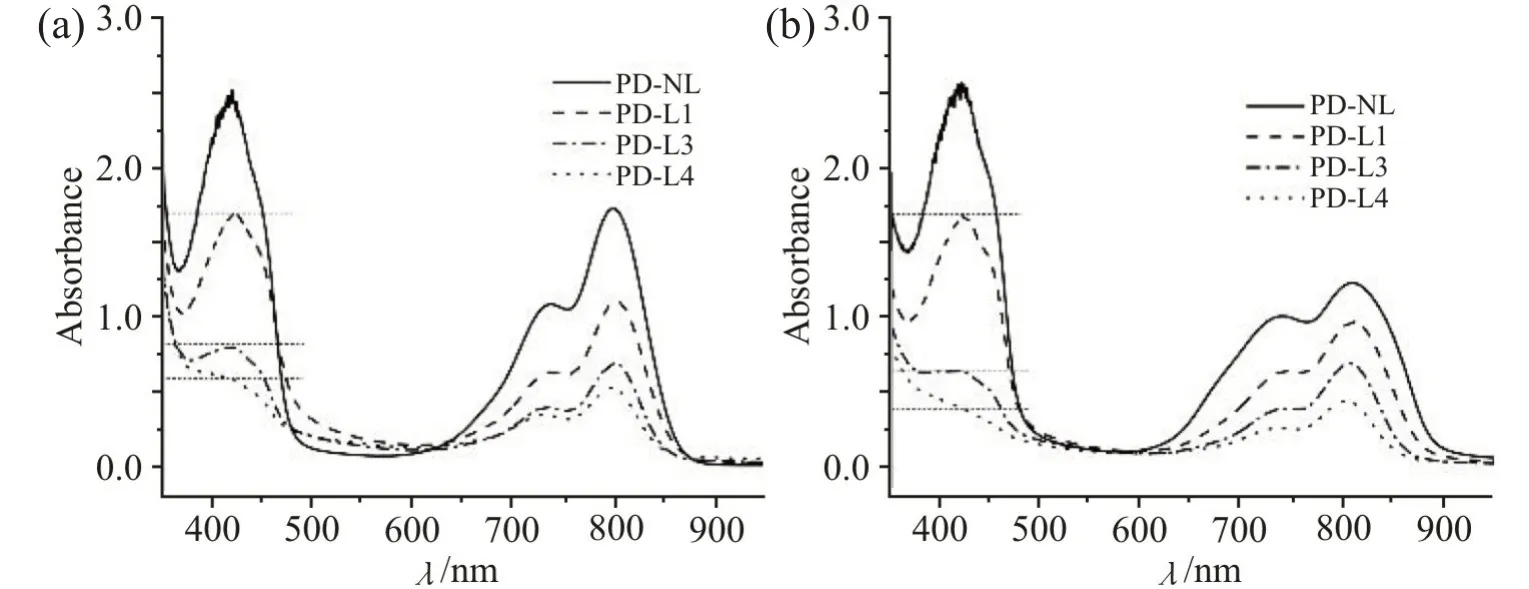
Fig.6 UV absorption spectra of the IR780/ RES loaded micelles added with DPBF before and after NIR laser irradiation
2.6 载药胶束光热性能
Fig.7 是 载 药 胶 束(PD@IR780&RES 以 及PHD@IR780&RES)的光热循环曲线和稀释液的光热曲线。
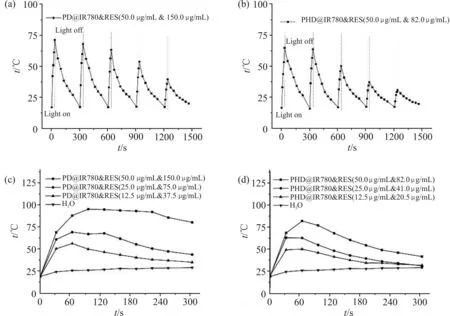
Fig.7 Photothermal cycling curves of two drug loaded micelles under 30 s illumination(50 μg/mL)(a,b)and photothermal curves under 5 min illumination after dilution(c,d)
载药胶束显示了良好的光热循环,第4 次以及第5 次光照时仍具有一定的光热效果(Fig.7a,Fig.7b)。这是由于胶束中的RES 在一定程度保护了IR780。对比2 种载药胶束的光热效果,从第3 次光照开始,PD 胶束明显地优于PHD 胶束,这可能是由于前者具有更高的RES 载药量,因而更好地保护了IR780 的分子结构。载药胶束及稀释液光照5 min 的光热曲线显示(Fig.7c, Fig.7d),2 种载药胶束随稀释倍数增加,能够达到的最高温度下降,但均高于纯水光照的最高温度。PD@IR780&RES 光热曲线的最大值达到95 ℃,而PHD@IR780&RES 是82 ℃,因此,PD@IR780&RES 确实具有更优的光热效果。
2.7 载药胶束抗菌性能
载药胶束对S.aureus和E.coli的平板抗菌结果如Fig.8 所示。激光器照射30 s 并不影响2 种细菌的生长。空白胶束与没光照的载药胶束的情况类似,对S.aureus和E.coli都有一定的杀菌作用,抗菌率分别为60 % 和20 %。对S.aureus更好抗菌效果源于细菌细胞壁的主要成分酸性多糖磷壁酸能够与胶束的阳离子结合,导致细菌死亡。引人注目的是,载药胶束光照杀菌率均在99 %以上(L-1 组)。说明PD@IR780&RES 及PHD@IR780&RES 中包载的光敏剂IR780 具有显著的光照杀菌性能。

Fig.8 Light sterilization effect of drug loaded micelles on S.aureus(a)and E.coli(b)and growth of bacteria on agar plate(c)
从前面的结果可以看到,光照过程中尽管RES对IR780 的结构有保护作用,然而依然部分地破坏了IR780 分子。为了验证近红外光照(NIR)后的载药胶束是否还具有足够的杀菌性,测定了预先光照2 次和3 次的载药胶束的光照杀菌(L2-1 和L3-1)能力,结果显示,它们的杀菌效果依然良好,高于99%。这也意味着,载IR780/RES 的胶束光照既可以杀死革兰氏阳性菌也可以杀死革兰氏阴性菌,而且还可以用于多次光照杀菌。Fig.8 C 直观地展示了琼脂板上细菌的生长情况。
3 结论
本文成功合成了具有细菌微环境响应性的两亲嵌段聚合物PHD 和PD,并将其制备成聚合物胶束用于包载IR780 和RES,进行了载药胶束的光照抗菌研究。PHD 和PD 均能够在水溶液中形成球形聚合物胶束,胶束表面电荷都呈现正电。PHD 和PD 都能够同时包载IR780 和RES,而且胶束包载双药的载药量远高于单独包载IR780 或RES 的载药量。通过改变投药比例制备得到了含RES 最高的载药胶束。紫外光谱验证了RES 可以改善IR780 的光 漂 白 现 象 。 在 PD@IR780&RES 或 者PHD@IR780&RES 中,RES 依然可以对光照的IR780起保护作用,并且,前者的光热循环效果更优一些。琼脂平板抗菌结果显示,2 种载药胶束可以重复光照杀菌,杀菌效果良好。

