MIL-53(Fe)/Bi2MoO6耦合过单硫酸盐降解酸性橙7
潘杰,莫创荣,许雪棠,任晓芳,谭顺,庞瑞林
(1.广西大学 资源环境与材料学院,广西 南宁 540000;2.广西大学 化学化工学院,广西 南宁 540000)

1 实验部分
1.1 试剂与仪器
Na2MoO4·2H2O、Bi(NO3)3·5H2O、NaOH、H2SO4、Na2S2O8、MB、C2H6O、CH3OH、EDTA-2Na、NaCl、Na2CO3、NaNO3、N,N-二甲基乙酰胺(DMF)、对苯二甲酸(H2BDC)、硝酸铁等均为分析纯;实验均采用去离子水。
BSA224S型分析天平;TG-16型台式离心机;DX-2700A型X射线衍射仪(XRD);Helios G4 CX型扫描电子显微镜(SEM);IRTracer-100型傅里叶变换红外光谱仪(FTIR);BL-GHX-V型光化学反应仪;UV-1800PC型紫外/可见分光光度计。
1.2 催化剂的制备方法
1.2.1 Bi2MoO6光催化剂的制备 通过水热法制备Bi2MoO6光催化剂。称取4 mmol Bi(NO3)3·5H2O加入到30 mL的去离子水中,磁力搅拌30 min。然后在上述溶液中加入2 mmol Na2MoO4·2H2O,磁力搅拌30 min,之后将溶液转移到100 mL聚四氟乙烯衬里的不锈钢高压反应釜中并在160 ℃下加热24 h。 在水热反应之后,自然冷却反应釜,离心收集制备得到的固体催化剂,用无水乙醇和去离子水交替洗涤数次,将产物在70 ℃空气中干燥12 h,最终得到淡黄色Bi2MoO6粉末,记为BM。
1.2.2 MIL-53(Fe)/BM复合催化剂的制备 通过溶剂热法制备MIL-53(Fe)/BM复合催化剂。将0.05,0.1,0.15 g上述制备得的BM分别加入在56 mL DMF中超声波10 min,然后加入0.674 g FeCl3·6H2O和0.415 g H2BDC,之后磁力搅拌1 h。接着将混合物转移至衬有100 mL聚四氟乙烯衬里的不锈钢高压反应釜,并在150 ℃下保持12 h。当反应釜自然冷却至室温时,通过离心依次用去离子水和甲醇交替洗涤数次,在甲醇中浸泡一夜后,然后依次用DMF和甲醇交替洗涤数次,之后在60 ℃下干燥12 h,最终得到0.05 MIL-53(Fe)/BM、0.1 MIL-53(Fe)/BM、0.15 MIL-53(Fe)/BM。在无BM条件下,制备出纯MIL-53(Fe)。
1.3 AO7的降解
在光化学反应仪中进行AO7降解实验,其中氙灯到石英试管的距离为8 cm,氙灯被双层石英冷阱包围。首先称取一定量的催化剂和量取50 mL 10 mg/L AO7溶液,均加入石英试管中。实验中pH除非另有说明,否则不调pH。经过磁力搅拌暗反应30 min之后,催化剂与AO7达到吸附-脱附平衡。将PMS加入石英管中,打开500 W氙灯开始反应。每隔10 min取4 mL溶液,通过0.45 μm水系滤膜过滤后,采用紫外可见分光光度计在484 nm处测溶液中AO7的吸光度。
2 结果与讨论
2.1 XRD表征及分析
图1给出了BM.MIL-53(Fe)及溶剂热法制备MIL-53(Fe)/BM的XRD图谱。

图1 不同催化剂的XRD图Fig.1 XRD patterns of different catalysts
由图1可知,对于纯MIL-53(Fe),XRD衍射峰结晶度相对BM较低,在9.2,10.6,12.6存在MIL-53(Fe)的主要特征峰[1],表明MIL-53(Fe)已经成功地制备。BM的特征峰2θ=10.90,23.52,28.25,32.61,33.10,47.15,55.56,58.43 °处分别对应于正交Bi2MoO6(JCPDS 72-1524)的(020)、(111)、(131)、(002)、(060)、(062)、(133)和(262)晶面[2-3]。BM的峰型比较尖锐,结晶度较高,并且未发现其它的特征锋,表明成功合成了高纯度的BM催化剂。0.05 MIL-53(Fe)/BM出现了BM的特征峰以及MIL-53(Fe)的9.2,10.6位置的特征峰,表明BM已成功引入MIL-53(Fe)。随着BM的复合量增加,MIL-53(Fe)的特征峰逐渐消失,主要原因是MIL-53(Fe)的相对含量较少;BM的特征峰逐渐增强,归因于反应时间增加,BM结晶度增加。结果表明,成功制备了BM、MIL-53(Fe)和MIL-53(Fe)/BM。
2.2 SEM表征及分析
由图2a,图2b可知,纯MIL-53(Fe)表现出均匀的八面体双锥形态,双锥体的表面粗糙,颗粒分布均匀且尺寸均一,与Zhang等研究结果一致[4]。图2c纯BM呈无序片状结构并且团聚在一起,具有平坦和光滑的表面,纳米片厚度约为100 nm。图2d表明合成的0.1 MIL-53(Fe)/BM复合催化剂的表面形态发生了变化。

图2 不同催化剂的SEM图Fig.2 SEM images of different catalysts a、b.MIL-53(Fe);c.BM;d.0.1 MIL-53(Fe)/BM
2.3 FTIR表征及分析
利用FTIR推断化合物的结构,红外光谱图可以体现出物质所含官能团的种类。通过FTIR光谱对BM、MIL-53(Fe)、0.1 MIL-53(Fe)/BM催化剂进行分析结果见图3。

2.4 不同体系对AO7的降解
当AO7初始浓度为10 mg/L,催化剂投加量为0.2 g/L,PMS浓度为1 mmol/L,初始pH为7.6,反应时间为60 min时,研究不同反应体系对AO7的降解,结果见图4。

图4 不同体系下AO7的降解Fig.4 Degradation of AO7 in different systems
由图4可知,AO7在仅有氙灯照射条件下,60 min 后无明显降解,表明AO7在氙灯照射下比较稳定。光/PMS对AO7的降解率为23%,PMS对AO7的氧化能力较差。光/0.1 MIL-53(Fe)/BM光催化降解率51%,表明催化剂的吸附和光催化对AO7的去除较低。光/BM/PMS体系中AO7的降解率为71%,比光/PMS和光/0.1 MIL-53(Fe)/BM体系的降解率高。光/MIL-53(Fe)/PMS体系中AO7的降解率为92%,比光/BM/PMS体系的降解率高。在暗/0.1 MIL-53(Fe)/BM/PMS体系中,AO7的降解率为90%,AO7降解率比光/0.1 MIL-53(Fe)/BM体系高。暗反应条件下,0.1 MIL-53(Fe)/BM中的Fe2+活化PMS产生活性物种,在40 min内可降解大量AO7,表明0.1 MIL-53(Fe)/BM可在暗条件下活化PMS。在光/0.1 MIL-53(Fe)/BM/PMS体系中,AO7的降解率高达99%,表明在光照下,催化剂0.1 MIL-53(Fe)/BM在PMS存在下可进一步促进AO7的降解,降解速率加快。可能原因是0.1 MIL-53(Fe)/BM催化剂在光条件下,产生电子-空穴对,直接降解污染物或者间接产生更多的活性物种,所以提高了对有机物的降解。在光照条件下,降解速率加快,并且可以促进催化剂中Fe3+/Fe2+的循环,有利于持续降解有机物。
2.5 不同反应条件的影响
2.5.1 不同催化剂复合比的影响 当AO7初始浓度为10 mg/L,催化剂投加量为0.2 g/L,PMS浓度为1 mmol/L,初始pH为7.6,光反应时间为60 min时,研究不同MIL-53(Fe)负载量对AO7的降解,结果见图5。
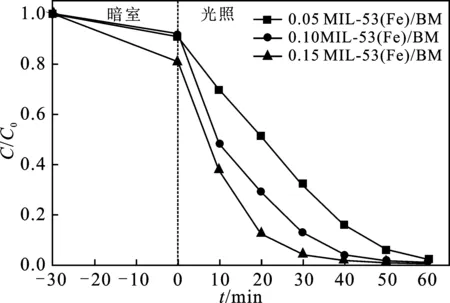
图5 不同催化剂复合比对AO7降解的影响Fig.5 The effect of different catalyst compound ratios on the degradation of AO7
由图5可知,在氙灯照射60 min后,0.05 MIL-53(Fe)/BM/PMS体系对AO7的降解率为98%,对AO7具有良好的降解性能。当BM增加后,0.1 MIL-53(Fe)/BM/PMS和0.15 MIL-53(Fe)/BM/PMS体系对AO7的降解率均为99%。虽然从UV-Vis DRS和PL分析表明0.1 MIL-53(Fe)/BM催化剂光学性能更好,但是在加入PMS后,可能PMS对AO7的降解作用更大。从实验结果和成本考虑,最佳催化剂复合比为0.1 MIL-53(Fe)/BM的催化剂。
2.5.2 PMS浓度对AO7降解的影响 当AO7初始浓度为10 mg/L,0.1 MIL-53(Fe)/BM投加量为0.2 g/L,初始pH为7.6,反应时间为60 min时,在光照射下,研究了光/0.1 MIL-53(Fe)/BM/PMS体系中不同PMS浓度对降解AO7的影响,结果见图6。
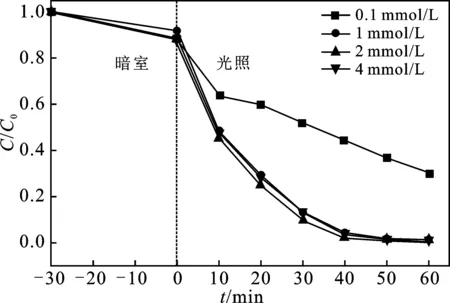
图6 PMS浓度对AO7降解的影响Fig.6 The effect of PMS concentration on the degradation of AO7
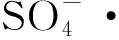
(1)
(2)
2.5.3 催化剂投加量对AO7降解的影响 在AO7初始浓度为10 mg/L,PMS浓度为1 mmol/L,初始pH为7.6,反应时间为60 min时,在光照射下,研究了光/0.1 MIL-53(Fe)/BM/PMS体系中不同催化剂投加量对降解AO7的影响,结果见图7。
由图7可知,0.1 MIL-53(Fe)/BM投加量由0.1 g/L增加至0.6 g/L时,AO7的降解率由92%增加至99%,降解率先增加后逐渐稳定。随着0.1 MIL-53(Fe)/BM 投加量的增加,吸附和反应位点增加,产生的自由基增加,故降解率增加[9-10]。当0.1 MIL-53(Fe)/BM为0.2 g/L时,降解率达到99%,降解效果较好。故选择0.1 MIL-53(Fe)/BM最佳投加量为0.2 g/L。
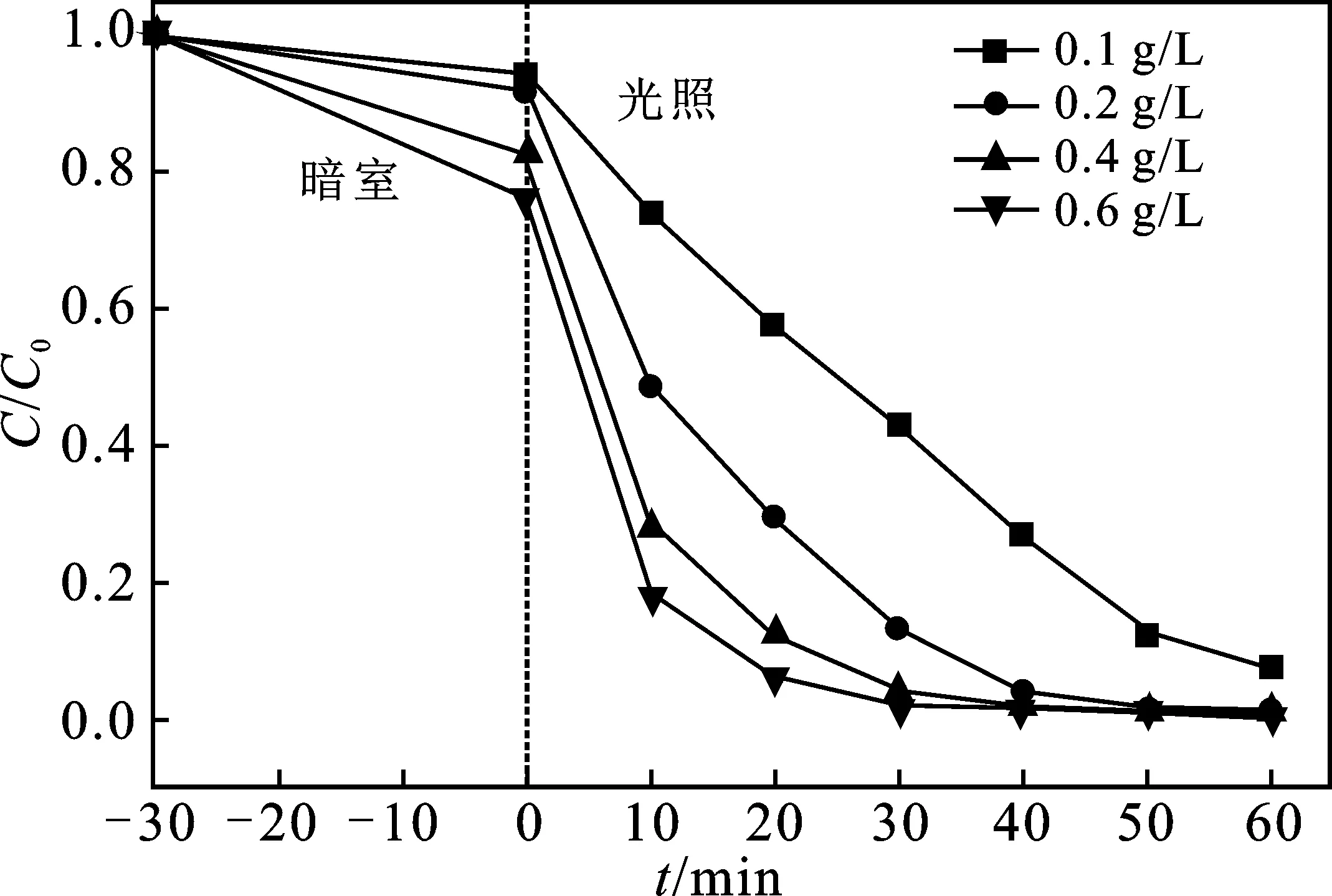
图7 催化剂投加量对AO7降解效果的影响Fig.7 The effect of catalyst dosage on the degradation effect of AO7
2.5.4 pH值对AO7降解的影响 在AO7初始浓度为10 mg/L、PMS浓度为1 mmol/L、0.1 MIL-53(Fe)/BM投加量为0.2 g/L、反应时间为60 min时,在光照射下,研究了不同初始pH溶液对光/0.1 MIL-53(Fe)/BM/PMS 体系降解AO7的影响,结果见图8。
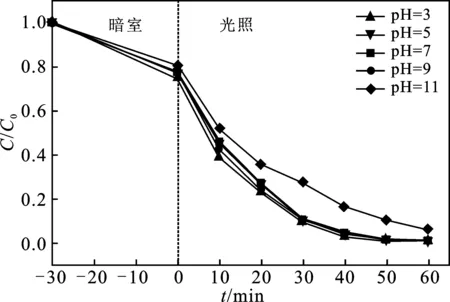
图8 溶液初始pH对AO7降解效果的影响Fig.8 The effect of the initial pH of the solution on the degradation effect of AO7
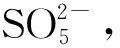
(3)
2.6 自由基捕获实验
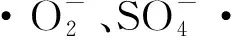
图9 自由基清除剂对AO7降解的影响Fig.9 Effect of radical scavengers on AO7 degradation

3 结论
(1)XRD、SEM、FTIR表征结果表明,通过简单的溶剂热法成功制备了MIL-53(Fe)/BM,其暗反应下可以活化PMS降解水中AO7,可作为活化PMS的催化剂。
(2)光/0.1 MIL-53(Fe)/BM/PMS体系在pH为3~11范围内均能高效降解水中AO7,具有较宽的pH反应范围。当AO7质量浓度为10 mg/L,PMS浓度为1 mmol/L,0.1 MIL-53(Fe)/BM投加量为0.2 g/L,溶液初始pH为7.6时,AO7降解率可达99%,光/0.1 MIL-53(Fe)/BM/PMS体系协同降解AO7性能较好。


