一株来自水库底泥的溶藻菌G2溶藻特性研究
袁轲婷,任大钧,万 琼,柴蓓蓓,康爱卿,雷晓辉,,陈 彬,陈 翔
1. 西安科技大学 建筑与土木工程学院,陕西 西安 710054
2. 河北工程大学/河北智慧水利重点实验室,河北 邯郸 056038
3. 河北工程大学 水利水电学院,河北 邯郸 056038
4. 中国水利水电科学研究院,北京 100038
5. 河北工程大学/水污染控制与水生态修复技术创新中心,河北 邯郸 056038
6. 上海勘测设计研究院有限公司,上海 200434
7. 中国长江三峡集团有限公司,湖北 武汉 430010
近年来,工农业的快速发展导致水体中氮(N)、磷 (P) 等营养元素过剩,使水体呈富营养化状态,导致藻华频发。中国的太湖[1]、长江中下游[2]、三峡水库[3]及北美的伊利湖[4]等均受到了有害藻华的困扰。根据2020年全国环境生态环境质量简况[5],在110个湖泊 (水库) 中,10个存在贫营养状态 (9.1%),68 个中营养状态 (61.8%),26 个轻度富营养状态 (23.6%),5个中度富营养状态(4.5%),1个重度富营养状态 (0.9%)。铜绿微囊藻(Microcystis aeruginosa) 作为引起水体藻华的主要藻种之一,通过产生微囊藻毒素和蓝藻毒素威胁环境生态和人类健康[6]。2007年太湖大部分水域爆发藻华,导致至少200万居民的饮用水供给中断1周[7],且在夏季太湖水域更易受藻毒素污染。托莱多是俄亥俄州靠近伊利湖的一个中型城市,2014年8月因藻华导致微囊藻毒素质量浓度 (3.19 μg∙μL−1) 超过安全饮用水标准 (1.00 μg∙μL−1),造成 40 万居民无饮用水[8]。
目前的除藻技术主要有物理法、化学法和生物法。物理法利用超声波法[9]、混凝气浮法[10]和高压除藻法[11]等手段去除水体内的藻类,虽然除藻效果明显,但经济性较差,且可能引发公共健康等问题,因而不适用于大面积的水体治理;化学法采用硫酸铜[12]和过氧化氢[13]等手段,通常用于处理小水体中的蓝藻,但硫酸铜会导致细胞内微囊藻毒素释放到周围的水体中,造成金属化合物的二次污染,也影响生物多样性及恶化富营养化,处理成本高;生物法已被证明是一种环境友好型且很有应用前景的除藻技术[14-15]。目前研究集中在生物制剂的使用上,尤其是藻类细菌。已从自然生态系统中分离出多种溶藻菌类型,包括假单胞菌属 (Pseudomonassp.)[16]、噬胞菌属 (Cytophagasp.)[17]、腐生螺旋体属 (Saprospirasp.)[18]、交替单胞菌属 (Alteromonassp.)[19]、交替假单胞菌属 (Pseudoalteromonassp.)[20]、柠檬酸菌属 (Citrobacersp.)[21]、弧菌属 (Vibriosp.)[22-23]和芽孢杆菌属 (Bacillussp.)[24]等。
本研究从陕西省某水库的底泥中分离出一株对铜绿微囊藻具有溶解作用的菌株G2,并通过16S rDNA测序和系统发育分析对其进行鉴定,同时探究了不同条件 (生长周期、温度、pH和光照强度)下,G2对铜绿微囊藻的溶藻活性,以期为G2实际应用提供理论依据。
1 材料与方法
1.1 材料
1.1.1 藻种培养
铜绿微囊藻 (FACH-905) 由中国科学院淡水藻种库提供,将藻种接种到BG-11液体培养基,置于25 ℃、光照强度 2 500 lx、光周期 12 L∶12 D 的光照培养箱内培养备用。
1.1.2 菌种培养
从陕西省西安市某水库的底泥中分离出一株具有溶藻效果的菌株G2,将其接种到高氏一号固体培养基上,置于25 ℃的恒温培养箱内保存备用。
1.2 方法
1.2.1 溶藻菌的分离鉴定
将西安市某水库采集的底泥带回实验室后加入超纯水中置于恒温振荡仪内,在25 ℃下以200 r·min−1的速率振荡 48 h,振荡后底泥溶液逐级稀释,用稀释涂布法对样本中的菌株挑选培养后筛出菌株,将其分离纯化在固态平板培养基上,观察其形态特征,并进行记录。然后将菌株制备成液体培养基,分别将其按一定比例投加至装有藻液的平板培养基内,进行72 h的溶藻实验观察。先进行初筛,将藻液出现黄化现象的菌株留下,并将其投加至预先培养14 d的铜绿微囊藻藻液的平板培养基内,7 d后计算各菌株除藻率,将除藻率较高的菌株作为本实验菌种。利用16S rDNA技术对该溶藻菌的序列进行鉴定。用引物27F (5-AGAGTTTGATCCTGGCTCAG-3) 和 1492R (5-CTACGGCTACCTTGTTACGA-3) 进行PCR扩增。PCR扩增程序:95 ℃ 预变性 5 min;95 ℃ 变性 30 s,58 ℃退火 30 s,72 ℃ 延伸 1 min 30 s,35 个循环;72 ℃终延伸 7 min。PCR扩增产物经纯化后测序。所得序列在国家生物技术信息中心 (NCBI) 中进行比对,并构建系统发育树。
1.2.2 溶藻菌生长曲线测定
在无菌操作台内,采用接种环挑取少量在固态培养基内长势良好的溶藻菌,接种至LB液体培养基内,将其置于 25 ℃、200 r·min−1的摇床内进行培养。每隔12 h测定其在600 nm处的吸光度(OD600),连续测定7 d,以OD600为纵坐标,时间t为横坐标,绘制溶藻菌的生长曲线,每个实验组设置3组平行。
1.2.3 叶绿素与除藻率测定
采用乙醇萃取法测定藻类叶绿素a质量浓度[25],除藻率Ra(%) 的计算方法[26]为:

式中:C0表示初始藻液叶绿素a质量浓度 (mg·L−1);Ct表示最终藻液叶绿素a质量浓度 (mg·L−1)。
1.2.4 溶藻菌的溶藻方式
将该溶藻菌用接种环接种至液体培养基内,培养 72 h 后以 2 000 r·min−1的转速将菌液离心15 min,采用0.22 μm无菌纤维素微孔滤膜分离菌细胞和上清液,以10%投加比例将菌细胞及上清液分别加入预培养2周相同状况的铜绿微囊藻藻液,进行8 d的溶藻实验,每隔2 d测定叶绿素a质量浓度,计算除藻率,每个实验组设置3组平行。
1.2.5 生长期对溶藻效果的影响
根据溶藻菌的生长曲线,分别取延滞期、对数期、稳定期和衰亡期的菌液,以5%的投加比分别加入至预培养2周、生长状况一致的铜绿微囊藻藻液内,在 25 ℃、2 500 lx、12 L∶12 D 光周期条件下进行8 d的溶藻实验,每隔2 d测定叶绿素a质量浓度,计算除藻率,每个实验组设置3组平行。
1.2.6 投加比例对溶藻效果的影响
将溶藻菌株在LB液体培养基中培养72 h后,取菌液,按照体积比2%、5%、10%、15%分别加入至200 mL预培养2周、生长状况一致的铜绿微囊藻藻液内,并以加入相同体积比、未含溶藻菌菌液的 LB 液体培养基为对照组,在 25 ℃、2 500 lx、12 L∶12 D光周期条件下进行溶藻实验,共进行8 d,每隔2 d测定叶绿素a质量浓度,计算除藻率,每个实验组设置3组平行。
1.2.7 pH 对溶藻效果的影响
将该菌株的无菌滤液用氢氧化钠 (NaOH) 与氯化氢 (HCl) 溶液调节 pH 至 3、5、7、9 和 11,在每个pH下保持1 h后将pH调至初始值。按照体积比为2%,将处理过的无菌滤液接种到相同条件预培养2周的铜绿微囊藻藻液内,待无菌滤液与藻液反应72 h后测定藻液叶绿素a质量浓度,计算除藻率,每个实验组设置3组平行。
1.2.8 温度对溶藻效果的影响
将该菌株的无菌滤液分别在5 (冰箱冷藏1 h)、25 、50 、75 ℃ 水浴中加热 1 h,并 120 ℃ 高温灭菌 30 min,然后将滤液置于室温 (25 ℃) 中,待无菌滤液温度上升或下降至室温后,按照体积比2%,将处理过的无菌滤液接种至相同状况的预培养2周的铜绿微囊藻内,待无菌滤液与藻液反应72 h后,测定反应后的藻液叶绿素a质量浓度,计算除藻率,每个实验组设置3组平行。
1.2.9 光照时间对除藻率效果的影响
取处于对数生长期的溶藻菌菌液,以5%的体积比加入至预培养2周的铜绿微囊藻藻液内,控制其光周期分别为 0 L∶24 D (全黑暗)、12 L∶12 D和 24 L∶0 D (全光照),光照强度为 2 500 lx,温度为25 ℃。每个光暗比下设置3个平行,进行溶藻实验,共进行8 d,每隔2 d测定叶绿素a质量浓度,计算除藻率,每个实验组设置3个重复。
1.3 数据统计
本实验数据采用 Excel 2010 和 Origin 2017 软件进行分析与绘图,系统发育树使用MEGA 7软件进行绘制。
2 结果
2.1 溶藻菌的筛选与鉴定
2.1.1 溶藻菌的筛选
经初筛和复筛后分离出1株对铜绿微囊藻有稳定溶藻效果的细菌,菌株命名为G2,作为本实验的试验菌株。G2呈橘色,表面有凸起状,边缘规则 (图1)。

图1 菌株G2的菌落Fig. 1 Colony of Strain G2
2.1.2 溶藻菌 16S rDNA 鉴定对分离出的G2进行16S rDNA鉴定,测得其序列长度为1 387 bp。将所测序列在NCBI中进行比对,并使用MEGA软件对该菌株进行同源性分析并构建系统发育树 (图2),发现G2与纤维弧菌属 (Cellvibriosp.) 的菌株相似性大于 98%,并将该菌株序列上传至GenBank,获得登录号MW221316。
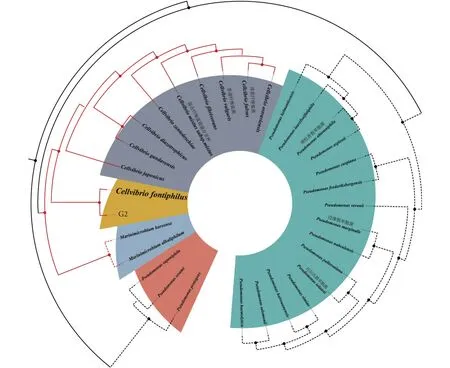
图2 基于16S rDNA基因序列构建的菌株G2系统发育树Fig. 2 Constructed phylogenetic tree of Strain G2 based on 16S rDNA gene sequence
2.2 溶藻菌 G2 生长曲线
根据细菌悬液浓度和光密度成正比[27],通过分光光度计测定菌剂在600 nm下的吸光度,得到G2的生长曲线 (图3),测得其延滞期为0~36 h,对数期为 36~72 h,稳定期为 72~84 h,84 h 后进入衰亡期。

图3 溶藻菌G2生长曲线Fig. 3 Growth curve of Strain G2
2.3 溶藻菌 G2 的溶藻方式
本研究将菌剂离心处理后,通过滤膜过滤,将无菌滤液和菌细胞分离后分别加入至铜绿微囊藻藻液内,结果见图4。G2上清液和菌细胞处理组在第8天的平均除藻率分别达 (52.43±2.20)%和(13.01±0.57)%,上清液的溶藻效果明显优于菌细胞本身,说明其分泌溶藻物质去除藻,也通过自身溶解藻细胞。菌体本身对藻类表现出有一定的去除效果,可能是因为菌体投入至藻液后自身释放出少量的抑藻活性物质所致。而对照组 (CK) 并未出现藻细胞溶解的现象,该组藻细胞仍处于生长状态。推测该细菌是通过分泌具有溶藻效果的胞外物质对铜绿微囊藻进行溶解,而不是通过菌细胞本身,因此G2的溶藻方式为间接溶藻。

图4 菌株G2的溶藻方式Fig. 4 Algicidal mode of Strain G2
2.4 溶藻菌 G2 的溶藻特性
2.4.1 不同生长期 G2 的溶藻效果
不同生长周期G2溶藻效果见图5。不同生长周期G2在第8天均达到最大除藻率,稳定期为(56.72±1.17)%,分别比对数期、衰亡期和延滞期高 (14.03±1.33)%、(4.29±1.46)% 和 (38.31±2.55)%。稳定期获得最佳的除藻效果,可能是溶藻菌从对数期后分泌具有抑藻效果的胞外物质大于延滞期所分泌的胞外物质。此外,选用该菌的稳定期进行溶藻实验,在处理后第4天相对于其他3个阶段有较大幅度的提升,第 2—第 4 天该菌株在延滞期、对数期、稳定期和衰亡期除藻率分别提升了 2.80%、7.14%、17.63% 和 14.84%,稳定期的菌株在反应第4天的除藻率达42.02%,因此该菌株适合将稳定阶段的菌液投加进行溶藻,可在短期内获得较好的效果。

图5 不同生长期下菌株G2的溶藻效果Fig. 5 Algicidal effect of Strain G2 at different growth stages
2.4.2 投加比例对溶藻效果的影响
不同投加比例下G2溶藻效果见图6。G2的菌液随着投加比例 (V/V) 的增加,对铜绿微囊藻的去除效果逐渐提升。分别以2%、5%、10%和15%的投加比例加入至铜绿微囊藻,第8 天各组平均除藻率分别达 (26.9±2.31)%、(39.79±1.41)%、(54.32±0.40)% 和 (54.97±1.87)%。投加比例是反映细菌密度的重要参数,初期的投加比例越高,其溶藻效果越显著。投加比例为15%时,第2—第4天的48 h内除藻率增长速率高于其他组别。该菌株的最佳投加比例为10%,在10%和15%的投加比例组分别处理藻细胞8 d后,其去除效果基本一致,均约54%,因此过多投入菌剂对溶藻效果并无明显提升。

图6 不同投加比例下菌株G2的溶藻效果Fig. 6 Algicidal effect of Strain G2 with different proportions
2.4.3 pH 对溶藻效果的影响
不同pH下除藻率均随着培养时间的增加而增大 (图7)。培养至第4天时,除藻率随着pH的增大呈先增后减的趋势,pH为7时获得最大除藻率(47.46±1.63)%。第 8天,pH 3、5、7、9、11组的除藻率分别为 (53.80±1.02)%、(56.92±1.44)%、(55.96±4.22)%、(54.43±2.03)% 和 (53.38±2.18)%,说明G2在不同pH下溶藻能力差异性较小,具有良好的耐酸碱性,对于偏酸性和偏碱性的水体有较强的适用性。
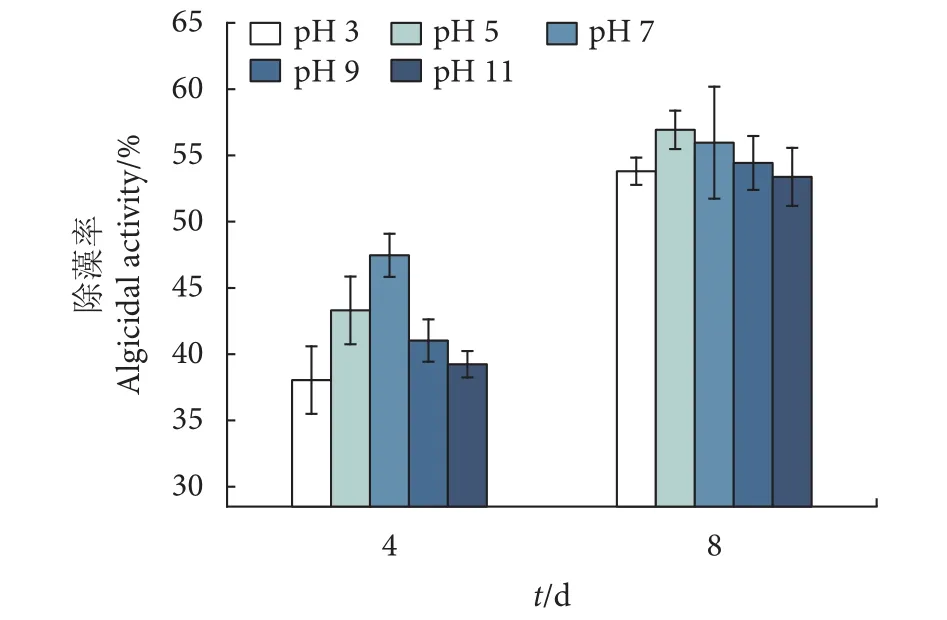
图7 不同pH下菌株G2的溶藻效果Fig. 7 Algicidal effect of Strain G2 with different pH
2.4.4 温度对溶藻效果的影响
不同温度下除藻率均随着培养时间的增加而增大 (图8)。第8天,温度5、25、75和120 ℃的溶藻能力均达最大,除藻率分别为 (59.42±0.88)%、(63.10±1.42)%、(29.45±0.91)% 和 (11.54±0.79)%。该菌株的无菌滤液对温度有一定的敏感性,当温度高于75 ℃,其溶藻效果衰退严重,120 ℃处理后,第8天的除藻率仅比第2天增长4.12%。

图8 不同温度下菌株G2的溶藻效果Fig. 8 Algicidal effect of Strain G2 at different temperatures
2.4.5 光照时间对溶藻效果的影响
不同光照下的除藻率随培养时间的增加而增大(图9)。在全黑暗条件下,培养初期 (第2—第4 天) 除藻率骤增,培养末期 (第 6—第 8 天) 除藻率增幅较小,在第8天达最大值 [(53.50±1.08)%];在全光照和12 L∶12 D条件下的除藻率与全黑暗的变化趋势相同,均在第8天达最大值,分别为(52.05±1.48)%和 (53.63±1.21)%,但三者的除藻率差异较小,说明该菌株对光照不敏感,光周期的改变对除藻率无明显的影响,因此其具有更广泛的适用性。

图9 不同光照下菌株G2的溶藻效果Fig. 9 Algicidal effect of Strain G2 under different light conditions
3 讨论
本研究从陕西省西安市某水库底泥中分离出一株具有溶藻功能的菌株G2,经16S rDNA鉴定,其与纤维弧菌属的序列相似度达98%以上。通过实验得出其最高除藻率可达60%以上。
溶藻细菌对藻细胞去除的作用方式大致有2种[28]:1) 溶藻菌直接作用于藻细胞,侵入藻细胞内部对藻细胞进行分解。Li等[29]发现了一株可以产生几丁质酶的菌株 (LY03),由于几丁质包裹着硅藻细胞,该菌株所产生的几丁质酶可以直接溶解硅藻的细胞壁,这也是首次发现几丁质酶对硅藻的溶解效果;2) 细菌为了繁殖与藻类在同一环境下竞争营养物质或分泌某种胞外物质进行溶藻。约70%的溶藻菌为间接模式溶藻。蛋白质、肽、氨基酸等是溶藻细菌产生的常见溶藻化合物[30-31]。石新国等[32]从海洋中分离出了一株交替单胞菌属的溶藻菌FDHY-C3,该菌株通过产生胞外具有溶藻功能的分泌物进行溶藻。Wang和Coyne[33]从特拉华州内陆湾分离出一株溶藻菌希瓦氏菌IRI-160,其通过分泌水溶性化合物来抑制鞭毛藻生长,且具有一定的专一性,对水体内的其他藻类无影响。从2.2的实验结果可知,G2的上清液显示出较高的溶藻活性,表明G2通过间接攻击表现出溶藻作用。细菌细胞在不与藻类细胞接触的情况下也能产生溶藻物质,溶藻物质对藻类生长具有抑制作用。
G2随着培养时间延长除藻效率提升,且处于对数增长期的菌液,其达到最佳除藻率相较于稳定期和衰亡期的菌液相对滞后,这可能是由于其形态及生理活性对于外界的环境因素相对敏感,而处于稳定期和衰亡期菌株的内部溶藻活性物质累积量高于其他生长阶段[34]。该菌株稳定期的除藻效率较高。Kong等[35]发现溶藻细菌HJC-D1随投加比例从1%增至10%,除藻率增加了 (63.2±2.41)%,但投加比例为5%和10%的除藻率相差不大。本研究中溶藻细菌G2的溶藻效果也反映了该趋势。当低投加比例菌液接种至藻液中时,菌液对藻细胞只起到轻微抑制作用,而高比例投加菌液更有利于提升其溶藻效果。但若超过最大投加比例,溶藻能力将不再增加。当投加比例为10%和15%时,除藻率分别为 (54.32±0.40)% 和 (54.97±1.87)%。原因可能在于投加比例的增加使单位体积内含有更多的溶藻物质,藻类与溶藻物质的接触概率进一步增加,除藻率随之提升[36]。
Zhang等[37]分离出一株具有高杀藻活性的菌株RPS,其上清液的溶藻活性对50 ℃及以上温度敏感,对pH (3~11) 不敏感。Yu等[38]分离出菌株HG-16,其溶藻活性在pH 3~11 稳定,表明该物质具有耐酸碱性。温度≤75 ℃处理2 h,除藻率无显著变化,在121 ℃处理2 h后,除藻率降至52.3%。本研究G2与PRS、HG-16在一定的温度和pH条件下溶藻特性一致。与5和25 ℃相比,G2在75和120 ℃下除藻率降低,但在pH 3~11 除藻率变化不大。推测也可能存在非蛋白的新溶藻物质,该物质对温度敏感但对pH不敏感。Zhang等[39]在中国湖南省分离到一株金黄杆菌,其除藻率在pH 7时达到最大值 (70.3%),在pH 9时降低至31.0%。杨冰洁等[40]分离出一株溶藻菌 CBA02,该菌株在较强酸性 (pH 2) 条件下除藻率低于5%;而在较强碱性条件下,除藻率可达90%以上。部分菌株在特定pH条件下具有较好的溶藻活性,而本研究G2具有较好的耐酸碱性,表明G2对不同类型的水体有较强的适应性。今后,可考虑分析其具有溶藻效果的组成成分,通过化学合成的手段人工制造更多的溶藻有效物质,以期为人工除藻剂提供多元化的手段。
4 结论
从陕西省西安市某水库底泥中分离出具有溶藻功能的菌株G2,菌落呈现橘色,表面有凸起状,边缘规则。经16S rDNA鉴定与纤维弧菌属序列相似度为98%以上。
1) G2通过产生胞外溶藻活性物质对藻类生长进行抑制,溶藻方式为间接溶藻。G2稳定期的菌液对藻类去除效果最佳。
2) 溶藻效果随投加比例的增加而提升,投加量大于10%时溶藻效果提升较慢;对75 ℃及以上的温度敏感,温度为25 ℃时除藻率最高 [(63.10±1.42)%];对pH 3~11不敏感,pH 5时除藻率最高[(56.92±1.44)%],且光照与G2溶藻效果的相关性较小。
3) G2对藻类暴发地适应性较强,水体治理过程中不存在外来物种带来的水体扰动及二次污染等问题。

