华南背景山区云中草酸的形成机制及影响因素
蔡晓銮,孙 伟,张国华,胡晓东,郭子雍,毕新慧*,王新明
1. 中国科学院广州地球化学研究所,有机地球化学国家重点实验室,广东省环境资源利用与保护重点实验室,广东 广州510640
2. 中国科学院深地科学卓越创新中心,广东 广州 510640
3. 中国科学院大学,北京 100049
4. 粤港澳大湾区环境污染过程与控制联合实验室,广东 广州 510640
草酸(C2)是大气有机气溶胶的重要组成部分,是全球范围内浓度最高的二羧酸[1-3],也是WSOC(水溶性有机碳)的重要组分[4]. 观测结果[5-6]表明,草酸最高可占WSOC 的3%. 草酸对气溶胶酸度、吸湿性、成云活性和二次有机气溶胶的生成有显著影响[7]. 此外,草酸对过渡金属铁以及金属钙的溶解度、光化学活性和生物可利用性等也有较大影响[8-9].
目前,已有研究在城市[10]、高山[11]、海洋[2]、极地[12]和农村/郊区[13]等环境测定了气溶胶中的草酸.尽管草酸可以来自一次源,如生物质燃烧[14]、汽车尾气[15]和自然海洋源[16],但其主要还是通过二次氧化途径生成[17],其中液相氧化是草酸生成的重要途径[18]. 影响草酸液相生成的前体物主要有直链饱和二羧酸(C2~C9)、支链饱和二羧酸(iC4,甲基丙二酸)和多官能团羧酸〔苹果酸(hC4)、丙酮酸(Pyr)和乙醛酸(ωC2)〕等[19-20].
研究[21]发现,云内氧化是草酸形成的主要途径.Sorooshian 等[22]通过飞机观测发现,云间隙颗粒物中草酸盐的浓度比无云颗粒物高. 在我国泰山[23]、香港大帽山[24]等地区的云水中均检测到二羧酸类物质.Zhang 等[17]也发现,中国大陆云中液相过程对草酸生成的重要性. 实验室模拟研究[7,14,25-28]发现,云水的液态水含量、温度,云水/颗粒物中NH4+、NO3—、Ca2+和水溶性铁等物质的浓度,以及云水/颗粒物的pH 等均会影响草酸的形成.
华南地区云覆盖率平均值为69.46%[29],远高于华北地区[30]. 笔者所在团队通过单颗粒气溶胶质谱在华南背景山区在线观测了无云期间和云事件期间颗粒的混合状态,定性地发现了云中液相反应可以促进草酸的形成,特别是在老化的生物质燃烧颗粒和含铁颗粒上[31]. 但是,云中过程形成的草酸浓度究竟有多高,影响草酸形成的主要因素有哪些,目前还缺乏认识.
因此,该研究在华南背景山区采集了云间隙颗粒物样品和云水样品,采用GC-MS (气相色谱-质谱仪)测定了样品中的草酸及其可能的前体物,通过对比同一时段采集的云水和云间隙颗粒物,研究云过程对草酸生成的影响,探讨影响云中草酸形成的主要因素,以期为深入认识草酸的大气化学过程提供数据支撑.
1 材料与方法
1.1 样品采集
采样地点位于广东省韶关市天井山观测站(112°53′56″E、24°41′56″N, 海拔1 690 m),该站点远离人为活动源,主要受当地生物源排放和长距离传输的影响. 采样时间为2020 年11 月14 日—12 月2 日.采样期间风速、相对湿度和温度分别为0.6~7.8 m/s、62.0%~93.4%和1.3~18.2 ℃. 采样期间,云事件5 次,共采集云水样品31 个、云间隙颗粒物样品8 个.
云水样品使用CASCC2 云雾水收集器(Colorado State University, 美国)采集[32]. 云事件的判别标准:能见度≤200 m,相对湿度≥95%,且无降雨. 采样过程中,采样器后方的风扇驱动云滴进入采样器,在特氟龙绳上凝结,凝结的云水通过采样器底部的特氟龙管流入预先清洗好的样品瓶中. 采样后的云水样品立即通过0.22 μm 的石英滤膜过滤以去除不溶性组分,云水的pH 通过pH 计(Mettler Toledo, 瑞士)测定,随后放入—20 ℃冰箱中待分析.
采样过程中云水的液态水含量的计算公式:
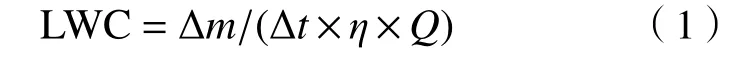
式中:LWC 为液态水含量,g/m3;Δm为样品的质量,g;Δt为采样的间隔,min;η为采样效率,%,对粒径大于3.5 μm 的云滴,η取86%;Q为CASCC2 云雾水收集器的流量,该研究中取5.8 m3/min.
云事件期间,同时使用流量为300 L/min 的采样器(PM-PUF-300 型, 广州铭野环保科技有限公司)收集云间隙PM2.5颗粒. 在采集之前,所用的石英滤膜(Whatman, 英国)在马弗炉中450 ℃下焙烧4 h,以去除潜在的有机物干扰.
1.2 样品分析
1.2.1 草酸及其他二羧酸类物质的分析方法
该文分析的目标化合物包括直链饱和二羧酸(C2~C9)、支链饱和二羧酸(iC4~iC6)、不饱和二羧酸〔马来酸(M)、富马酸(F)、柠康酸(mM)〕、多官能团羧酸〔苹果酸(hC4)、丙酮酸(Pyr)和乙醛酸(ωC2)〕. 分析方法参考文献[33-34].
试验前将置于—20 ℃的云水样品取出,常温下解冻;每个云水样品各取20 mL,分别加入2 μL 1 000 mg/L 的氘代己二酸溶液(上海麦克林生化科技有限公司). 对于颗粒物样品,取30 cm2的滤膜置于样品瓶中,加入2 μL 1 000 mg/L 的氘代己二酸溶液和15 mL 的Milli-Q 超纯水,用超声仪(KQ-500DE 型, 昆山市超声仪器有限公司)超声萃取15 min,重复3 次. 所得的颗粒物萃取液与云水样品的后续处理步骤一致,即用旋转蒸发仪(R-300 型, Buchi, 瑞士)旋蒸至0.3 mL 左右;随后,将旋蒸后的溶液转移至2 mL 进样瓶,用氮吹仪(BF-2000 型, 北京八方世纪科技有限公司)吹干后加入100 μL 的N,O-双(三甲基硅烷基)三氟乙酰胺(含1%的三甲基氯硅烷)和20 μL 的吡啶,在80 ℃反应1 h;然后,将进样瓶冷却至室温,加入内标物质六甲基苯(上海阿拉丁生化科技股份有限公司);最后,用正己烷定容至1 mL,待测.
使用GC-MS (7890A-5979C 型, Agilent, 美国)测定样品中的二羧酸类物质. 色谱条件:使用DB-5MS石英毛细管柱(0.25 mm×30 m, 0.25 μm, Agilent, 美国). 升温程序设置为初始温度70 ℃,保持2 min,以2.5 ℃/min 升至120℃,10 ℃/min 升至220 ℃,20 ℃/min升至300 ℃,之后保持5 min,总分析时间为41 min.以高纯氦气为载气,进样方式为不分流进样. 质谱条件:离子源为电子轰击源(EI, 70 eV);质谱扫描范围为m/z=50~550.
1.2.2 质量控制与质量保证
采用的回收率指示物为氘代己二酸. 其他标准品包括草酸、丙二酸、丁二酸、戊二酸、己二酸、庚二酸、辛二酸、壬二酸(上海安谱实验科技股份有限公司),甲基丙二酸、甲基丁二酸、甲基戊二酸、M、F、mM、Pyr、ωC2(Sigma-Aldrich,美国)和hC4(成都埃法生物科技有限公司). GC-MS 仪器内标为六甲基苯,溶剂有甲醇、正己烷(上海麦克林生化科技有限公司)和超纯水(电导率为18.25 MΩ/cm).
对基质空白(空白滤膜和空白超纯水)和溶剂空白进行超声萃取、衍生化和GC-MS 仪器分析,结果显示,基质空白所测结果与溶剂空白一致,说明基质对该文的分析方法没有影响.
用溶剂空白加标样的结果来计算各二羧酸类物质的回收率,共设置2 个浓度梯度(0.4 和2.0 μg/mL),结果表明,除草酸回收率在75%外,其余二羧酸类物质的回收率可在80%以上. 重复性试验表明,分析标准偏差均小于8%,所有样品中回收率指示物氘代己二酸的回收率均在70%以上,所以该研究所有数据没有经过回收率校正.
1.2.3 总碳分析仪测定水溶性有机碳
使用TOC 分析仪(TOC-V 型, Shimadzu, 日本)测定云水样品和间隙颗粒水提取液样品中的WSOC.采样前向样品中加入一滴磷酸以去除无机碳. 试验数据均考虑了空白值的校正,所使用的TOC 分析仪检测限为0.004 mg/L.
1.2.4 水溶性离子和金属离子的测定
研究使用带有抑制型电导率检测器和Metrosep C4-150/4.0 色谱柱的离子色谱(IC, 883 Basic IC plus型, Metrohm, 瑞士)测定样品中的水溶性离子. 其中,阴离子用Metrosep A Supp-150/4.0 6.1006.520 分离柱(150 mm×4.0 mm)和Metrosep RP2 6.1011.030 保护柱(1.0 mm×3.5 mm),阳离子用Metrosep C4-150/4.0 6.1050.410 分离柱(100 mm×4.0 mm). 测定的阳离子包括Na+、NH4+、K+、Mg2+和Ca2+,阴离子包括F—、Cl—、NO2—、Br—、NO3—、PO43—和SO42—. 云水中水溶性元素分析采用电感耦合等离子体质谱(ICP-MS, iCap Qc型, Thermofisher, 美国),包括Na、Mg、Al、P、K、Ca、Ti、V、Cr、Mn、Fe、Co、Ni、Cu、Zn、As、Rb、Sr、Mo、Cd、Cs、Ba 和Pb. 由于该文重点关注的是二次液相过程对草酸形成的影响,因此,根据文献仅选取了NH4+、SO42—、NO3—、Ca2+和Fe 组分,讨论其对草酸的影响. 试验数据均考虑了空白值的校正.
1.2.5 多元线性回归和随机森林方法
多元线性回归和随机森林可以明确描述预测变量和响应变量(即回归变量)之间的关系. 为了确定决定云水中影响草酸浓度变化的关键因素,在Rstudio 中使用“randomForest”包运行随机森林模型.将云水中以下物质的浓度,如hC4+Pyr+ωC2、C3~C9、iC4~iC6、NH4++SO42—+NO3—、M+F、Ca2+、Fe,以及液态水含量(LWC)、pH 和环境温度输入模型作为云水中草酸浓度变化的预测因子. 模型输出结果中的“IncNodePurity”代表了每个变量对分类树每个节点上观测值异质性的影响,该值越大表明预测变量的重要性越高. 同样,在Rstudio 中使用多元线性回归方法得到每个影响因素的R2,代表了每个变量对云水中草酸浓度变化的解释度,可以用来定量每个影响因素对草酸浓度变化的贡献. 该研究中多元线性回归与随机森林方法是独立使用的.
2 结果与讨论
2.1 云水和云间隙颗粒物中草酸及其他二羧酸类物质的分布特征
云水和云间隙颗粒物中二羧酸类物质浓度的分布特征如表1 所示. 为方便对比,表格中的浓度均归一化为大气浓度. 由表1 可见,采样期间云水和云间隙颗粒物中草酸浓度分别为(44.53±27.60)和(27.28±14.47)ng/m3,其他二羧酸类物质浓度的总和分别为(27.28±15.71)和(68.92±32.45)ng/m3. 从草酸在云水中的液相浓度来看,华南背景山区的草酸浓度(431 μg/L)高于阿尔卑斯山(170 μg/L)[35],低于泰山(2 080 μg/L)[23]和大帽山(677 μg/L)[24]. 云水中草酸浓度最高,其次是C4、Pyr 和hC4,这四者浓度之和占云水中二羧酸类物质总浓度的80%;云间隙颗粒物中草酸浓度也最高,其次是Pyr、ωC2和hC4,这四者浓度之和占颗粒物中二羧酸类物质总浓度的66%. 云水中和云间隙颗粒物中草酸分别占直链饱和二羧酸的78.9%和70.0%,占水溶性有机碳的2.4%和1.1%.

表 1 2020 年冬季华南背景山区中云水和云间隙颗粒物中二羧酸类物质的浓度Table 1 Concentrations of dicarboxylic substances in cloud water and cloud interstitial particles in the background mountainous area of southern China in winter in 2020 ng/m3
已有研究[23]主要报道了云水中二羧酸类物质的浓度,没有对比其在云水和云间隙颗粒物中浓度的差异. 该文采用二羧酸类物质浓度在云水(归一化为在大气中的浓度)和云间隙颗粒物中浓度的比值来评估云中过程对不同二羧酸类物质的影响. 由图1 可见:云水中草酸和C4的浓度高于云间隙颗粒物中,而其他二羧酸类物质则呈相反的特征;ωC2浓度在云水和云间隙颗粒物中的差异较大,可能是由于ωC2在云水中更多地被转化;此外,iC5、iC6、mM、F 和M 等在云水中的浓度也明显低于在云间隙颗粒物中,说明这些物质很可能是云水中草酸形成的前体物.
2.2 云水中草酸的形成机制
通过比较草酸在直链饱和二羧酸(C2~C9)、总二羧酸类物质和WSOC 中的占比,可以评估云中液相过程对草酸形成的重要性. 由图2 可见,5 个云事件的云水中C2/(C2~C9)(浓度比,下同)、C2/总二羧酸类物质(浓度比,下同)和C2-C/WSOC(草酸中的碳浓度在水溶性总有机碳浓度中的占比,下同)均高于云间隙颗粒物中高,这3 个比值的范围在云水中分别为75.5%~87.7%(平均值为81.4%)、49.4%~72.0%(平均值为59.4%)、2.1%~2.9%(平均值为2.4%),在云间隙颗粒物中分别为57.0%~70.0%(平均值为64.1%)、23.0%~28.7%(平均值为25.3%)、0.3%~2.4%(平均值为1.1%),说明相对于云间隙颗粒物,云中过程促进了草酸的形成.
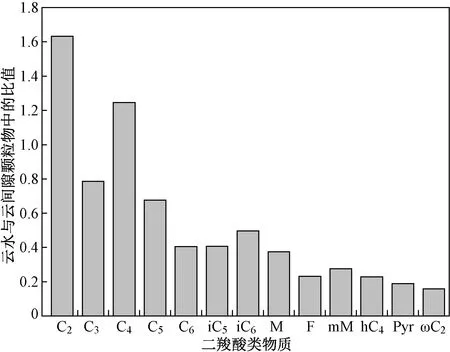
图 1 云水与云间隙颗粒物中二羧酸类物质浓度的比值Fig.1 The ratio of the concentrations of dicarboxylic substances in cloud water to those in cloud interstitial particles
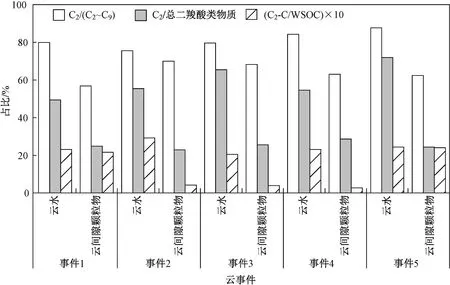
图 2 5 个云事件的云水和云间隙颗粒物中草酸在直链饱和二羧酸(C2~C9)、总二羧酸类物质和水溶性有机碳(WSOC)中的占比Fig.2 The percentage of oxalic acid in linear dicarboxylic acids , total dicarboxylic substances and water soluble organic carbon (WSOC) in cloud water and interstitial particles during five cloud events
为进一步探究云水中草酸的形成机制,笔者分析了草酸与二次无机离子的相关性. 云水中草酸浓度与NO3—、NH4+、SO42—浓度均呈正相关(R2为0.29~0.59,P均小于0.01),表明它们的形成机制可能类似,即均通过二次反应形成[36-38]. 有研究[39]发现,直链饱和二羧酸HOOC(CH2)nCOOH 的逐步液相氧化可以生成HOOC(CH2)n—1COOH,最终生成草酸. 其中,C4可以与羟基自由基发生脱羧反应先形成C3,再形成草酸. M可以发生水合反应或C4发生羟基化反应先生成hC4,再氧化生成草酸[19]. 中间体ωC2和Pyr 光化学氧化的终产物也是草酸[10].
该文利用物质浓度比〔C2/(C3~C9)、C2/(iC4~iC6)、C2/(M+F+mM)和C2/(hC4+Pyr+ωC2)〕来分析草酸的液相生成机制. 由图3 可见,云水中C2/总二羧酸类物质与C2/(C3~C9)、C2/(iC4~iC6)、C2/(hC4+Pyr+ωC2)均呈显著正相关(R2为0.47~0.63,P均小于0.01),说明C3~C9、iC4~iC6、hC4+Pyr+ωC2可能是云水中草酸的重要前体物,与已有研究结果[19-20]一致. 除此之外,C2/总二羧酸类物质与C2/(M+F+mM)相关性(R2=0.76,P<0.01)也较好,说明F、mM 和M 也可能是云中草酸的重要前体物. 类似地,云间隙颗粒物中的C2/总二羧酸类物质与C2/(iC4~iC6)、C2/(hC4+Pyr+ωC2)和C2/(M+F+mM)的相关性(R2为0.61~0.93,P均小于0.05)均较好,但与C2/(C3~C9)的相关性(R2=0.04,P<0.7)较弱. 云水和云间隙颗粒物的差异表明,草酸在不同含水量颗粒物上的形成机制可能存在一定差异.
图 3 云水中C2/总二羧酸类物质与C2/(C3~C9)、C2/(iC4~iC6)、C2/(M+F+mM)和C2/(hC4+Pyr+ωC2)的相关性分析Fig.3 Correlation analyses between C2/total dicarboxylic substances and C2/(C3-C9), C2/(iC4-iC6),C2/(M+F+mM) and C2/(hC4+Pyr+ωC2) in cloud water
2.3 云水中草酸浓度变化的影响因素
通常前体物、气象条件和云水性质均可以影响云中草酸的形成. 为探究影响云水中草酸浓度变化的主要因素,该研究对LWC、pH、温度与草酸、前体物以及草酸与前体物的比值进行了相关性分析. 结果表明,云水中草酸与LWC 与pH 均没有显著相关性,Cheng 等[25]研究也发现,草酸与LWC 之间没有显著相关性;但Meng 等[11]研究表明,草酸的浓度与气溶胶的pH 密切相关,高酸性条件下有利于草酸的形成.此外,草酸与环境温度通常存在一定正相关,高温季节会促进草酸的液相氧化生成[40]. 由图4 可见,草酸与温度呈显著正相关(R2=0.41,P<0.01). 但值得说明的是,由于该研究采样时间主要集中在冬季,采样期间云水的LWC〔(0.12±0.04)g/m3〕、pH (4.28±0.40)和温度〔(12.9±1.4)℃〕相对变化均较小. 因此,未来还需要更多的观测去深入探讨其对草酸形成的影响.

图 4 云水中草酸浓度与温度的相关性Fig.4 Correlation analyses between oxalic acid and temperature in cloud water
LWC与前体物C3~C9、iC4~iC6、M+F+mM、hC4+Pyr+ωC2的浓度均呈弱正相关(R2为0.16~0.35,P均小于0.05),说明LWC 的增加将有利于草酸前体物的生成. 而pH 与草酸的前体物浓度没有显著相关性. 研究[41]表明,前体物C3、C4和C5浓度与温度均存在显著相关性,但笔者研究中温度只与iC4~iC6浓度呈显著正相关(R2=0.39,P<0.01). 前体物向草酸的转化同样也受到环境条件的影响. 相关性分析表明,LWC 与C2/(C3~C9)、C2/(iC4~iC6)、C2/(M+F+mM)、C2/(hC4+Pyr+ωC2)均呈弱负相关(R2为0.21~0.43,P均 小 于0.01), pH 与C2/(C3~C9)、 C2/(iC4~iC6)、C2/(M+F+mM)、C2/(hC4+Pyr+ωC2) 也均呈弱负相关(R2为0.14~0.39,P均小于0.05),说明LWC 的降低和酸度的增加将有利于前体物向草酸的转化. 与Sorooshian 等[42]研究结果不同,其发现LWC 的增加会使溶液pH 上升,pH 的上升有利于ωC2向草酸的转化. 温度与C2/(C3~C9)、C2/(iC4~iC6)、C2/(M+F+mM)和C2/(hC4+Pyr+ωC2)均不存在显著相关性,与Sorooshian等[42]发现温度会促进ωC2向草酸转化的结果不同.这可能是由于实际环境是一个非常复杂的体系,环境因子对前体物及其转化的影响机制复杂,不同环境下的关键影响因子也不同,同时也可能存在非线性影响机制. LWC、pH、温度对草酸前体物及其转化的影响机制还需要更加深入、细致的研究.
此外,有研究[43]表明,Ca2+和水溶性Fe 在液相中可以与草酸形成稳定络合物,络合物的光解是大气草酸的重要汇[28]. 但笔者研究云水中Ca2+浓度与草酸浓度相关性较弱(R2=0.13,P<0.05),同时没有发现水溶性Fe 浓度与草酸及其前体物浓度有显著相关性.
通过随机森林和多元线性回归这2 种方法来定量云水中前体物、温度和云水性质对草酸浓度变化的贡献. 由图5 可见,在随机森林中这些影响因素对云水中草酸浓度变化的可解释度为65%,多元线性回归的结果与随机森林结果一致,输入的影响因素对云水中草酸浓度变化的可解释度为99%. 从多元线性回归方法的结果可知,前体物hC4+Pyr+ωC2、C3~C9和iC4~iC6的浓度对草酸浓度变化的贡献率较大,分别为38%、22%和14%,其次是前体物M 和F 浓度(mM 与其他影响因素存在严重共线性,因此该研究没有涉及mM),F 和M 浓度对草酸浓度变化的贡献率为6%,所有涉及的前体物(C3~C9、iC4~iC6、hC4+Pyr+ωC2、M+F)浓度对草酸浓度变化的贡献最大,为79%. 第二大贡献者是云水性质,对草酸浓度变化的贡献率约20%. 温度对草酸浓度变化的贡献率仅为1%.
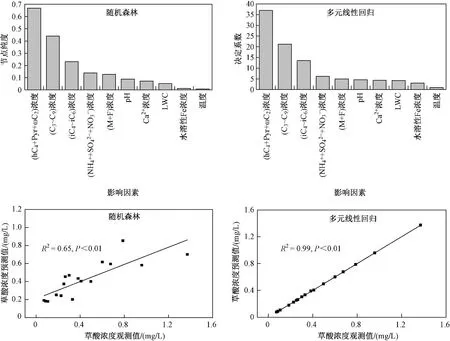
图 5 影响云水中草酸形成的因素和云水中草酸浓度预测值与观测值的相关性分析Fig.5 Ordination of factors influencing the formation of oxalic acid in cloud water and correlation analyses of oxalic acid in cloud water between the observed values and the predicted values
该文通过相关性分析并结合随机森林和多元线性回归分析,证明华南背景山区云水中的草酸主要是通过多官能团羧酸(hC4+Pyr+ωC2)的氧化形成,其次直链饱和二羧酸(C3~C9)、支链饱和二羧酸(iC4~iC6)以及不饱和二羧酸(M、F)对草酸浓度变化的贡献率为20%. 随机森林和多元线性回归分析均表明,LWC与pH 对云水中草酸浓度变化的影响相当,而水溶性Fe 离子浓度和温度对草酸浓度变化的影响均较小.由图5 可见,随机森林和多元线性回归预测的云水中草酸浓度与观测值拟合结果的相关系数(R2)分别达0.65 和0.99,说明利用这些因素可以很好地解释云水中草酸的浓度变化.
3 结论
a) 华南背景山区云水和云间隙颗粒物中草酸的浓度分别为431 μg/L 和27.28 ng/m3,分别占直链饱和二羧酸总浓度的78.9%和70.0%,占WSOC 浓度的2.4%和1.1%.
b) 云水中草酸在C2~C9、总二羧酸类物质和WSOC 中的占比高于在云间隙颗粒物中,表明云中过程促进了草酸的形成. 云水中C2/总二羧酸类物质与C2/(C3~C9)、 C2/(iC4~iC6)、 C2/(M+F+mM)和C2/(hC4+Pyr+ωC2)的相关性均较好.
c) C3~C9、iC4~iC6、M+F+mM 和hC4+Pyr+ωC2是云水中草酸形成的重要前体物. 随机森林以及多元线性回归分析表明前体物,尤其是多官能团羧酸(hC4+Pyr+ωC2)对云水中草酸浓度变化的贡献率(约79%)最大;其次是云水性质,贡献率为20%,而温度的贡献率为1%.

