妊娠晚期孕妇GBS感染与凝血功能、阴道清洁度及母婴结局
董卫国 王文工 卫 明
湖北省中西医结合医院(武汉,430015)
B族链球菌(GBS)不仅引起新生儿感染,还可造成孕妇产褥期脓毒血症和新生儿脑膜炎[1-3]。临床对孕35~37周孕妇采取GBS筛查和相关干预措施,减少孕妇围产期内GBS感染几率[4-6]。但我国关于GBS感染对晚期妊娠孕妇的影响和妊娠结局的大样本调查和结论较少。基于此,本文探究GBS感染对妊娠晚期孕妇的凝血功能、生殖道清洁度及母婴结局的影响,为GBS感染孕妇干预治疗提供参考。
1 资料与方法
1.1 一般资料
选取本院2019年1月-2019年10月收治的孕35~42周孕妇986例临床资料。纳入标准:年龄20~40岁,孕龄≥35周;正常单胎妊娠;未合并其他严重病菌感染疾病。排除标准:合并有心脑血管或肝肾等脏器功能障碍疾病;胎儿胎位异常,或为巨大儿;存在宫颈功能异常;羊水量异常。均行阴道清洁度检测及阴道分泌物GBS培养,根据GBS培养结果分为GBS阳性(GBS+组)和GBS阴性(GBS-组);将GBS+组根据是否正规治疗分为正规治疗组与非正规治疗组。对入选孕妇追踪其分娩情况并记录母婴结局。本研究取得孕妇知情同意,并通过了本院伦理委员会审批。
1.2 观察指标
1.2.1阴道分泌物常规取孕妇阴道分泌物,血琼脂平板培养基中接种。①阴道清洁度:显微镜观察标本菌落分布,分析其阴道清洁度。②GBS菌落培养:标本接种培养后,置35℃培养18~24h,出现可疑菌落后分离到血平板基内分离培养。采用rapid ID 32 sTREP鉴定试条ATB Expression TM仪判断培养结果。
1.2.2凝血功能取孕妇晨空腹静脉血离心,采用迈瑞EXC_810及配套试剂(武汉嘉晟宁康医疗科技有限公司)检测血浆凝血酶时间(TT)、血浆凝血酶原时间(PT)、活化部分凝血活酶时间(APTT)、国际标准化比值(INR)、纤维蛋白原(Fbg)、D-二聚体(D-D)、纤维蛋白(原)降解产物(FDP)和抗凝血酶-3(AT-3)等。
1.2.3母婴结局记录两组孕妇胎膜早破、早产、新生儿感染、产褥感染等不良妊娠结局和新生儿窒息、新生儿肺炎、新生儿病理学黄疸等新生儿不良结局。
1.3 干预治疗
正规治疗:对GBS阳性孕妇分娩前4 h或胎膜破裂时采用抗生素预防性干预,青霉素无过敏者采用青霉素干预,青霉素G第一次静脉滴注的剂量为480万U,后每4h 240万U静脉滴注直至分娩;对青霉素过敏者,给予静脉滴注头孢唑林,初始剂量2g,后静脉滴注1g/8h,直至分娩。未正规治疗:产妇临产时未给药干预。
1.4 统计学方法
2 结果
2.1 一般资料
在986例孕妇中,GBS+组92例(9.3%),GBS-组894例(90.7%)。两组孕妇一般资料无差异(P>0.05)。见表1。

表1 两组孕妇一般资料对比
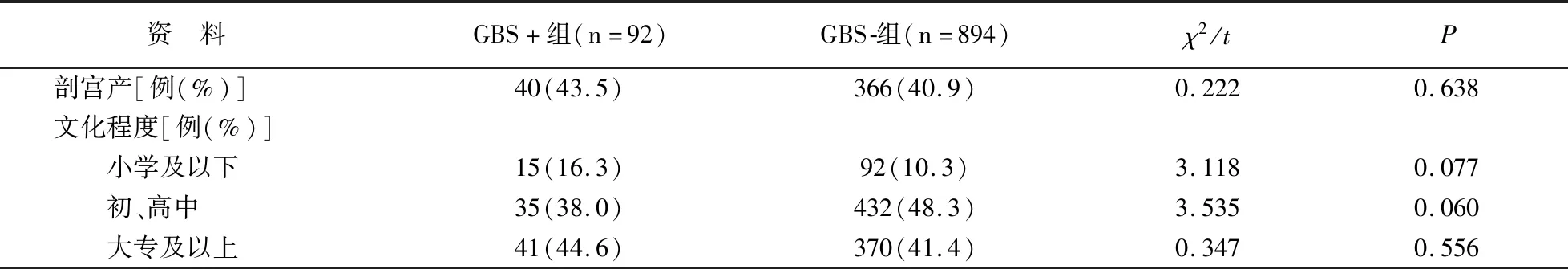
资 料 GBS+组(n=92)GBS 组(n=894)χ2/tP剖宫产[例(%)]40(43.5)366(40.9)0.2220.638文化程度[例(%)] 小学及以下15(16.3)92(10.3)3.1180.077 初、高中35(38.0)432(48.3)3.5350.060 大专及以上41(44.6)370(41.4)0.3470.556
2.2 凝血功能指标
两组血浆TT水平无差异(P>0.05)。GBS+组血浆PT、APTT、INR、D-D、FDP均低于GBS-组,Fbg、AT-3高于GBS-组(P<0.05)。见表2。
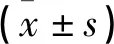
表2 两组凝血功能指标对比
2.3 阴道清洁度
阴道清洁度异常比例GBS+组高于(57例,62.0%) GBS-组(311例,34.8%)(χ2=26.322,P<0.05)。
2.4 母婴结局
GBS+组中,未经正规治疗孕妇出现胎膜早破、早产、新生儿感染、产褥感染、新生儿窒息、新生儿病理学黄疸几率高于正规治疗组(P<0.05)。见表3。
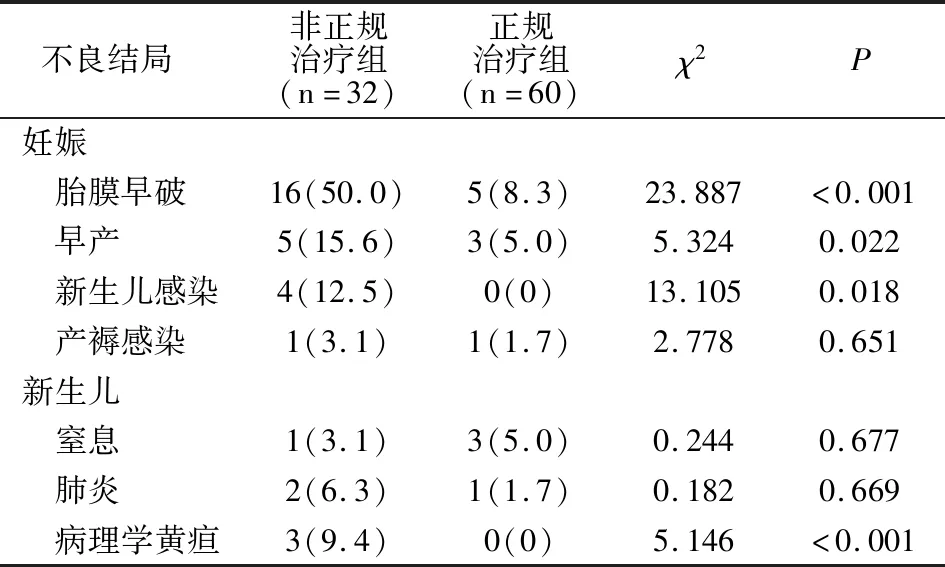
表3 两组母婴不良结局对比[例(%)]
3 讨论
临床研究发现,妊娠期GBS很少会直接造成孕妇和胎儿感染,而在分娩中感染给新生婴儿[7-8]。究其原因当孕妇分娩时,机体免疫功能降低、GBS菌群失调或移位,免疫与病菌的平衡被打破,GBS可从阴道内上行感染至宫腔,使胎儿处于感染环境中,进而引发GBS感染和早产败血症[9-10]。在发展中国家,新生儿出现GBS阳性和败血症几率极高,而我国临床研究中也发现了引发新生儿感染、产褥感染、新生儿窒息等较严重的GBS母婴感染情况[11-12]。因此,需提高对妊娠晚期孕妇GBS感染的重视。
在本研究中,986例孕晚期孕妇出现GBS感染阳性9.3%,阳性比率较高。分娩过程孕妇存在大出血风险,这与机体凝血功能有关。目前已有研究证实,孕产妇在感染GBS后会一定程度上导致凝血指标异常,产生血管内凝血或血栓,并导致妊娠不良结局[13-14]。TT、PT是机体外源性凝血系统功能障碍和临床抗凝治疗的监测指标之一;APTT是目前临床常用的内源性凝血系统凝血活性敏感筛查和相关抑制药物治疗检测指标,可用于对出血疾病的初步筛查诊断[15]。INR可行标准化报告,提高抗凝治疗用药科学性;Fbg高水平状态是血栓性疾病的重要标志物[16]。在本研究中,GBS+组孕妇的PT、APTT、INR水平均低于GBS-组,Fbg水平高于GBS-组,而两组TT水平无显著差异,提示发生GBS感染的孕妇更易出现凝血异常,并发生血栓类疾病。分析其可能原因为,分娩过程中的前置胎盘、羊水栓塞等均会导致组织损伤,组织凝血活酶类促凝物进入孕妇血液中,诱发弥散性血管内凝血,妊娠晚期孕妇 GBS感染在一定程度上导致孕妇血浆中 Fbg、凝血因子及激肽释放原升高,而 PT、APTT下降,进一步诱发弥散性血管内凝血和血栓的发生[14]。此外,两组TT水平无差异,可能是因为不同孕妇机体内所缺失的血凝因子存在不同,导致结果存在偏差。
研究发现,GBS病菌本身存在明显侵袭性和黏附性,GBS感染后可通过分泌溶血素作用在绒毛膜上皮细胞,降低胎膜屏障功能和张力,增加羊膜腔上皮细胞通透性,造成胎膜早破和生殖道组织损伤,进而导致羊膜早破[17]。美国疾病控制中心在《围产期GBS感染与预防指南(2010)》中推荐GBS阳性孕产妇使用青霉素作为预防用药,对青霉素过敏者使用红霉素、克林霉素或万古霉素作为替代药物。本研究对GBS阳性孕妇分娩前4 h或胎膜破裂时采用青霉素预防性干预,青霉素过敏选择其他抗生素干预,降低了孕妇出现胎膜早破、早产、新生儿感染、产褥感染、新生儿窒息、新生儿病理学黄疸几率。表明在妊娠晚期对GBS阳性孕妇预防性药物治疗可降低GBS带菌量,从而减少GBS感染风险,改善不良母婴结局。
此外,本文GBS+组孕妇的阴道清洁度异常比例高于GBS-组,出现母婴不良结局比例更高。分析原因:免疫功能与GBS病菌平衡状态被打破后,GBS可通过大量繁殖形成自身抗体,对机体免疫应答机制造成损伤,进而引发其他细菌感染,累及羊膜内组织,对新生儿造成极大负面影响[18-19]。因此,需对妊娠晚期孕妇的阴道清洁度进行定期检查,筛查GBS感染阳性情况,并及时采取相关治疗措施,减少由GBS感染导致的母婴不良结局。
综上所述,妊娠晚期孕妇出现GBS感染不仅会造成孕妇凝血功能障碍,降低其阴道清洁度,还会诱发不良母婴结局,严重影响孕妇分娩和新生儿质量。因此,需及时对妊娠晚期孕妇进行GBS检查,降低孕妇分娩风险,提高生育优良率。

