阿司匹林干预脑胶质细胞瘤相关巨噬细胞表达VEGF、bFGF 和YKL-40 成血管生长因子
陈丽丽,王涵,武蕾蕾,展涛,郭素芬,于建渤,吴影,高丹
(牡丹江医学院附属红旗医院 皮肤科,黑龙江 牡丹江 157011)
0 引言
肿瘤血管生成为肿瘤组织提供必需的营养成分和氧气,同时也是肿瘤组织扩散和转移的必要条件。靶向阻击肿瘤血管生成一直是抗肿瘤转移或抗肿瘤复发的热点。但是,临床研究发现,应用抗肿瘤血管生成类的药物,却没有完全达到抗肿瘤转移的预期效果[1]。
肿瘤微环境(tumor microenvironment,TME)包含肿瘤细胞和非肿瘤细胞、炎症细胞以及多种促血管生成因子等,这些成分构成了肿瘤生长、转移的局部微环境,TME对肿瘤血管的生成起到重要的促进作用[2]。血液中的单核细胞/巨噬细胞,被炎症因子募集到肿瘤组织中,经细胞因子刺激极化为肿瘤相关巨噬细胞,该细胞能够分泌基质金属蛋白酶(matrix metalloproteinase,MMP)、巨噬细胞源性肿瘤坏死因子(tumor necrosis factor,TNF)及白细胞介素-1(interleukin-1,IL-1)等细胞因子而促进血管的生成[3],并有助于肿瘤细胞摆脱免疫系统的攻击,促进肿瘤生长或转移,是血管生成因子的主要来源[4]。
胶质瘤是常见的颅内原发肿瘤,具有新生血管较多并且杂乱的特点[5]。虽然目前以放化疗或者手术治疗为主,但是胶质瘤具有易侵袭、转移等特点,治疗效果并不十分理想。证据表明高肿瘤相关巨噬细胞浸润与肿瘤患者的疾病进展和总生存率有关[6]。
研究发现:胶质瘤相关巨噬细胞与胶质瘤的恶性程度密切相关,即胶质瘤级别越高,肿瘤相关巨噬细胞越多[7]。又发现胶质瘤中肿瘤相关巨噬细胞与微血管密度呈正相关,且级别越高越显著[8]。目前关于胶质瘤相关巨噬细胞的研究,多集中在胶质瘤相关巨噬细胞对胶质瘤细胞的凋亡、侵袭和迁移方面的影响,而胶质瘤相关巨噬细胞是否通过影响成血管因子的表达而调控胶质瘤的生长和转移研究却较少。
环氧合酶-2(cyclooxygenase-2,COX-2)对肿瘤血管的生成有促进作用。阿司匹林具有选择性抑制COX-2的重要作用[9],在阿司匹林的干预下,是否可能影响胶质瘤相关巨噬细胞分泌VEGF、bFGF以及YKL-40等成血管因子,是本课题所要解决的问题,研究结果将对揭示胶质瘤相关巨噬细胞与胶质瘤发生发展关系探寻靶点,并为抗胶质瘤做好研究基础。
1 材料与方法
1.1 材料
1.1.1 细胞株
人白血病THP-1单核细胞(购于中国科学院典型培养物保藏委员会细胞库);人脑星形胶质母细胞瘤U-87MG细胞(由沈阳万类生物科技公司惠赠)。
1.1.2 主要试剂和仪器
RPMI-1640或DMEM高糖培养基和胎牛血清(美国Hyclone公司),佛波酯(Phorbol ester,PMA;美国sigma公司),人重组白细胞介素-4蛋白(Interleukin-4,IL-4;美国BD公司),免抗人CD163(武汉博士得公司),免抗人VEGF单克隆抗体、免抗人FGF2单克隆抗体和山羊抗免IgG(美国Proteintech公司),超敏型二步法检测试剂盒(北京中衫金桥公司),浓缩型DAB试剂盒(北京中衫金桥公司)。人VEGF、bFGF和YKL-40的ELISA试剂盒(美国R&D公司)。日本OLYMPUS倒置显微镜,西班牙Biological超净工作台。
1.2 实验方法
1.2.1 细胞培养
含10%胎牛血清的RPMI-1640完全培养液培养THP-1细胞。含10%FBS的DMEM高糖完全培养基培养U-87MG细胞。
1.2.2 细胞诱导和分组
3×105/mL人白血病THP-1单核细胞,添加含PMA的RPMI-1640完全培养基,37℃,5%CO2培养24h后,更换含白细胞介素-4(Interleukin-4,IL-4)的DMEM高糖完全培养基;37℃,5%CO2培养48h,诱导为M2型巨噬细胞,单独培养M2型巨噬细胞为M2组。单独培养U-87MG细胞为U-87M组。U-87MG细胞与M2型巨噬细胞非接触共同培养为共培养M2组,共培养细胞用2mmol/L、4mmol/L、8mmol/L阿司匹林进行干预分别为2mM、4mM、8mM阿司匹林组。
1.2.3 非接触共培养体系
3×105/mL人M2型巨噬细胞接种在孔径0.4µm的Transwell培养板下室,DMEM高糖完全培养基培养。2×105/mL U-87MG细胞用DMEM高糖完全培养基重悬,接种至Transwell培养板上室;37℃,5%CO2培养12h后,待U-87MG细胞完全贴壁,Transwell培养板上室内添加0mmol/L、2mmol/L、4mmol/L、8mmol/L阿司匹林,37℃,5%CO2培养24h。
1.2.4 人M2 型巨噬细胞的鉴定
1×104THP-1细胞种植于附有玻片的24孔板内,然后经PMA和人重组IL-4诱导THP-1细胞至贴壁并融合达70%以上;4%多聚甲醛固定30min;3%BSA工作液封闭,室温放置20min;添加免抗人CD163抗体(1:200),4℃孵育过夜;0.01mmol/l PBS磷酸盐缓冲液清洗3次,每次3min;山羊抗免IgG(1:300),37℃孵育40min;0.01mmol/l PBS磷酸盐缓冲液清洗3次,每次2min;滴加DAB工作液,苏木素轻度复染3min。显微镜观察并照相。
1.2.5 免疫组化法检测VEGF、bFGF 的表达
取上述各组中单独培养的细胞和共培养M2型巨噬细胞及阿司匹林作用的M2型巨噬细胞,经固定、冲洗、封闭等处理后加入VEGF、bFGF一抗,4℃过夜;余步骤同M2型巨噬细胞的鉴定。
1.2.6 ELISA
3.5×104各组细胞,37℃,5%CO2培养12h,提取各组细胞的上清液。使用人VEGF、bFGF地ELISA试剂盒检测各组细胞VEGF、bFGF的含量。
1.3 观察指标
需要与结果2.1,2.2,2.3对应。
1.4 统计学分析
2 结果
2.1 THP-1细胞形态学特征
THP-1从血液中被募集到组织中,被细胞因子激活,转化为TMAs。THP-1细胞经2-3次传代,状态稳定良好的情况下,细胞悬浮呈圆形,大小均匀,折光度较好。在培养液中添加含浓度为100ng/mL PMA的RPMI-1640完全培养基24h,细胞完全贴壁,形态由圆形转变为卵圆形或梭形有隆起。添加含浓度为20ng/mL IL-4的RPMI-1640完全培养基24h,部分细胞伸出伪足,形态变长。48h后,细胞形态明显改变,伪足延长变细,图1。
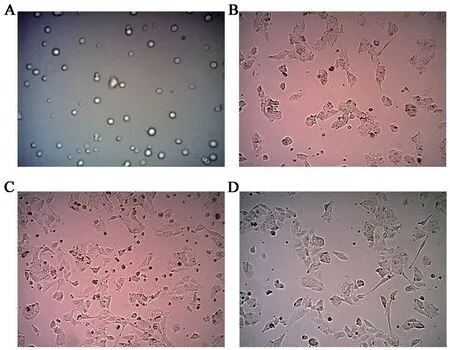
图1 各组THP-1细胞培养24h的形态学特征(×100)
2.2 M2型巨噬细胞的表型鉴定
免疫组化结果表明:与THP-1细胞诱导之前CD163表达(0.37%)相比,THP-1细胞经PMA及IL-4逐级诱导后出现高表达的M2型巨噬细胞特异性抗原CD163(93.7%),两组数据相比具有显著差异(P<0.01),图2。

图2 THP-1细胞经PMA及IL-4诱导后CD163的表达(×400)
2.3 ELISA检测各组细胞VEGF、bFGF和YKL-40含量
单独培养的M2型巨噬细胞及与U87MG细胞共同培养的M2型巨噬细胞均见VEGF,bFGF和YKL-40的表达,但共培养的M2型巨噬细胞VEGF,bFGF和YKL-40表达明显增多,数据相比具有统计学有意义(P<0.01)。与共同培养的M2型巨噬细胞相比较,当在共培养体系中加入2mm、4mm、8mm不同浓度阿司匹林后,阿司匹林组VEGF,bFGF和YKL-40含量逐渐降低,数据相比具有统计学有意义(P<0.01)。当阿司匹林浓度达8mm时,共培养体系M2型巨噬细胞VEGF,bFGF和YKL-40含量较2mm和4mm阿司匹林干预的M2型巨噬细胞明显最低,数据相比具有统计学有意义(P<0.01),表1。
表1 ELISA检测各组细胞VEGF、bFGF含量(,n=16,pg/mL)

表1 ELISA检测各组细胞VEGF、bFGF含量(,n=16,pg/mL)
注:*P<0.01,与U-87M组和M2组比较;#P<0.01,与共培养M2组比较
3 讨论
胶质瘤是一种顽固、常见的颅内原发肿瘤,具有新生血管较多并且杂乱的特点[5]。临床目前主要进行放化疗或者手术治疗,但胶质瘤具有易侵袭、转移等特点,导致以上治疗效果一直不理想,因此我们需要不断地寻找新的治疗方法,为临床治疗胶质瘤提供新思路。
在肿瘤组织中可以发现各种免疫细胞。血液中的单核细胞/巨噬细胞,被炎症因子募集到肿瘤组织中,经细胞因子刺激极化为肿瘤相关巨噬细胞(TAMs)。从功能表型上,巨噬细胞大致分为:经典(M1)型和替代(M2)型巨噬细胞。M1型巨噬细胞能够被γ-干扰素等诱导,主要抗感染,抑制肿瘤细胞生长。M2型巨噬细胞分泌多种因子,有助于肿瘤细胞摆脱免疫系统的攻击,从而促进肿瘤生长转移。研究发现,M2型巨噬细胞经肿瘤诱导更接近TAMs。有资料显示:TAMs在肿瘤微环境中扮演重要角色,TAMs是血管生成因子的主要来源[10],如M2型巨噬细胞可以释放血管内皮生长因子(Vascular endothelial growth factor,VEGF)、基质金属蛋白酶(Matrix metalloproteinase,MMP)等直接促进血管的生成[3],还可以释放巨噬细胞源性肿瘤坏死因子(Tumor necrosis factor,TNF)及白细胞介素-1(Interleukin-1,IL-1)等促进黑色素瘤中白细胞介素-8(Interleukin-8,IL-8)和VEGF的释放,从而间接促进肿瘤的血管生成[11]。越来越多的证据表明高TAMs浸润与肿瘤患者的疾病进展和总生存率有关。
VEGF和bFGF是最常见的成血管因子,其促进血管形成的机制已有大量报道,如它们可以促进内皮细胞有丝分裂,也可以动员内皮祖细胞迁移并掺入到成熟内皮细胞中而发挥促血管生成作用[12]。YKL-40是一种分泌型糖蛋白,通常由多种细胞如巨噬细胞,软骨细胞和血管平滑肌细胞表达[13]。大量证据表明YKL-40不仅是急性及慢性炎症标志物,而且参与细胞的增殖、分化、凋亡、血管生成及组织重构等过程[14]。
阿司匹林是经典的非甾体抗炎药,具有选择性抑制环氧合酶-2(cyclooxygenase-2,COX-2)的作用。已有研究表明COX-2对肿瘤血管的生成有促进作用。COX-2对肿瘤血管形成的机制为:①促进血管内皮类生长因子的表达如VEGF;②前列腺素类产物如血栓素A2、前列腺素E2、前列环素能促进内皮细胞的迁移及血管形成;③通过上调Bcl-2的表达或Akt基因的活性,促进血管内皮细胞的形成。Kale和Gan的研究证实:M2型巨噬细胞可以产生COX-2。那么,在阿司匹林的干预下,是否可能通过抑制COX-2来影响TAMs成血管因子VEGF、bFGF以及YKL-40的表达呢?这也是本课题所要解决的问题。
鉴于以上原因,实验中我们采用共培养系统首先设计了常见的VEGF、bFGF以及YKL-40影响血管形成因子研究。结果发现:与单独培养的M2型巨噬细胞比,同U87MG胶质瘤细胞共培养的M2型巨噬细胞表达和分泌VEGF、bFGF以及YKL-40明显增加。结果显示:与U87MG胶质瘤细胞共培养的M2型巨噬细胞可以高表且与单独培养的M2型巨噬细胞比具有明显的统计学意义。以上这些成血管因子的变化说明胶质瘤细胞可能参与诱导M2型巨噬细胞大量表达和分泌VEGF、bFGF以及YKL-40,但具体的机制还不清楚。当阿司匹林浓度达8mm时,共培养体系中的M2型巨噬细胞表达VEGF较空白对照组的M2型巨噬细胞明显减少。因此,如果采用阿司匹林可以起到重要的抗血管新生作用,阿司匹林不但可以直接抑制肿瘤细胞成血管因子的表达,同时也可以对肿瘤微环境中M2型巨噬细胞成血管因子的生成起到抑制作用,从而为肿瘤的抗血管治疗提供更多可靠依据,也可为阿司匹林的进一步药用价值开发带来新希望。
这项研究初步探索了阿司匹林干预脑胶质细胞瘤相关巨噬细胞表达VEGF、bFGF和YKL-40成血管生长因子的影响,关于阿司匹林干预血管新生的靶点机制研究还需要借助基因组学、代谢组学等手段深入探索。

