仿制药与原研药头孢哌酮复方制剂对产ESBL肠杆菌的作用效果
毛光明 万玲俐
近年来,肠杆菌科细菌作为引起医院内血流感染最常见的病原菌之一而备受关注。产超广谱β-内酰胺酶(extended spectrum βlactamase, ESBL)肠杆菌科细菌引起的血流感染日益严重,且耐药率逐年升高,多重耐药菌株逐渐增多,而临床治疗该细菌感染的手段十分有限[1-3]。β-内酰胺酶为革兰阴性菌及少数革兰阳性菌是对β-内酰胺类抗生素产生逃逸耐药性的重要原因[4-5]。β-内酰胺酶抑制剂的主要作用机制为通过抑制ESBL 的生物活性,确保β-内酰胺类抗生素不被生物降解而失去抑制细菌生长的效果,对治产ESBL 肠杆菌科细菌感染具有重要意义[6-7]。我国已批准上市的β-内酰胺酶抑制剂有他唑巴坦、舒巴坦和克拉维酸,在抗菌方面取得良好的效果[8-9]。
原研药与仿制药相比,因其制作的工艺、辅料不同,可能造成药效的不同,同时复方制剂中因不同药物组合,也可能会影响药效[10-11]。这些同类复方制剂之间是否存在差异,差异性有多大,给临床治疗疾病用药时带来困惑或因为疗效问题影响患者的治疗[12-13]。本项目拟通过研究仿制药与原研药头孢哌酮复方制剂对产ESBL 肠杆菌科细菌抗菌活性,对比了解两者之间的抗菌活性强度是否存在差异,为临床实际用药选择时提供参考,最大程度提高治疗效果,降低患者药品治疗费用。
1 资料与方法
1.1 一般资料
选取2017年4月至2020年2月于攀枝花市中心医院确诊为急性细菌性感染且经细菌培养鉴定为产ESBL 肠杆菌科细菌感染患者100 例作为研究对象。将50 例接受原研药头孢哌酮舒巴坦治疗患者纳入观察组;50 例接受仿制药头孢哌酮舒巴坦治疗患者纳入对照组。
纳入标准:1)具有明显感染症状,体征和实验室指标检测异常的急性细菌性感染患者[14];2)年龄18~70 岁,试验前未用过其他抗菌药物或用后确证无效者(细菌培养仍阳性);3)无青霉素类、β-内酰胺酶抑制剂过敏史,及过敏性疾病史者;4)近期未进行抗菌治疗;5)签署了知情同意书。
排除标准:1)青霉素类药物过敏史;严重心、肝、肾功能不全或造血功能障碍;2)有出血倾向及出血性疾病患者;3)妊娠期及哺乳期妇女;4)有精神、神经系统疾病;5)依从性差或病情严重,不能完成疗程者,非细菌性感染者。本研究经攀枝花市中心医院医学伦理委员会审核批准后执行。
1.2 治疗方法
观察组给予原研药头孢哌酮舒巴坦(辉瑞制药有限公司,国药准字H20020598,规格1.5 g/支),室温保存,有效期2年;用法用量:3 g/次,3 次/d,静脉滴注。对照组给予仿制药头孢哌酮舒巴坦(深圳立健药业有限公司,国药准字H20121501,规格1 g/支),室温保存,有效期2年;用法用量:3 g/次,3 次/d,静脉滴注。治疗疗程:两组至少治疗3 d,临床症状体征及实验室指标均无改善者,视为治疗无效,退出试验,继续采用其他治疗手段进行治疗,临床症状体征及实验室指标有改善者,继续按照相关指南要求足疗程治疗。
1.3 评价方法
依据卫生部于2004年10月颁发的《抗菌药物临床研究指导原则》[8],根据临床症状、体征、实验室检查结果、细菌学检查结果进行综合评价以确定临床疗效,按痊愈、显效、改善、无效4 级评定。痊愈:治疗后临床症状、体征、实验室检查、细菌学检查均恢复正常;显效:治疗后病情明显好转,但上述4 项中有1 项未完全恢复正常;改善:治疗后病情有所好转;无效:治疗72 h 后病情无明显变化或有所加重。治疗有效率(%)=痊愈例数+显效例数/总例数×100%。
按病原菌清除、未清除、替换3 级评定。清除:治疗结束时病原菌消失、且无新病原菌出现;未清除:治疗结束时病原菌仍存在;菌交替:疗程结束后出现新的病原菌,而原病原菌消失[12]。
总成本=直接治疗成本+间接治疗成本+不良反应成本[13];直接治疗成本=医院费用+药品成本。本研究只作药品成本比较。间接治疗成本主要指因患病造成的缺勤等导致损失的工资及收入。不良反应成本指治疗不良反应的药品费用等。药物经济学所述的成本不仅指药物费用,还包括不良反应治疗费用、检查费用、时间费用等[15]。因本研究中接受治疗的患者按设计的疗程、给药剂量、病情轻重程度进行评估、分组,在检查费用上无差异,故只计算每例受试者使用治疗药物的费用。
最低抑菌浓度(MIC)的测定:先将琼脂M-H培养基高压灭菌,制成液体状(未凝固),并放凉至约50 ℃,然后将头孢哌酮舒巴坦浓度分别稀释为20.00、10.00、5.00、2.50、1.25 μg/ml;向干燥的培养皿内加入2.5 ml 不同质量浓度的头孢哌酮舒巴坦溶液和22.5 ml 的琼脂培养基,则头孢哌酮舒巴坦质量浓度依次变为2.000、1.000、0.500、0.250、0.125 μg/ml;取感染部位标本进行细菌培养,利用平板菌计数法选取最适菌落数,取0.2 ml 最适菌液置上述琼脂培养皿中,划线,混匀,24 h 后记录细菌菌落数(平行进行空白对照试验),采用体外稀释法观察头孢哌酮舒巴坦对产ESBL 肠杆菌科细菌的MIC[16]。
1.4 统计学分析
采用SPSS 26.0 及GarphPad 8.0 软件包对数据与图形处理。首先,采用Kolmogorov-Smirnov test 与Levene 检验对数据的正态性与方差齐性进行分析。计量数据以±s表示,组间比较采用独立样本t检验;计数数据采用百分率表示,组间比较采用χ2检验。P<0.05 为差异有统计学意义。
2 结果
2.1 观察组与对照组基线资料均一性的检验
观察组与对照组在年龄、性别、BMI、疗程、用药总量、用药前体温、用药前白细胞计数比较差异无统计学意义(P>0.05)。见表1。
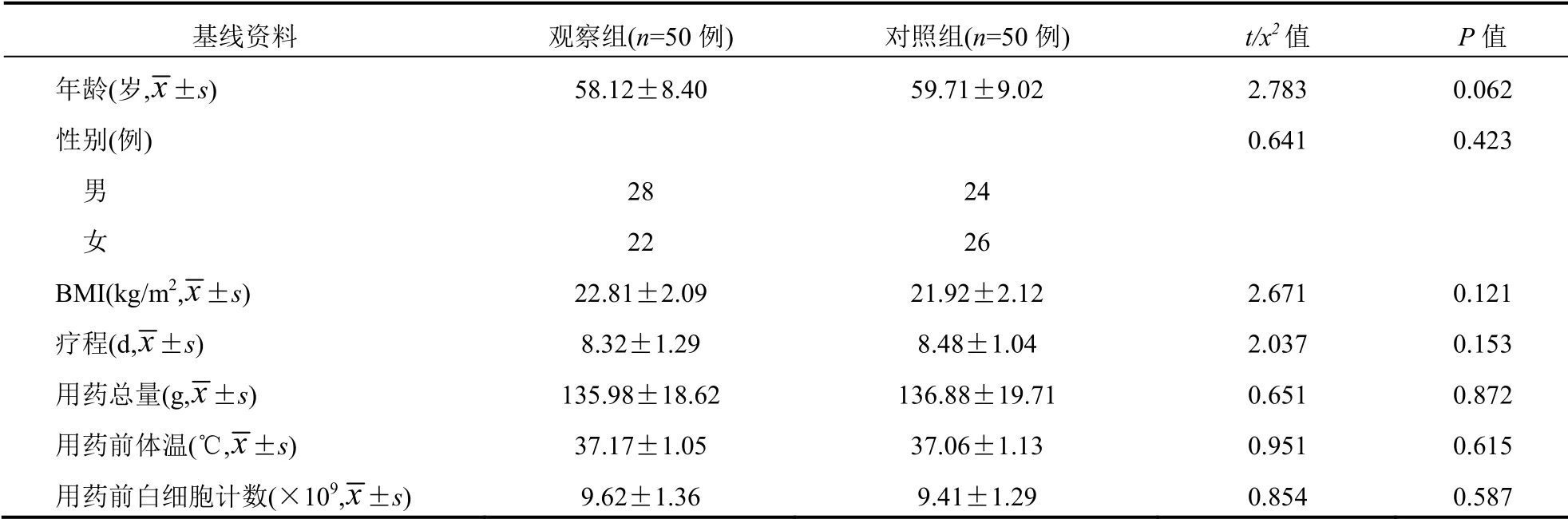
表1 两组患者基线资料均一性比较
2.2 观察组与对照组细菌清除率与临床治疗有效率比较
观察组细菌清除41 例,细菌清除率为82.00%;对照组细菌清除39 例,细菌清除率为78.00%;观察组与对照组细菌清除率比较差异无统计学意义(χ2=0.250,P=0.617)。见表2。
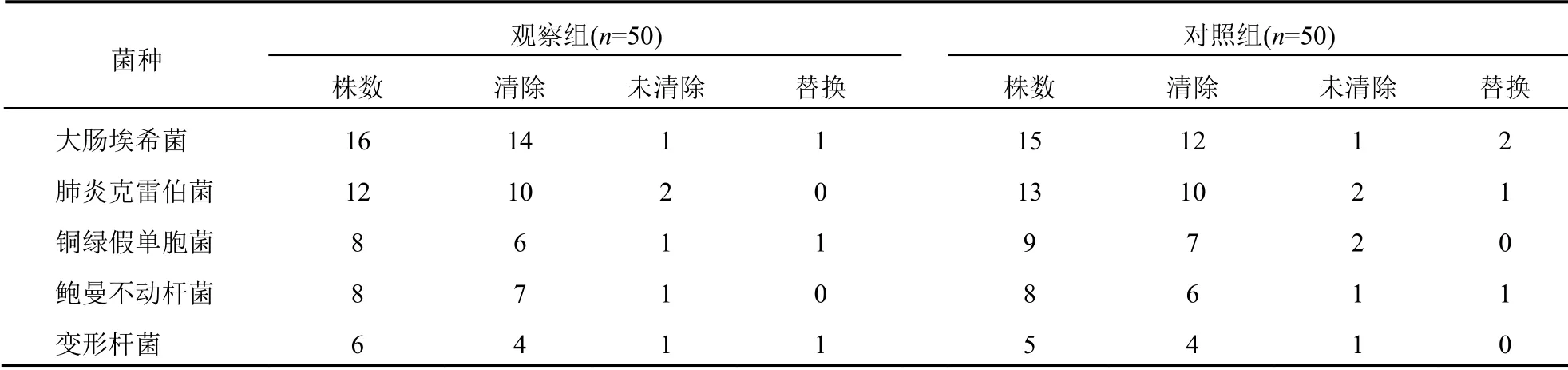
表2 观察组与对照组患者细菌清除情况比较
观察组与对照组临床治疗有效率比较差异无统计学意义(P>0.05)。见表3。
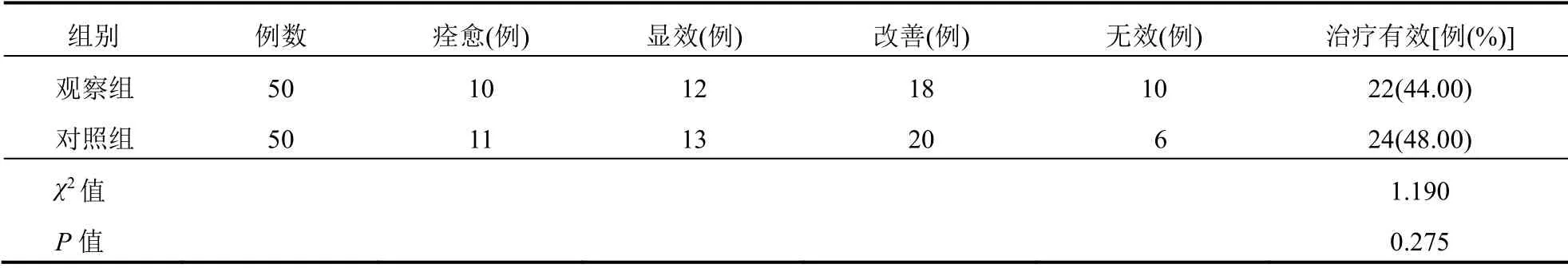
表3 观察组与对照组患者临床治疗有效率比较
2.3 观察组与对照组MIC 比较
观察组与对照组大肠埃希菌MIC90 均为32 mg/L;肺炎克雷伯菌MIC90 均为32 mg/L;铜绿假单胞菌MIC90 均为40 mg/L;鲍曼不动杆菌MIC90 均为40 mg/L;变形杆菌MIC90 均为16 mg/L;观察组与对照组MIC90 比较差异无统计学意义(P>0.05)。
2.4 观察组与对照组成本-效果比较
观察组C/E 显著高于对照组(t=8.951,P=0.000)。见表4。

表4 观察组与对照组患者成本-效果比较
2.5 观察组与对照组不良反应情况比较
观察组与对照组不良反应发生率比较差异无统计学意义(P>0.05)。见表5。
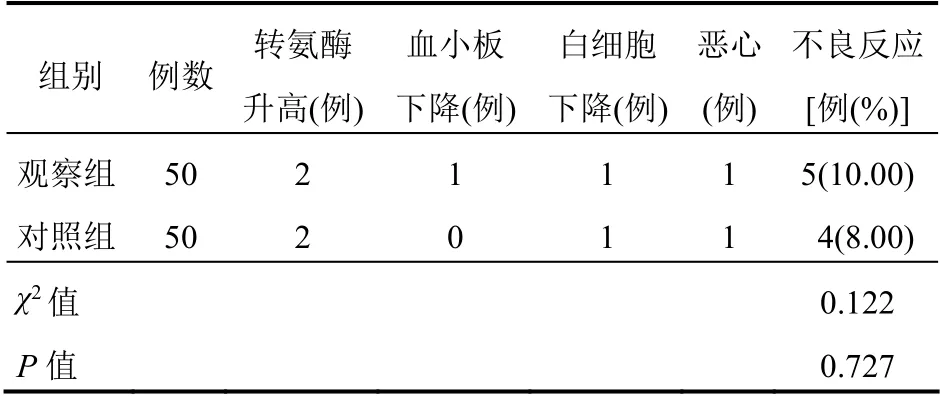
表5 观察组与对照组患者不良反应情况比较
3 讨论
仿制药是指原研药(又叫专利药)专利到期后上市的仿制品,也被称为非专利药。仿制药应与原研药具有相同的活性成分、给药途径[16]。与原研药相比,仿制药价格低,可有效降低医疗支出,提升公众健康水平,具有良好的经济效益和社会效益,是巨大的社会公共财富[17]。目前,市场上出现了头孢哌酮分别与他唑巴坦、舒巴坦组成的复方制剂,且配比组成不同,头孢哌酮舒巴坦主要有1∶1、2∶1组成,头孢哌酮他唑巴坦有4∶1、8∶1 组成,头孢哌酮舒巴坦有原研药和仿制药[18-19],这对于减少医保以及患者的经济负担有重要意义。然而,也有研究报道尽管原研药与仿制药含量相近,但仿制药中不同的赋形剂或添加剂等辅料也会对药品质量产生影响,患者还可能会对特定产品中的辅料产生不良反应,使用仿制药可能会增加不良反应发生率[20-21]。因此,正确有效地选择仿制药辅料对保证与原研药同等的治疗效果方面非常重要。
本研究通过对原研药与仿制药头孢哌酮复方制剂其配方比值对产ESBL 肠杆菌科细菌的体外MIC及作用效果的对比发现,原研药头孢哌酮复方制剂与仿制药头孢哌酮复方制剂临床有效率无显著差异,提示复方制剂虽然药物配方比例不同,但临床效果相当。本研究显示原研药头孢哌酮复方制剂与仿制药头孢哌酮复方制剂的细菌清除率也无显著差异,这表明原研药头孢哌酮复方制剂与仿制药头孢哌酮复方制剂在进入体内后,药物活性相当,对细菌的清除能力无显著差异性。本研究发现两药物MIC 无显著统计学差异,表明两药物体外抑菌能力差异无统计学意义。克拉维酸对许多临床上重要的β-内酰胺酶具有很强的抑制活性,但对染色体介导的β-内酰胺酶无效[22]。舒巴坦稳定,除了质粒β-内酰胺酶外,还对染色体产生的诱导酶也有一定的抑制作用,抑酶谱较广,与克拉维酸敏感细菌谱也不完全相同[23]。因此,从理论上讲头孢哌酮+酶抑制剂组成的复方制剂具有良好的抗菌活性。两组毒副作用比较,本研究发现两药品不良反应发生率也无显著差异,提示两药品的安全性较好。然而,仿制药头孢哌酮复方制剂C/E 显著低于原研药,表明原研药品在效果等同的情况下有更高的经济负担。本研究使用的仿制药头孢哌酮舒巴坦与原研药成分相似,临床疗效确切肯定,提示仿制药抗菌谱广,对产ESBL 肠杆菌具有良好抗菌活性,仿制药的临床应用可能有益于降低整体医疗费用成本。
综上所述,仿制药头孢哌酮复方制剂与原研药头孢哌酮复方制剂在临床有效率、细菌清除率、MIC及不良反应发生率方面无显著差异性,但C/E 显著低于原研药头孢哌酮复方制剂。需注意的是,在仿制药的研发以及生产过程中应该严格遵守相关标准,确保其治疗效果。

