不同孕周使用胰岛素对妊娠糖尿病患者血糖控制情况及妊娠结局的影响
武红
新泰市人民医院产科,山东新泰 271200
妊娠糖尿病(gestational diabetes,GDM)是妊娠女性特有的疾病, 即妊娠前有潜在糖耐量减退或糖代谢正常的女性在妊娠期时确诊的糖尿病[1]。据相关调查显示,我国GDM 的发病率约占所有妊娠女性的1%~5%,若血糖未得到有效的控制可以引起羊水过多、早产、巨大儿、妊娠高血压、难产等问题,给母儿的健康与安全带来危机[2]。 同时,虽然多数糖代谢异常的孕产妇产后血糖可以恢复正常, 但在一定程度上增加了近远期2 型糖尿病的患病风险[3]。 目前,在饮食与运动等常规干预的基础上, 针对血糖难以达标的GDM 患者应首先推荐胰岛素治疗。 然而,临床关于胰岛素治疗GDM 的起始孕周并无明确定论[4]。为了进一步完善GDM 患者的治疗方案,该研究选择2020 年7 月—2021 年6 月就诊的GDM 患者82 例为研究对象, 对不同孕周接受胰岛素治疗后血糖的控制情况与妊娠结局进行分析,现报道如下。
1 资料与方法
1.1 一般资料
选取该院收治的GDM 患者82 例为研究对象。纳入标准:符合9 版《妇产科学》[5]中对于GDM 的诊断标准,以及胰岛素治疗指征;采用饮食及运动等非药物干预后血糖控制效果仍不理想; 首次发生GDM;年龄20~35 周岁;患者具有良好的沟通能力与依从性,自愿配合相关研究,并对研究内容完全知情。 排除标准:服用过降糖药物者;孕前有糖尿病史者;合并其他妊娠与内外科合并症及并发症者;肝肾功能不全者;血液与免疫系统疾病者;患有精神疾病者。 82 例研究对象根据使用胰岛素治疗时的孕周进行分组,其中孕周≥32 周为对照组,孕周<32 周为研究组, 每组41 例。 研究组年龄22~35 岁, 平均(29.04±1.02)岁;孕次1~5 次,平均(1.85±0.12)次;其中初产妇22 例, 经产妇19 例; 体质指数(body mass index, BMI)19.01~29.65 kg/m2,平 均(25.65±2.02)kg/m2。对照组年龄21~35 岁,平均(29.08±1.15)岁;孕次1~5 次,平均(1.84±0.15)次;其中初产妇22例, 经 产 妇19 例;BMI 19.20~29.22 kg/m2, 平 均(25.58±2.15)kg/m2。 两组患者年龄、孕次、产次、BMI指数的一般资料对比,差异无统计学意义(P>0.05),具有可比性。 该研究方案已取得该院医学伦理委员会的批准。
1.2 方法
两组均采取常规饮食与运动常规干预措施,其中饮食控制包括:脂肪25%、蛋白质20%、碳水化合物55%,热量30 kJ(kg·d)。 在此基础上,对照组孕周≥32 周时使用胰岛素治疗, 研究组孕周<32 周使用胰岛素治疗,直至结束妊娠。(1)胰岛素治疗指征[5]:①医学营养干预2 周,血糖难以达标(餐后2 h 血糖>6.7 mmol/L,空腹血糖>5.3 mmol/L);②医学营养干预后,患者血糖达标,但出现酮症;③医学营养干预后,血糖达标,但出现体质量减轻。(2)胰岛素治疗方法:两组均使用短效胰岛素诺和灵R(国药准字S20191007,规格:3 mL:300 IU)于三餐前进行皮下注射,首次用量为4~6 U,之后根据血糖指标进行调整。血糖控制标准:夜间血糖与餐后2 h 血糖在4.4~6.7 mmol/L,餐前血糖3.5~5.3 mmol/L。
1.3 观察指标
针对两组以下指标进行观察与对比。 ①治疗前与分娩时的血糖指标:餐后2 h 血糖、空腹血糖。 ②妊娠结局:剖宫产、早产、羊水过多、宫内窘迫、妊娠高血压。③新生儿结局:巨大儿、新生儿低血糖、新生儿窒息。
1.4 统计方法
采用SPSS 23.0 统计学软件处理数据, 符合正态分布的计量资料用(±s)表示,采用t检验;计数资料用[n(%)]表示,采用χ2检验,P<0.05 为差异有统计学意义。
2 结果
2.1 两组患者治疗前与分娩时血糖指标对比
治疗前, 两组餐后2 h 血糖与空腹血糖指标对比,差异无统计学意义(P>0.05);分娩时,两组餐后2 h血糖与空腹血糖指标均低于治疗前, 差异有统计学意义(P<0.01),但两组餐后2 h 血糖与空腹血糖指标对比,差异无统计学意义(P>0.05)。 见表1。
表1 两组患者治疗前与分娩时血糖指标对比[(±s),mmol/L]

表1 两组患者治疗前与分娩时血糖指标对比[(±s),mmol/L]
注:与同组治疗前对比,*P<0.01
?
2.2 两组患者妊娠结局对比
两组剖宫产、妊娠高血压发生率对比,差异无统计学意义(P>0.05);研究组早产、羊水过多、宫内窘迫发生率低于照组,差异有统计学意义(P<0.05)。 见表2。
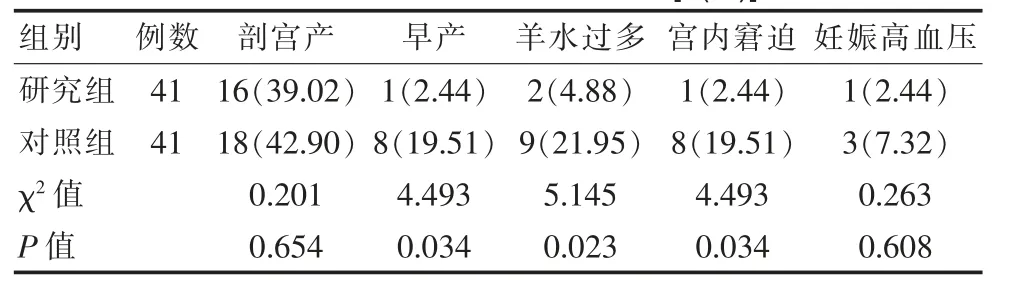
表2 两组患者妊娠结局对比[n(%)]
2.3 两组新生儿结局对比
两组新生儿低血糖、新生儿窒息发生率对比,差异无统计学意义(P>0.05);研究组巨大儿发生率低于对照组,差异有统计学意义(P<0.05)。 见表3。
3 讨论
GDM 是妊娠期常见的合并症, 通常情况下,胎儿主要通过胎盘获取母体中的葡萄糖而保持能量供应,但随着宫内胎儿不断发育,其对葡萄糖的需求量不断增加, 加之孕期肾小球滤过率与肾血浆流量提升,肾小管对于糖的吸收率却未增加,致使妊娠期女性排糖量随之升高[6]。 同时,妊娠中期与晚期时体内拮抗胰岛素物质分泌增多, 导致胰岛素敏感度随着孕周增加而下降,造成胰岛素分泌缺失,部分胰岛素分泌异常的女性,妊娠期难以代偿此类生理变化,最终血糖升高并引起GDM[7]。
妊娠期一旦发生GDM,患者血糖水平可见持续性升高,之后经胎盘到达胎儿体内,刺激其胰岛B 细胞出现增生与肥大,并分泌大量的胰岛素,加快肝内蛋白质、糖原与脂肪合成,继而引起生长过快、宫内缺氧与髓外造血功能进等问题[8-9]。 同时,GDM 能够导致患者体内葡萄糖利用率缺失,干扰代谢功能,损坏胎儿生长环境,降低免疫功能,增加羊水量,提高早产与感染等不良结局风险[10]。 目前,GDM 患者主要采用饮食与运动干预, 对于血糖控制不理想者则首选胰岛素进行治疗[11]。 然而,临床关于GDM 患者胰岛素治疗的起始时间仍未有明确定论[12]。 通常情况下,孕32~33 周是胰岛素使用量的最高峰,此阶段孕妇抗胰岛素物质分泌量较高, 且是胎儿生长育的旺盛时期,所以该研究选择32 周为界限进行分组研究[13]。黄英[14]针对不同时间接受胰岛素治疗者进行研究,结果显示孕早期组(孕周<32 周)羊水过多与早产率低于孕晚期组(孕周≥32 周)。 该文结果与此结果相近, 分娩时两组餐后2 h 血糖与空腹血糖指标均低于治疗前(P<0.01),但两组餐后2 h 血糖与空腹血糖指标结果对比,差异无统计学意义(P>0.05)。两组剖宫产、妊娠高血压发生率对比,差异无统计学意义(P>0.05);研究组早产、羊水过多、宫内窘迫发生率低于对照组(P<0.05)。 可见,不同孕周使用胰岛素治疗GDM 对于血糖的控制效果相当。 同时,剖宫产易受社会因素的影响, 不利于判断与胰岛素起始孕周的相关性;妊娠高血压的发病机制十分复杂,通常与胰岛素抵抗关系密切, 但控制血糖对于胰岛素的逆转效果并不明确, 所以不同孕周的妊娠高血压发生率未见明显差异[15]。 然而,尽早采取胰岛素治疗利于产妇胰岛B 细胞功能恢复, 对于早产、 羊水过多、宫内窘迫的发生率具有显著的抑制作用。
宫内发育是生命的初始阶段, 宫内环境良好利于胎儿成长, 保障新生儿的健康。 有研究指出,在GDM 影响下能够增加巨大儿的发生风险,而巨大儿易引起产后出血、胎膜早破、肩难产、新生儿窒息等并发症[16]。 有研究发现,巨大儿糖代谢紊乱与肥胖症的发生率较正常新生儿高[17]。于兰群[18]对40 例GDM患者进行研究, 结果发现妊娠<32 周使用胰岛素治疗的观察组患者巨大儿发生率显著低于妊娠≥32周胰岛素治疗对照组(P<0.05)。 该文结果显示,两组新生儿低血糖、新生儿窒息发生率对比,差异无统计学意义(P>0.05);研究组巨大儿发生率较对照组低(P<0.05)。 可见,孕早期采用胰岛素控制血糖指标能够调节胎儿胰岛素分泌,维持各类物质代谢平衡,继而降低了巨大儿的发生风险,保障其生长发育质量。
综上所述,不同孕周使用胰岛素治疗GDM 对于血糖的控制效果相当, 但早期使用胰岛素能够有效改善妊娠结局, 降低巨大儿的发生率。 需要注意的是,由于该次研究未进行产后随访,所以关于不同孕周使用胰岛素对于GDM 产后血糖指标与远期并发症的影响仍有待进一步的观察与研究。

