光强调制型SPRi生物传感器的应用及分析方法
朱天逸 许晟熙 李杭 刘星宇 王诗韵
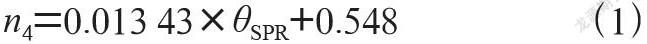



摘 要:表面等离体激元共振是一种在生物化学、生物分析化学和生物医学等领域中得到广泛应用的光学传感技术,因其高通量、无需标记、高灵敏度等优点受到越来越广泛的重视。该研究通过分析SPRi(SPRi maging)传感器对不同折射率的样品与共振角的检测规律,得出系统应用于样品折射率、生物膜样品厚度分布及覆盖面密度检测的方法;从两种物质相互作用的平衡反应原理推导、分析了SPRi传感器进行实时分子相互作用检测的方法,为SPRi传感器的应用实验提供借鉴。
关键词:SPRi;生物传感器;分子相互作用
中图分类号:TP212 文献标识码:A文章编号:2096-4706(2022)01-0113-03
Abstract: Surface plasmon resonance is an optical sensing technology widely used in biochemistry, bioanalytical chemistry and biomedicine and other fields. It has attracted more and more attention because of its high throughput, no marking required and high sensitivity. By analyzing the detection law of SPRi (SPRi maging) sensor for samples with different refractive index and resonance angle, this study obtains the method applied to the detection of sample refractive index, biofilm sample thickness distribution and coverage density; based on the equilibrium reaction principle of the interaction between two substances, the method of real-time molecular interaction detection by SPRi sensor is deduced and analyzed, which provides reference for the application experiment of SPRi sensor.
Keywords: SPRi; biosensor; molecular interaction
0 引 言
表面等离体激元共振(surface plasmon resonance, SPR)是一种20世纪90年代发展起来的表面光学分析技术[1-3]。具有灵敏度高、生物样品无须标记、无须纯化、实时监测、速度快、样品消耗量少、无损伤等特点,广泛应用于生物、化学、药学、医学、环境科学检测,特别是在生物大分子相互作用的实时检测、医疗诊断、药物开发、环境监测、食品安全等领域具有独特的优势。SPR生物传感器可以实现生物分子相互作用的无标记、高灵敏度和实时分析,可以在生物化学、生物分析化学和生物医学中广泛应用[4,5]。这种方法已经成功应用到不同生物分子相互作用的研究中,比如抗原—抗体[6,7]、蛋白质-DNA[8]、DNA杂交[9]、DNA-RNA[10,11]和蛋白质-糖类[12,13]的相互作用。
SPR传感器原理为,一束p偏振光以大于临界角的入射角θ照射在玻璃与金属膜界面,发生全内反射;改变θ,当表面等离体波波矢ksp与光波在界面方向的分量kx匹配相等时,会发生反射光被金属等离子体吸收现象,激发表面等离体激元共振,反射光能量急剧下降,达到最低。SPR对金属膜表面的介质的折射率的改变极其敏感,折射率的微小变化都会引起SPR角的变化,对同一种介质,在金属膜表面的结合量不同同样会引起SPR响应强度的不同。基于这样原理,SPR生物传感器主要应用在检测样品折射率、检测生物膜厚度及覆盖面密度、实时检测生物分子相互作用。基于此,本研究将对SPR传感器对金膜表面贴附的不同样品的折射率与共振角的检测规律进行分析,得出系统应用于样品折射率、生物膜样品厚度分布及覆盖面密度检测的原理;并从两种物质相互作用的平衡反应原理推导、分析SPR传感器进行实时分子相互作用检测的方法,为SPR传感器的系统设计及后续的应用实验奠定重要的理论基础。
1 检测样品折射率变化
折射率是表征各种材料光学性质的重要参数,反映了介质的光学性质,一定条件下可以根据介质的折射率来了解介质的光学性能、纯度、质量浓度以及色散和性质。根据叙述的表面等离体激元共振的基本原理,玻璃表面所覆盖介质的折射率的细微改变都会引起共振条件的改变,从而引起共振角度θSPR的改变,这里将讨论折射率的改变与共振角变化之间的相互关系。
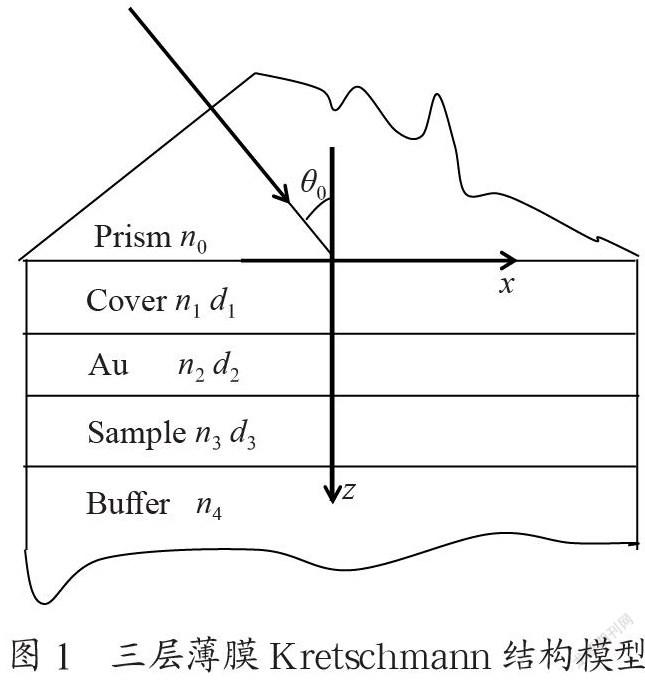
建立一种三层薄膜Kretschmann结构模型,如图1所示。系统介质共5种,入射光波长λ=632.8 nm,其中棱镜选用ZF12,折射率n0=1.711 29;盖玻片折射率为n1=1.516 8,厚度d1=0.2 mm;铬厚度d2=5 nm,折射率n2=2.97;金膜厚度d3= 50 nm,折射率n3=0.219 6+3.323 9i,所測样品折射率n4在1.331~1.345范围内逐渐增加,根据推导的多层薄膜光学系统的反射率公式得到不同样品折射率的SPR曲线。
从SPR曲线中可以得到每种折射率溶液对应不同的共振角θSPR,随着样品折射率的增加,共振角度也是不断增大的,在某一固定入射角度,样品折射率越大,其对应的反射率也越大。进一步得到环境折射率与共振角的关系图,环境折射率与共振角存在很好的线性关系,曲线经过线性拟合得到线性相关系数为1,二者的关系式:
根據这个关系,可以在实际检测实验中,由不同环境介质中测得的共振角计算出相应的环境折射率,再根据折射率与溶液质量浓度之间的函数关系计算得到溶液的浓度分数。
2 检测样品厚度及覆盖面密度
在当前分子生物学、细胞生物学研究领域中,生物膜受到越来越多的关注。生物膜的主要成分是磷脂分子,磷脂分子与其他脂分子虽然不是生物大分子,但是众多的脂分子可以自组装成膜。除了常见的脂单层膜和双层膜的研究,脂质体也是脂质膜研究的一种常见对象。
建立一种半圆柱形三层薄膜Kretschmann结构模型,系统介质共5种,分别为棱镜、铬层、金膜、生物膜和环境介质。入射光波长λ=632.8 nm,其中棱镜折射率n0=1.761 82,铬厚度d1=5 nm,折射率n1=2.97,金膜厚度d2=50 nm,折射率n2=0.219 6+3.323 9i,环境介质假设为水,折射率n4=1.33,生物膜样品的折射率n3从1.40以步长为0.05变化到1.55,厚度d3从0变化到400 nm。
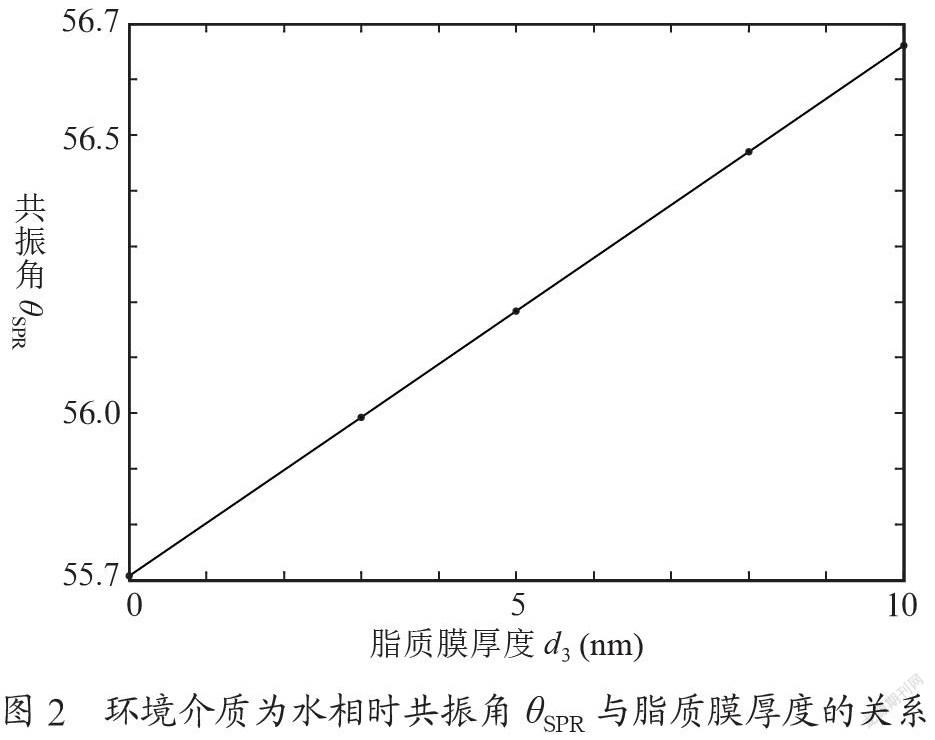
在生物膜厚度小于10 nm的条件下,生物膜厚度d3与SPR共振角θSPR存在着线性关系,即SPR生物传感器能够线性地响应样品的输入信号。椭偏仪测得脂质膜的折射率为1.45,分别模拟计算脂质膜厚度为0 nm、3 nm、5 nm、8 nm、10 nm的SPR曲线,并计算出共振角θSPR与脂质膜厚度d3的关系,如图2所示。从拟合的结果看,共振角θSPR与脂质膜厚度d3存在很好的线性关系,其线性线性相关系数为1,拟合结果为:
利用这个线性关系,实际应用中可以根据检测到的共振角θSPR来计算金膜上脂质膜覆盖的厚度。已知单层脂质膜的厚度是3.98 nm,得到单层脂质膜的共振角位移约为ΔθSPR=0.380。脂质膜是由两层磷脂分子构成的,所以单层磷脂分子的厚度大约是1.99 nm。根据方程式(2),可以计算单层磷脂分子的共振角位移为ΔθSPR=0.190,进一步计算覆盖在传感芯片上的磷脂分子层的数量。这对脂质体制备条件的探索提供了很好的理论依据。
3 实时检测分子相互作用的变化
表面等离体激元共振是一种允许实时对生物分子进行动力学和平衡结合情况检测的物理光学技术。首先将探针分子固定在传感器表面,然后将目标结合相溶液流过表面。探针分子和目标分子的相互作用将会改变金属表面的折射率,继而改变穿过金属传感器的表面等离体的性质。
两种生物大分子相互作用的过程中,有一种分子主动寻找与之相互作用的另外一种分子。相互作用主动方的分子被称为配体(ligand),被动方的分子被称为受体(receptor)。SPR传感器应用于实时检测相互作用的两种分子在金膜上的吸附与结合,先将亲和反应的一对分子中一种分子固定在金膜表面,另一种分子以溶液形式通过金膜表面时,二者的反应会引起金膜表面附近的折射率的改变,反应的传感图如图3所示。曲线部分分别表示分子相互作用中结合、解离和再生过程。
假设固定的配体L与注射通过的分析物A(受体)两种分子相互作用,形成复合体AL,这是个可逆反应式(3),符号ka和kd分别是复合体的合成速率和解离速率。
用两种分子的相互作用的结合信号曲线图拟合,而解离信号曲线的拟合可以得到kd的值,由此可以得到结合速率常数ka和解离速率常数kd。进而得到解离平衡常数和亲和力平衡常数的值。
4 结 论
此外,本章对表面等离体激元共振传感器的应用方法进行了详细分析。以三层薄膜Kretschmann结构系统为模型,讨论了SPRi系统应用于检测样品折射率的原理,得出折射率与SPR共振角的关系,以此可以根据检测的SPR共振角来获取相应的样品折射率,了解材料的光学性能参数等。另外,阐述了当前越来越受关注的生物膜样品厚度分布检测和覆盖密度检测的原理和方法。最后,对实时分子相互作用检测方面进行了理论推导和分析。讨论了分子相互作用的结合、解离速率及平衡常数的推导,为后面SPRi系统的应用研究提供相应的理论基础。
参考文献:
[1] OLARU A,BALA C,JAFFREZIC-RENAULT N,et al. Surface Plasmon Resonance (SPR) Biosensors in Pharmaceutical Analysis [J].Critical Reviews in Analytical Chemistry,2015,45(2):97-105.
[2] NGUYEN H H,PARK J,KANG S,et al. Surface Plasmon Resonance:A Versatile Technique for Biosensor Applications [J].Sensors,2015,15(5):10481-10510.
[3] HEARTY S,LEONARD P,MA H. Measuring Antibody-Antigen Binding Kinetics Using Surface Plasmon Resonance [J].Antibody Engineering,2018,1827:421-455.
[4] YU X B,XU D K,CHENG Q. Label-free detection methods for protein microarrays [J].Proteomics,2006,6(20):5493-5503.
[5] KANDA V,KITOV P,BUNDLE D R,et al. Surface Plasmon Resonance Imaging Measurements of the Inhibition of Shiga-like Toxin by Synthetic Multivalent Inhibitors [J].Analytical Chemistry,2005,77(23):7497-7504.
[6] LEE H J,YAN Y L,MARRIOTT G,et al. Quantitative functional analysis of protein complexes on surfaces [J].The Journal of Physiology,2005,563(1):61-71.
[7] HOMOLA J. Surface Plasmon Resonance Sensors for Detection of Chemical and Biological Species [J]. Chemical Reviews,2008,108(2):462-493.
[8] HOMOLA J. Present and future of surface plasmon resonance biosensors [J].Analytical and Bioanalytical Chemistry,2003,377:528-539.
[9] KANDA V,KARIUKI J K,Harrison D J,et al. Label-Free Reading of Microarray-Based Immunoassays with Surface Plasmon Resonance Imaging [J].Analytical Chemistry,2004,76(24):7257-7262.
[10] KIM S A,BYUN K M,KIM K,et al. Shuler,S J Kim.Surface-enhanced localized surface plasmon resonance biosensing of avian influenza DNA hybridization using subwavelength metallic nanoarrays [J/OL].Nanotechnology,2010,21(35):(2010-08-09).https://iopscience.iop.org/article/10.1088/0957-4484/21/35/355503.
[11] GOODRICH T T,LEE H J,CORN R M. Direct Detection of Genomic DNA by Enzymatically Amplified SPR Imaging Measurements of RNA Microarrays [J].Journal of the American Chemical Society,2004,126(13):4086-4087.
[12] GOODRICH T T,LEE H J,Corn R M. Enzymatically Amplified Surface Plasmon Resonance Imaging Method Using RNase H and RNA Microarrays for the Ultrasensitive Detection of Nucleic Acids [J].Analytical Chemistry,2004,76(21):6173-6178
[13] SMITH E A,THOMAS W D,KIESSLING L L,et al. Surface plasmon resonance imaging studies of protein-carbohydrate interactions [J].Journal of the American Chemical Society,2003,125(20):6140-6148.
作者簡介:朱天逸(1999.09—),男,汉族,江苏南京人,本科在读,主要研究方向:生物医学传感器及其应用。

