限时喂养对DNA疫苗免疫效果的影响
李方琳,梁 鹏,粟雨芯,马忠仁,苏君鸿
(1.西北民族大学 生物医学研究中心,甘肃 兰州 730030;2.西北民族大学 生命科学与工程学院,甘肃 兰州 730030)
流感是由流感病毒引起的急性呼吸道传染性疾病。流感病毒是一种高度传染性呼吸道病原体,对全球公共卫生构成重大威胁[1]。目前预防和控制流感最为有效的措施就是接种疫苗。近年来,DNA疫苗因其免疫效果好、危险性低、操作方法简便、价格低廉、易于贮藏和运输等优点引起广泛关注[2-5]。
营养、免疫功能和病理状态间的作用是相互的[6-7],营养摄入和营养状况影响宿主的免疫能力和身体对疾病或感染的反应;免疫缺陷影响营养利用,一些致病微生物或疾病可能引起营养不良和免疫缺陷,人体的生化指标测定与饮食摄入和临床检查相关联,也与免疫学测量相关联[8-9]。此外,饮食摄入量的定性和定量也参与免疫调节[10-11]。限时喂养(Time-restricted feeding,TRF)是将进食限制在特定时间。最受欢迎的TRF进食时间是8:16,意味着8 h的进食窗口之后是16 h的空腹窗口[12-15]。有研究表明,在禁食期间肠道微生物群中与抗生素活性相关的基因表达水平显著增加,同时与宿主免疫系统相关的基因表达上调[16]。本试验探讨8 h进食窗口对小鼠免疫效果的影响。
1 材料与方法
1.1 主要材料与试剂
pcDNA3.1(+)-HA重组质粒、小鼠淋巴细胞分离液(达科为生物技术有限公司)、RPMI-1640培养基、优级胎牛血清(兰州民海生物工程有限公司)、35 mm培养皿(Thermo)、200目尼龙网、15 ml离心管、96孔板、10 ml移液管、MTT试剂盒(Promega)、Con A及受体破坏酶RDE(Sigma)、BSA(索莱宝)、H1N1流感病毒(武汉生物制品研究所有限责任公司)、1%鸡红细胞(自制)、U型血凝板。
1.2 试验动物
雄性SPF级BALB/c小鼠,由中国科学院兰州兽医研究所实验动物中心提供。试验期间,所用饲料为普通小鼠生长繁殖饲料,垫料为辐照木屑,饲料及垫料均购自苏州双狮生物有限公司。
1.3 方法
1.3.1 适应阶段 4周龄、体重15~20 g的BALB/c小鼠(n=24)。试验开始前,所有小鼠被饲养在温度24.9±1.2 ℃、相对湿度50.9±7.1%、12 h的光/暗循环、无特定病原体的环境中,为期1周。适应期间小鼠可以随意获取食物和饮水,为保持环境干燥、清洁,每4 d更换1次饮水与垫料。
1.3.2 试验阶段 适应结束后,将小鼠分为2个大组,即自由进食组(N)和8 h限时喂养组(F),其中每大组又分为2个亚组,各组均经肌肉分别注射25 μg重组质粒pcDNA3.1(+)-HA及同体积生理盐水进行免疫,即pcDNA3.1(+)-HA实验组(N/F-pcDNA3.1(+)-HA),对照组(N/F-Con),每笼6只。N组小鼠全天均可自由获取食物和水。F组小鼠于初次免疫后立即进入限时喂养,即上午8:30喂养、下午4:30撤去食物,第二天上午8:30再次喂养,如此重复30 d。2周后进行加强免疫,检测小鼠指标。以初次免疫开始记为0 w。试验分组如图1所示。
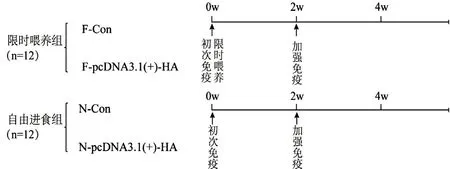
图1 试验设计
1.3.3 样本采集 以每笼为单位,F组每日8:30给食、下午4:30撤食,N组为前一天8:30给食,次日8:30撤去饲料,给饲料与撤饲料时均进行称量,二者之间的差值为小鼠每日进食量。从初次免疫开始,每周在撤去食物之前称量小鼠体重。
1.3.4 血清抗体检测
1.3.4.1 分离血清。加强免疫2周后,采集小鼠血液,室温放置2 h,2 000 rpm离心10 min,分离血清,-80 ℃备用。
1.3.4.2 制备1%鸡红细胞。对成年未经免疫的公鸡翅下采血,离心洗涤数次,取红细胞沉淀,用PBS稀释为1%,置于4 ℃备用。
1.3.4.3 四个红细胞凝集单位抗原。1个红细胞凝集单位是指能引起等量标准化红细胞凝集时的病毒量,红细胞凝集抑制试验一般采用4个红细胞凝集单位(25 μl体积中含有4个红细胞凝集单位的病毒量)。取一次性血凝板,每孔加入50 μl PBS,第一孔加入50 μl稀释后的抗原,按照1:2n倍比稀释抗原,随后每孔加入50μl 1%鸡红细胞,室温静置30 min观察结果。当结果为第一孔++++,第二孔++,第三孔+/-,第四孔-时,则该抗原稀释度为四个红细胞凝集单位抗原。
1.3.4.4 去除非特异性血凝抑制素。将小鼠血清与受体破坏酶(RDE)按照1:4混合,于37 ℃恒温过夜后,56 ℃水浴1 h,加入鸡浓缩红细胞,4 ℃放置1 h,离心,取上清备用。
1.3.4.5 红细胞凝集抑制试验(HI)。在一次性血凝板每孔加入25 μl PBS,在第1孔加入经RDE处理过的小鼠血清或标准血清,按照1:2n倍比稀释血清,第11孔吸出25 μl弃掉,第12孔不含血清。每孔加入25 μl四个红细胞凝集单位抗原,轻轻混匀,室温孵育1 h后,每孔加入1%鸡红细胞,室温放置30 min后观察结果。
1.3.5 脾细胞刺激 加强免疫2周后,BALB/c 小鼠脱颈处死,立刻泡于75%的酒精10~20 min,按照说明书分离脾脏淋巴细胞。用移液器小心吸出淋巴细胞层,转移到新的无菌离心管中,加入10 ml 1640培养基洗涤,室温下,转速250 g离心10 min,弃上清。用含有10%胎牛血清和1%双抗的1640培养基重悬细胞,最后调整细胞浓度为4×104/ml,向96孔板中每孔加入100 μl。培养24 h后,分别用5 μg/ml Con A、H1N1流感病毒、2μg/ml BSA和1640培养基作为刺激物,各组重复5孔,37 ℃、5% CO2培养48 h,加入20 μl MTT,继续培养4 h,用酶标仪在490 nm波长下测定每孔的OD值。数据表示为刺激指数(SI),即其余刺激孔的平均OD值除以培养基处理孔的平均OD值。
2 结果与分析
2.1 饮食与体重变化
通过对各组小鼠饮食与体重进行称量,结果显示,限时喂养1周后,与N组相比,F组小鼠体重较低(图2),但这种差距随着时间的推移逐渐减小,可能是在限时喂养后期,小鼠逐渐适应这种饮食模式。同时,经过对小鼠进食量进行记录统计发现,F组小鼠累计进食量减少(图3),可能是限时喂养前期F组体重较轻。
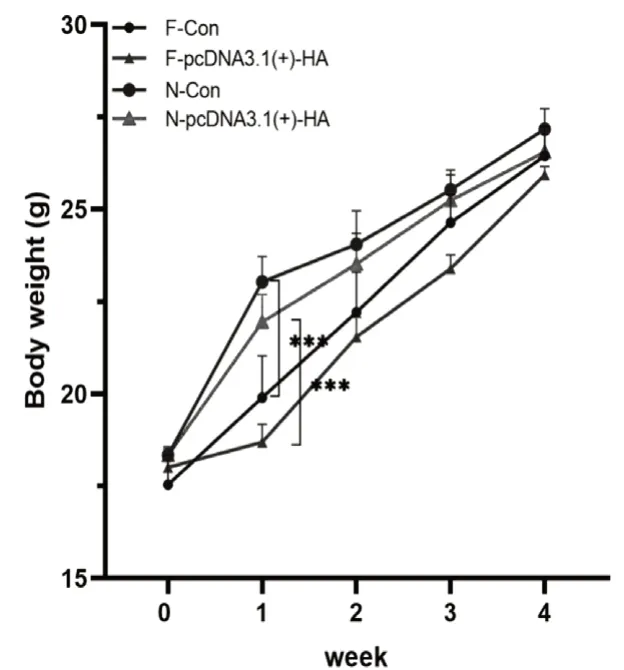
图2 限时喂养对小鼠体重的影响

图3 限时喂养对小鼠进食量的影响
2.2 血清抗体检测
使用红细胞凝集抑制试验对小鼠血清抗体进行检测,结果显示,阳性对照的完全凝集孔为第9孔,F-pcDNA3.1(+)-HA组小鼠血清完全凝集孔为第5~6孔(图4A),N-pcDNA3.1(+)-HA组小鼠血清完全凝集孔为第4~5孔(图4B),表明F-pcDNA3.1(+)-HA组小鼠血清抗体效价较N-pcDNA3.1(+)-HA组高,也意味着限时喂养在一定程度上增强了小鼠的体液免疫。
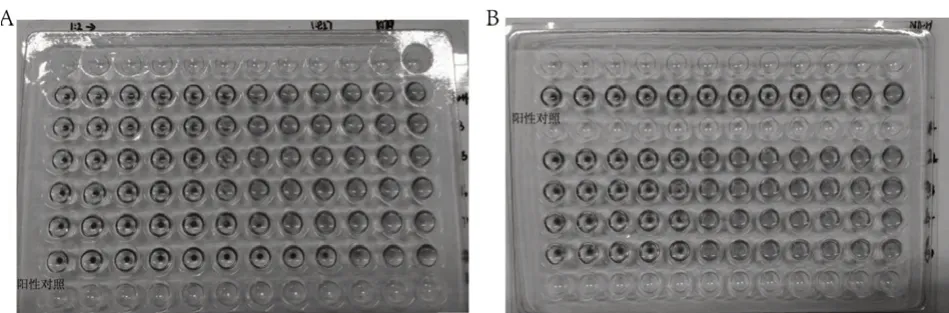
图4 小鼠血清抗体检测
2.3 脾细胞刺激
采用MTT法检测脾脏T细胞增殖情况,进一步确定限时喂养如何影响细胞免疫。如图5所示,F-pcDNA3.1(+)-HA和N-pcDNA3.1(+)-HA组对ConA以及H1N1的增殖反应明显强于F-Con组及N-Con组。F-pcDNA3.1(+)-HA对ConA以及H1N1的增殖反应明显强于N-pcDNA3.1(+)-HA,也表明限时喂养在一定程度上可以增强抗原特异性T细胞应答。

图5 小鼠脾细胞增殖情况
3 讨论
与N组相比,限时喂养4周后,无论是F-pcDNA3.1(+)-HA组还是F-Con组,累计进食量均有所下降,但对小鼠最终的体重没有明显影响。注射DNA疫苗的小鼠细胞免疫均有所增强,但F-pcDNA3.1(+)-HA组增强更加明显,该结果与体液免疫结果一致。这些结果表明,TRF在一定程度上可以增强小鼠免疫功能。

