WT-1 mRNA表达动态分析对成人急性髓系白血病患者早期复发风险的预测价值
阿依姆妮萨·阿卜杜热合曼,徐丽,艾克拜尔·阿布都热衣木,努尔阿米娜·伊明尼亚孜
急性髓系白血病(acute myeloid leukemia,AML)是目前临床较为常见的恶性骨髓克隆性疾病,根据FAB标准将AML分为M0~M7共计8种类型。目前研究显示,早期发现并通过诱导治疗可获得较好的预后,但是有部分患者在缓解一段时间后出现病情反复的情况,需要尽早开展针对性治疗延长生存周期[1-2]。WT-1是一组抑癌基因,其表达在AML患者中存在明显的差异,有研究认为WT-1 与AML患者预后存在明显相关性,但是将其运用于AML患者早期复发的研究则相对较少[3-4]。现将WT-1 运用于AML患者早期复发的预测,报道如下。
1 资料与方法
1.1 临床资料 选择2018年7月—2019年6月喀什地区第一人民医院血液内科确诊AML并经诱导治疗获得缓解的维吾尔族患者80例作为研究对象。以随访至2021年7月31日是否复发分为复发组22例和未复发58例(对照组)。复发组进行异基因干细胞移植(Allo-HSCT)治疗占比低于对照组,危险度分级高危占比高于对照组(P<0.05),2组性别、年龄、吸烟史、病程、家族遗传史、合并症、基础疾病、FAB分型等比较差异均无统计学意义(P>0.05),见表1。本研究经医院伦理委员会批准(20180627145),患者及家属均知情同意并签署知情同意书。
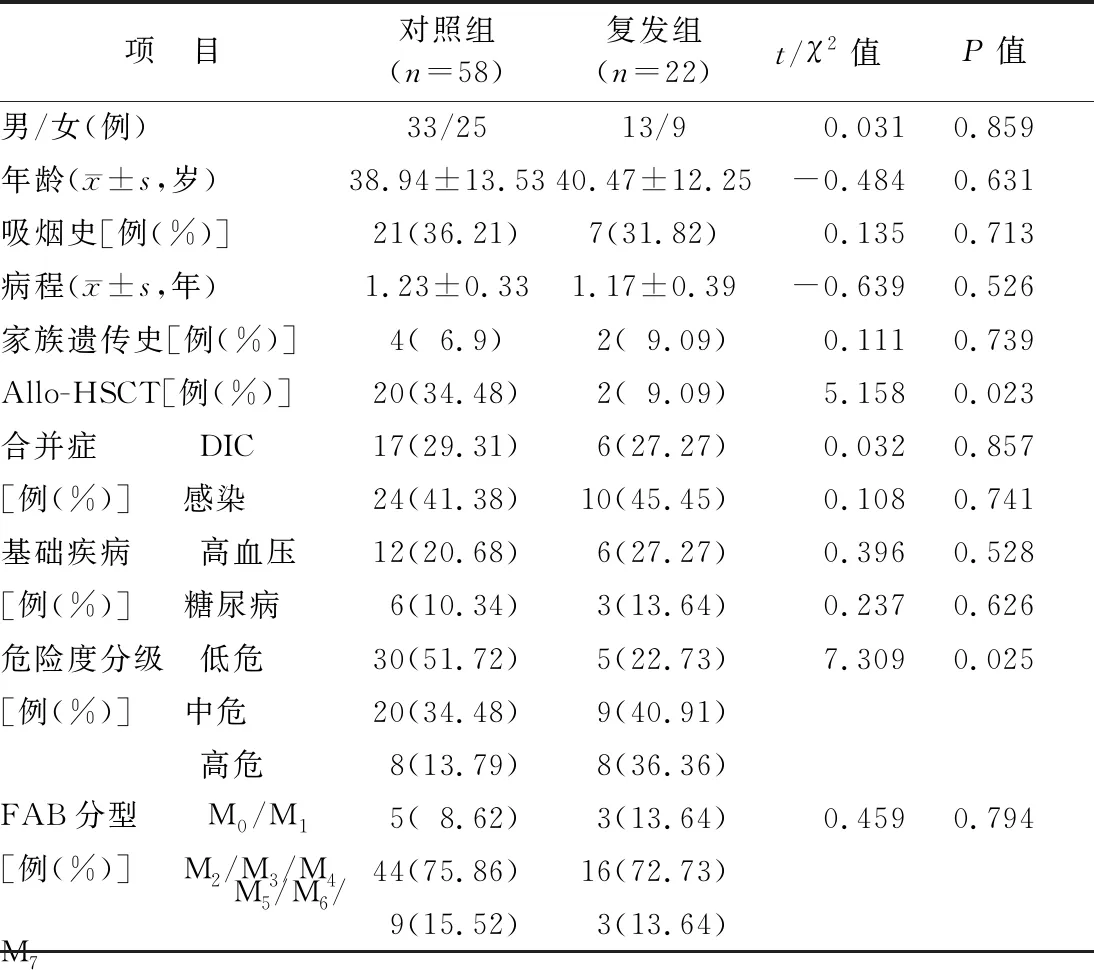
表1 复发组与对照组AML患者临床资料比较
1.2 病例选择标准 (1)纳入标准:①符合“成人急性髓系白血病(非急性早幼粒细胞白血病)中国诊疗指南(2017年版) ”[5]中对于AML的诊断标准;②首次诊断AML,且既往未接受过相关药物治疗;③年龄 18~60岁;④患者经过诱导治疗后疗效判定为病情缓解。(2)排除标准:①伴有其他恶性肿瘤疾病;②严重的肝肾功能异常;③治疗过程中出现严重不良反应;④长期免疫抑制剂、细胞毒性药物使用病史。
1.3 诱导治疗方案 根据文献[5]中相关推荐,首选方案为注射用盐酸阿糖胞苷(Ara-C,海正辉瑞制药有限公司)100~200 mg·m-2·d-1静脉滴注7 d,注射用盐酸柔红霉素(DNR,海正辉瑞制药有限公司)60~90 mg·m-2·d-1静脉滴注3 d,二者用量根据患者病情进行调整。如患者诱导治疗后缓解则采用标准剂量Ara-C(3 g/m2,1次/12 h,每个疗程6 d,共计3~4个疗程)维持治疗,条件符合患者在获得缓解后可以接受Allo-HSCT。
1.4 观测指标与方法
1.4.1 随访情况:患者完成治疗后进行为期2年随访,主要通过电话随访及患者定期到医院复查。电话随访每周进行1次,医院复查根据患者病情动态调整时间,统计随访期间无复发生存时间(relapse-free survival,RFS)。
1.4.2 实验室相关指标检测:(1)血常规。治疗前清晨抽取患者空腹静脉血7 ml,采用BC-5000型全自动血细胞分析仪及配套试剂(深圳迈瑞生物医疗电子股份有限公司生产)检测中性粒细胞绝对值(N)、血小板计数(PLT)。(2)凝血功能。上述静脉血,采用C2000-A型全自动凝血分析仪及配套试剂(深圳迈瑞生物医疗电子股份有限公司生产)检测凝血酶原时间(PT)、活化部分凝血活酶时间(APTT)、纤维蛋白酶原(Fib)。(3)基因突变。采用二代测序(NGS)检测,上述静脉血3~4 ml并提取单个核细胞,而后提取细胞内DNA制备全基因组文库,依托Ion Torrent测序平台中血液恶性疾病相关的基因情况,对患者外周血单个核细胞中的目标区域PCR富集和高通量平行测序,检测FLT3-ITD、NPM1、CEBPA及C-KIT基因突变情况。
1.4.3 WT-1 mRNA表达量检测:留取患者骨髓标本后使用TRIzol reagent 试剂盒(美国ABI公司)提取总RNA;RNA与qRT-PCR引物(WT-1 引物序列:上游引物5'-GATAACCACACAACGCCCATC-3' ;下游引物5'-CACACGTCGCACATCCTGAAT-3')混合后使用7500荧光定量 PCR 仪(美国ABI公司)反向转录到cDNA;通过将cDNA、反应酶及TaqMan探针[探针序列:5'-(FAM)CTCCAGGCACACGTCGCACATCCTG(TAMRA)-3']组成qRT-PCR反应体系后加入Step-One Plus Detection定量PCR(美国ABI公司)中进行反应。PCR反应混体系(20 μl):预混液10 μl, cDNA 1 μl, 引物1 μl,TaqMan探针0.25 μl,而后加蒸馏水配齐;反应过程:预变性95℃、30 s,变性95℃、3 s,退火60℃、30 s。总共进行40个循环。采用2-ΔΔCt法,以GAPDH(上游引物:5'-GGAGCGAGATCCCTCCAAAAT-3',下游引物:5'-GGCTGTTGTCATACTTCTCATGG-3')为内参,计算诱导治疗前后WT-1基因mRNA的表达量,而后计算WT-1 mRNA表达量差值=治疗前WT-1 mRNA表达量-治疗后WT-1 mRNA表达量,WT-1 mRNA表达量比值=治疗后WT-1 mRNA表达量/治疗前WT-1 mRNA表达量,以评估患者治疗前后WT-1 mRNA表达量动态变化情况。
1.5 疗效评价及复发判定标准 (1)缓解标准[6]:①完全缓解(CR):a.无白血病症状体征;b.骨髓原始细胞 <5%,红系、巨核系正常;c.无 Auer 小体;d.无髓外白血病;e.外周血无白血病细胞,N≥1.5×109/L,PLT≥100×109/L;f.脱离红细胞输注,达到上述所有标准记为完全缓解;②形态学CR:符合①标准中的a、b、c、d项标准,伴不全血象恢复(外周血N﹤1.0×109/L 或PLT﹤100×109/L) ;③部分缓解(PR):骨髓中原始细胞较初始检查减低至少50%视为部分缓解。(2)复发标准:根据文献[7]中说明,将病变细胞或骨髓原始细胞超过5%(除外其他原因)或髓外出现病变细胞浸润定义为疾病复发。

2 结 果
2.1 2组实验室相关指标比较 复发组FLT3-ITD突变(+)占比高于对照组,治疗前后WT-1 mRNA差值低于对照组,而治疗后WT-1 mRNA、治疗前后WT-1 mRNA比值高于对照组,差异具有统计学意义(P<0.05),见表2。
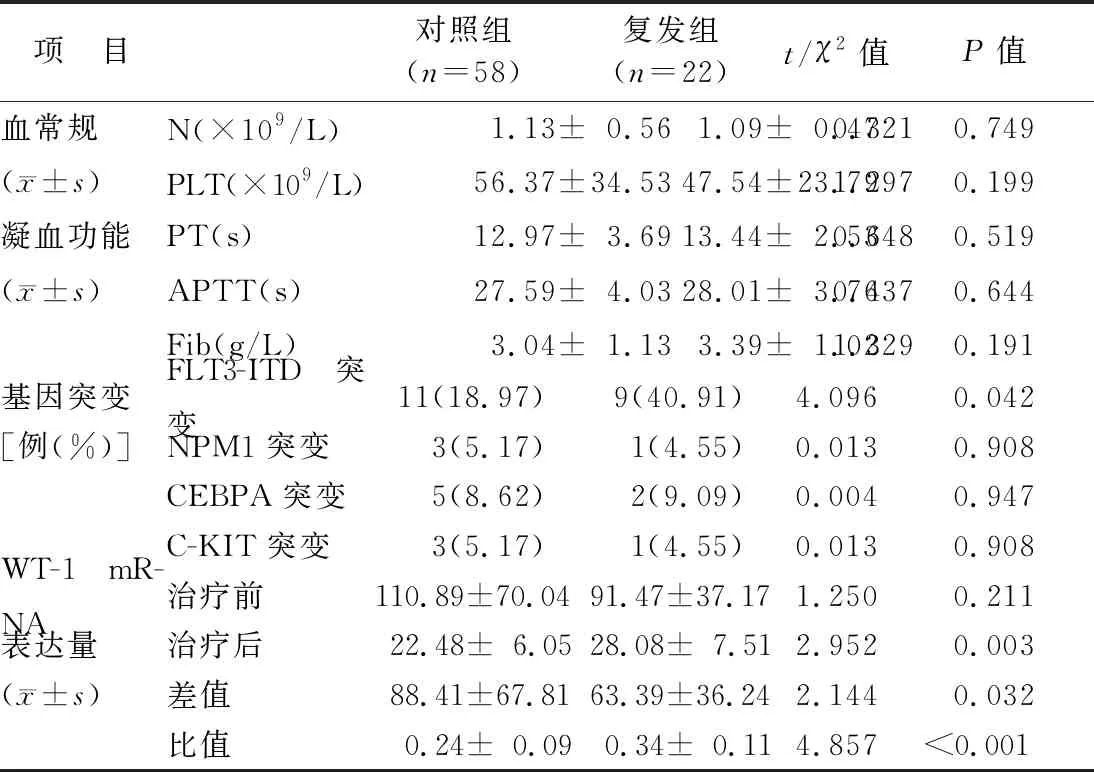
表2 对照组与复发组AML患者实验室相关指标比较
2.2 AML复发的相关因素COX回归分析 以是否复发为因变量(1=是,0=否),RFS时间为时间变量,表1、2中P<0.05项目作为自变量(Allo-HSCT:1=否,0=是;危险度分级:1=低危,2=中危,3=高危;FLT3-ITD突变:1=阳性,0=阴性;治疗后WT-1 mRNA、治疗前后WT-1 mRNA差值、治疗前后WT-1 mRNA比值取实测值)进行COX回归分析,结果显示,治疗前后WT-1 mRNA比值高、危险度分级高是AML患者复发的独立危险因素(P<0.05),见表3。
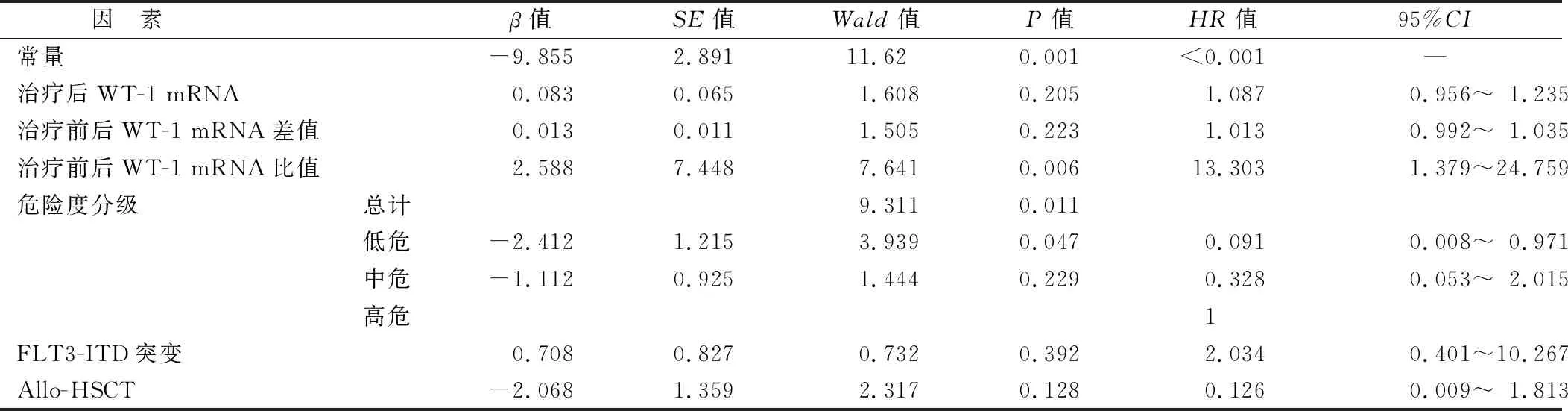
表3 AML复发的相关因素COX回归分析
2.3 AML患者复发预测的ROC曲线分析 根据COX分析结果,以治疗前后WT-1 mRNA比值建立AML患者复发的预测曲线,结果显示,治疗前后WT-1 mRNA比值预测AML患者复发的曲线下面积(AUC)为0.861,95%CI0.757~0.966,Cut-off值0.363,敏感度为0.545,特异度为0.966,约登指数为0.511,预测准确率为85.00%,见图1。
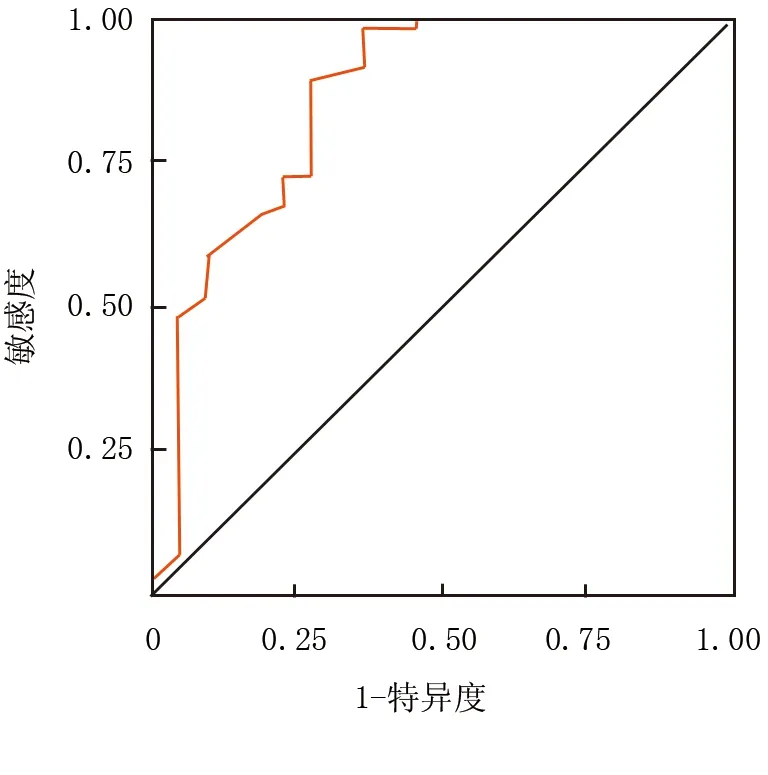
图1 治疗前后WT-1 mRNA比值对AML患者复发预测的ROC曲线
3 讨 论
长期临床观察发现,约80%的AML患者可以通过Ara-C+DNR/去甲柔红霉素诱导治疗方案获得缓解,但绝大部分患者因为疾病复发导致的死亡,是影响AML缓解后患者预后的主要因素[8]。Przespolewski等[9]研究指出,AML患者复发后再次使用标准治疗方案治疗疗效不显著,而早期针对可能复发的患者进行Allo-HSCT或靶向治疗等方案是延长患者生存期限的关键。故目前临床上针对AML复发的预测模型研究较多,也为临床治疗提供了较好的参考价值,目前AML复发的预测模型尚需要进行大量研究进一步完善,提升模型的预测效能[10]。
在既往研究中,AML初诊并经过治疗后获得CR的患者2年复发率为26%~60%[11-12],而本研究复发患者占比处于此区间的较低值,这可能与本研究中患者进行Allo-HSCT占比较高(37.93%)有关,可能是降低复发率的关键原因。而后通过单因素分析发现,2组患者危险度分级、FLT3-ITD突变情况及WT-1表达情况存在显著差异。危险度分级是目前国内外各AML诊治指南中对于AML疾病预后判定的关键因素之一[13],而危险度分级标准也是经过大量临床研究总结所指定的标准,也是AML患者制定治疗方案的主要参考因素之一。本研究中复发患者AML高危占比相对较高,说明危险度分级还可以作为判定复发的参考指标之一,是对之前研究的补充。而对于FLT3-ITD突变来说,首先其是AML患者被判定为高风险的因素之一[14];其次,研究发现FLT3-ITD突变在AML患者中发生率高达20%~30%,尽管约70% FLT3-ITD突变患者经过治疗后会发生CR,但大多数患者会最终复发并发生耐药[8, 15]。FLT3-ITD突变可能是影响患者复发的重要因素,但其具体作用机制还有待进一步研究进行探讨。WT-1在人体内扮演了转录抑制因子的角色,作为目前发现的癌细胞分化的关键基因,在多个研究中已经证实其与恶性肿瘤疾病之间的关系。在血液系统恶性疾病的相关研究中则指出,HOTAIR/miR-20a-5p/WT-1通路作为AML发生过程中的关键信号通路,其发生的反应过程可以直接促进AML病情进展,同时还可以诱导血液中的异常细胞发生耐药,从而导致AML患者疗效及预后达不到预期目标,而WT-1作为其中的关键因子,在疾病发生及发展过程中起到了不可替代的作用[16-17]。WT-1首先可以抑制IGF-Ⅱ、PDGF-A、GM-CSF、TGF-β等造血干细胞正常分化基因的表达,从而在早期分化阶段与调控骨髓内原始造血细胞的生长,导致干细胞分化被影响,从而影响AML患者病情进展[18-19];其次WT-1发生突变,还可以与EGR-1位点结合起到转录阻遏物的作用,导致细胞过度增殖而发生异常。本研究发现,治疗后2组患者WT-1 mRNA表达较治疗前显著下降,说明诱导治疗方案对WT-1的表达可以产生显著的影响,这一结果与Mehralizadeh等[20]的研究一致。但2组患者治疗前WT-1 mRNA并无显著差异,而治疗后复发组WT-1 mRNA明显较高,提示治疗后WT-1 mRNA表达量与复发有一定关系,其具体作用机制尚需要进行相关基础实验予以证实。
本研究通过COX回归分析将Allo-HSCT、FLT3-ITD突变、治疗后WT-1 mRNA表达量及治疗前后WT-1 mRNA表达量差值等相关因素排除,分析原因如下:(1)Allo-HSCT在所有患者中占比仍相对较低,样本量较少可能导致结果出现偏倚;(2)有研究提示,FLT3-ITD突变与WT-1基因表达之间存在相关性,同时之前阐述的AML患者中FLT3-ITD突变发生率也相对较低,在二者共同作用下削弱了FLT3-ITD突变与AML患者复发相关的独立性,故被排除独立相关因素;(3)基线WT-1 mRNA表达量对治疗后此基因表达也存在显著影响,而计算治疗前后差值相较于比值对于基线资料影响的效果较差,故上述2个指标均成为复发的独立影响因素。最后建立的治疗前后WT-1 mRNA比值预测AML复发的ROC曲线说明此指标对于AML患者复发具有一定的预测价值。而此指标预测特异度较好,敏感度则需要进一步加强,故可以作为预测模型中的串联指标提升模型的预测效能。
综上,WT-1 mRNA动态表达对于AML患者复发具有一定的临床价值,但本次研究具有以下几点不足:(1)本研究为单中心小样本量研究,结果出现偏倚的可能性较大;(2)本研究为临床研究,对于其中多个基因的具体作用过程是建立在既往研究基础上所得,所阐明的作用过程可能不完全,需要进一步进行基础研究探讨。故今后在开展多中心、大样本量研究探讨WT-1 mRNA与AML患者复发关系及具体作用过程的同时,还应尝试将其运用于AML患者预测综合模型构建中,并进一步探讨综合模型的效能。
利益冲突:所有作者声明无利益冲突
作者贡献声明
阿依姆妮萨·阿卜杜热合曼:提出研究思路,设计研究方案,课题设计,论文撰写,论文修改;徐丽:提出研究思路,设计研究方案,论文审核;艾克拜尔·阿布都热衣木:实施研究过程,资料搜集整理;努尔阿米娜·伊明尼亚孜:进行统计学分析

