溶剂诱导吡唑啉酮和靛红的缩合反应研究*
刘金香,聂隆骏,张 勇
(赣南师范大学 化学化工学院,江西 赣州 341000)
吡唑啉酮是一类含有两个连续氮原子的五元杂环骨架,它广泛存在于天然生物碱和药物分子中,具有镇痛、解热、抗病毒、抗菌、抗炎、抗肿瘤、抗艾滋病毒等作用,被认为是一类重要的药效基团[1].不仅如此,由于吡唑啉酮具有多个不同的反应活性位点,它还可以作为一类功能强大的合成子被广泛应用于有机合成中[2].因此,该类化合物合成引起了研究者们的广泛关注[3-4].近年来,人们发展了各种合成吡唑啉酮类化合物的方法.尽管如此,发展简洁、高效合成吡唑啉酮类化合物的方法依然是有机合成领域的热点研究问题.
有机化学反应通常都需要在溶剂中进行.各类溶剂由于性质不同,对反应的速率、区域选择性和立体选择性都会产生不同程度的影响.因此,溶剂的合理使用是有机合成中一个极为重要的问题.最近,课题组在研究水相反应时发现:水在酰基化合物的亲核加成反应中发挥着极为重要的作用,它不仅可以加速反应的进行,还可以有效地调控反应的选择性[5-10].受此启发,本文研究吡唑啉酮与靛红的亲核加成反应,发现水可以有效地促进该反应的进行,而所得到的亲核加成产物在无水溶剂中会自发的发生脱水反应.该方法可以在无催化剂和添加剂的条件下,仅通过溶剂改变,制备得到一系列吡唑啉酮-氧化吲哚烯烃类化合物.
1 实验部分
1.1 仪器与试剂
核磁共振仪(Bruker Avance Ⅲ-400);红外光谱仪(Nicolet IS50);靛红(A.R),3-甲基-1-苯基-2-吡唑啉-5-酮(A.R),二甲基亚砜(A.R)等试剂均为国产分析纯.
1.2 合成靛红烯烃吡唑啉酮的实验操作
于10 mL反应瓶中分别加入吡唑啉酮(1.0 mmol)、靛红(1.0 mmol)和5 mL去离子水,室温反应1 h.过滤,所得固体用水洗涤后真空干燥得中间化合物3.将3溶解于1 mL无水DMSO溶液中,室温搅拌48 h,反应结束后,在反应体系中加入10 mL水,乙酸乙酯(3×10 mL)萃取,合并有机相并用无水硫酸钠干燥.浓缩,将所得残留物经柱层色谱分离,得到相应的产物4.
1.3 结构表征
(E)-3-(3-Methyl-5-oxo-1-phenyl-1H-pyrazol-4(5H)-ylidene)indolin-2-one (4a).Dark red solid; 53.4 mg, 88% yield.1H NMR (400 MHz, DMSO-d6): δ (ppm)10.91(1H, s),9.05(1H,d,J=8.0 Hz),7.84(2H,d,J=7.6 Hz),7.45-7.41 (3H,m),7.23-7.19(1H,m),6.96(1H,t,J=7.6 Hz),6.81(1H,d,J=8.0 Hz),2.50(3H,s).13C NMR(100 MHz,DMSO-d6):δ(ppm)19.7,110.4,118.6,121.3,121.7,125.1,128.2,128.9,130.9,136.3,137.5,140.3,147.0,148.4,163.7,167.0.IR (KBr):v 692 760 1102 1298 1334 1464 1596 1689 1722 2928 3158 cm-1.
(E)-5-Chloro-3-(3-methyl-5-oxo-1-phenyl-1H-pyrazol-4(5H)-ylidene)indolin-2-one (4b).Dark red solid;58.4 mg,86% yield.1H NMR(400 MHz,DMSO-d6):δ(ppm)11.07(1H,s),9.18(1H,s),7.85(2H,d,J=7.6Hz),7.52-7.44(3H,m),7.26-7.23(1H,m),6.86(1H,d,J=8.4 Hz),2.53(3H,s).13C NMR(100 MHz,DMSO-d6):δ(ppm)19.8,111.5,118.5,122.2,125.0,125.4,128.8,129.2,130.0,135.1,137.2,138.7,137.2,138.7,145.5,148.1,163.5,166.5.IR(KBr):v 695 761 1151 1311 1453 1593 1686 1725 2910 3122 cm-1.
(E)-5-Bromo-3-(3-methyl-5-oxo-1-phenyl-1H-pyrazol-4(5H)-ylidene)indolin-2-one (4c).Dark red solid;63.4 mg, 83% yield.1H NMR (400 MHz,DMSO-d6):δ(ppm)11.07(1H,s),9.31(1H,s),7.85(2H,d,J=8.0 Hz),7.62(1H,d,J=8.4 Hz),7.46(2H,t,J=8.0 Hz),7.26-7.23(1H,m),6.81(1H,d,J=8.4 Hz),2.52(3H,s).13C NMR(100 MHz,DMSO-d6):δ(ppm)19.8,111.9,113.1,118.5,122.7,125.0,128.8,129.2,132.7,137.2,137.8,138.6,145.8,148.1,163.5,166.4.IR(KBr):v 682 759 1150 1310 1452 1593 1685 1724 2927 3122 cm-1.
(E)-5-Methyl-3-(3-methyl-5-oxo-1-phenyl-1H-pyrazol-4(5H)-ylidene)indolin-2-one (4d).Dark red solid;52.0 mg,82% yield.1H NMR(400 MHz,DMSO-d6):δ(ppm)10.79(1H,s),8.89(1H,s),7.87-7.84(2H,m),7.45(2H,t,J=8.0 Hz),7.24-7.23(2H,m),6.71(1H,d,J=7.6 Hz),2.50(3H,s),2.24(3H,s).13C NMR(100 MHz,DMSO-d6):δ(ppm)19.6,20.7,110.1,118.6,124.4,125.0,127.9,128.9,130.4,131.0,136.9,137.4,140.6,144.9,148.3,163.7,167.0.IR(KBr):v 691 759 958 1123 1334 1464 1596 1689 1722 2933 3158 cm-1.
(E)-5-Methoxy-3-(3-methyl-5-oxo-1-phenyl-1H-pyrazol-4(5H)-ylidene)indolin-2-one (4e).Dark red solid;54.0 mg,81% yield.1H NMR(400 MHz,DMSO-d6):δ(ppm)10.67(1H,s),8.78(1H,s),7.84(2H,d,J=8.0 Hz),7.47-7.43(2H,m),7.24-7.21(1H,m),7.05(1H,d,J=6.8 Hz),6.73(1H,d,J=8.8Hz),3.72(3H,s),2.50(3H,s).13C NMR(100 MHz,DMSO-d6):δ(ppm)19.6,55.5,110.7,115.8,118.7,121.8,122.7,125.1,128.2,128.9,137.4,140.8,141.1,148.3,154.1,163.7,167.0.IR(KBr):v 692 764 937 1171 1315 1489 1592 1688 1722 2093 3130 cm-1.
(E)-1-Methyl-3-(3-methyl-5-oxo-1-phenyl-1H-pyrazol-4(5H)-ylidene)indolin-2-one (4f).Dark red solid;53.4 mg, 84% yield.1H NMR(400 MHz,CDCl3):δ(ppm)9.28(1H,d,J=7.2 Hz),7.93(2H,d,J=6.8 Hz),7.43-7.04(5H,m),6.73(1H,d,J=6.4 Hz),3.19(3H,s),2.65(3H,s).13C NMR(100 MHz,CDCl3):δ(ppm)20.2,26.3,108.3,119.3,121.4,123.1,125.4,129.0,130.0,131.8,135.7,137.9,139.2,147.6,148.8,164.1,166.2.IR(KBr):v 694 761 1011 1098 1292 1339 1370 1478 1610 1690 1721 2926 cm-1.
(E)-3-(3-Methyl-5-oxo-1-phenyl-1H-pyrazol-4(5H)-ylidene)-1-phenylindolin-2-one (4g).Dark blue solid;64.2 mg,85% yield.1H NMR(400 MHz,CDCl3):δ(ppm)9.37(1H,d,J=8.0 Hz),7.95(2H,d,J=8.0 Hz),7.57(2H,t,J=7.6 Hz),7.48-7.35(6H,m),7.24-7.21(1H,m),7.10(1H,t,J=8.0 Hz),6.71(1H,d,J=7.6 Hz),2.65(3H,s).13C NMR(100 MHz,CDCl3):δ(ppm)20.3,109.7,119.3,121.3,123.6,125.5,127.0,128.9,129.0,130.1,130.5,131.9,133.7,135.7,137.9,138.9,147.7,148.9,164.1,165.8.IR(KBr):v 695 757 1106 1182 1365 1478 1597 1686 1721 2938 cm-1.
(E)-1-Benzyl-3-(3-methyl-5-oxo-1-phenyl-1H-pyrazol-4(5H)-ylidene)indolin-2-one (4h).Dark red solid;63.2 mg,80% yield.1H NMR (400 MHz,CDCl3):δ(ppm)9.30(1H,d,J=7.6 Hz),7.95(2H,d,J=8.0 Hz),7.46-7.42(2H,m),7.36-7.21(7H,m),7.03(1H,t,J=7.6 Hz),6.68(1H,d,J=7.6 Hz),4.93(2H,s),2.70(3H,s).13C NMR(100 MHz,CDCl3):δ(ppm)20.2,43.9,109.3,119.4,121.5,123.2,125.5,127.3,128.1,129.0,129.1,130.4,131.9,135.3,135.7,137.9,139.1,146.8,148.9,164.2,166.4.IR(KBr):v 705 756 1103 1176 1290 1353 1499 1601 1692 1717 2940 cm-1.
(E)-3-(1-(4-Chlorophenyl)-3-methyl-5-oxo-1H-pyrazol-4(5H)-ylidene)indolin-2-one (4i).Dark red solid;54.6 mg,81% yield.1H NMR(400 MHz,DMSO-d6):δ(ppm)10.91(1H,s),9.04(1H,d,J=8.0 Hz),7.91-7.87(2H,m),7.51-7.43(3H,m),7.00-6.96(1H,m),6.83(1H,d,J=8.0 Hz),2.51(3H,s).13C NMR(100 MHz,DMSO-d6):δ(ppm)19.6,110.4,119.8,121.3,121.7,127.9,128.7,128.8,130.9,136.3,136.4,140.6,147.1,148.7,163.7,166.9.IR(KBr):v 679 757 1123 1332 1490 1573 1682 1713 2932 3128 cm-1.
(E)-3-(1-(4-Bromophenyl)-3-methyl-5-oxo-1H-pyrazol-4(5H)-ylidene)indolin-2-one (4j).Dark red solid;62.8 mg,82% yield.1H NMR(400 MHz,DMSO-d6):δ(ppm)10.91(1H,s),9.03(1H,d,J=8.0 Hz),7.85-7.82(2H,m),7.63-7.60(2H,m),7.45(1H,t,J=7.6 Hz),6.98(1H,t,J=8.0 Hz),6.83(1H,d,J=7.6 Hz),2.51(3H,s).13C NMR(100 MHz,DMSO-d6):δ(ppm)19.5,110.3,116.8,120.1,121.2,121.7,127.8,130.9,131.7,136.4,136.7,140.6,147.1,148.7,163.7,166.9.IR(KBr):v 677 762 1124 1336 1488 1566 1690 1719 2925 3156 cm-1.
(E)-3-(3-Methyl-5-oxo-1-(p-tolyl)-1H-pyrazol-4(5H)-ylidene)indolin-2-one (4k).Dark red solid;56.4 mg,89% yield.1H NMR(400 MHz,DMSO-d6):δ(ppm)10.91(1H,s),9.09(1H,d,J=7.6 Hz),7.74(2H,d,J=8.4 Hz),7.48-7.44(1H,m),7.25(2H,d,J=8.4 Hz),7.01-6.97(1H,m),6.84(1H,d,J=8.0 Hz),2.52(3H,s),2.32(3H,s).13C NMR(100 MHz,DMSO-d6):δ(ppm)19.5,20.4,110.3,118.6,121.3,121.7,128.2,129.2,130.8,134.2,135.1,136.2,140.2,146.9,148.1,163.5,166.9.IR(KBr):v 679 757 1123 1332 1490 1573 1682 1713 2927 3128 cm-1.
(E)-3-(1-(4-Methoxyphenyl)-3-methyl-5-oxo-1H-pyrazol-4(5H)-ylidene)indolin-2-one (4l).Dark red solid;55.3 mg,83% yield.1H NMR(400 MHz,DMSO-d6):δ(ppm)10.90(1H,s),9.09(1H,s),7.73-6.83(7H,m),3.77(3H,s),2.50(3H,s).13C NMR(100 MHz,DMSO-d6):δ(ppm)19.5,55.2,110.2,113.9,120.6,121.3,121.6,128.2,130.7,130.8,136.1,140.1,146.9,147.8,156.1,163.3,167.0.IR(KBr):v 677 758 1126 1337 1463 1515 1687 1713 2928 3191 cm-1.
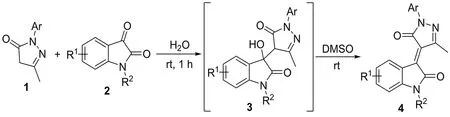
图1 吡唑啉酮-氧化吲哚烯烃类化合物合成路线

表1 溶剂优化a
2 结果与讨论
2.1 反应条件的优化
以吡唑啉酮(3-甲基-1-苯基-2-吡唑啉-5-酮)和靛红为反应原料,水为溶剂,无需任何催化剂和添加剂,室温搅拌就能制备得到中间产物3a.当对3a进行核磁测试时,我们发现它在氘代溶剂中不稳定,会自发脱水生成产物4a.受此启发,我们对3a脱水生成4a这一过程进行了溶剂优化(如表1).溶剂优化结果显示,在甲醇、四氢呋喃、1,4-二氧六环、甲苯、乙腈及水中搅拌48 h,没有任何脱水产物生成;当选用丙酮及无水DMF作为溶剂时,会生成少量的脱水产物生成(Entry 2,3);用乙醇作溶剂时相应的脱水产物可以以30%的产率分离得到(Entry 4);而使用无水DMSO作为溶剂时,我们可以以高达88%的产率分离得到脱水产物4a(Entry 7);当选用水和DMSO的混合溶剂时,却只得到10%的脱水产物,说明水的存在不利于脱水反应的进行.减少溶剂无水DMSO的用量并不能提高反应的产率(Entry 12,13).最终可确定脱水反应的最优条件是:1 mL无水DMSO,室温搅拌48 h.
2.2 反应底物拓展
在最优反应条件下,对两步法制备吡唑啉酮-氧化吲哚烯烃类化合物4进行底物拓展研究(表2).对于靛红类化合物2,无论是吸电子还是给电子基团对反应都没有明显的影响,相应的烯烃产物(4a-4e)都能以非常好的收率(81%~86%)得到.此外,靛红氮上的保护基团对反应的产率也没有明显的影响,保护基团为甲基、苯基和苄基时,均可以较高的产率(80%~85%)得到相应的产物(4f-4h).对于吡唑啉酮类化合物,苯环上包含不同取代基(如氯、溴、甲基和甲氧基)的化合物1都能很好地适用于该反应,以81~89%的产率得到相应的产物4i-4l.

表2 底物拓展a
3 结论
本文发现吡唑啉酮和靛红在纯水溶剂中能迅速地反应,而所得到的亲核加成产物在无水DMSO溶剂中可以自发脱水,从而制备出一系列吡唑啉酮-氧化吲哚烯烃类化合物,产率高达89%.该方法无需任何催化剂和添加剂,具有反应条件温和、操作简单,底物适应范围广等优点,具有潜在的实际应用价值.

