硫酸稀土复盐的碱转化反应及动力学
何仕磊,张晓伟,2,刘 芳,张子木,柳召刚,冯福山,胡艳宏
(1.内蒙古科技大学 材料与冶金学院,内蒙古 包头 014000;2.上海理工大学 材料与化学学院,上海 200093;3.东北大学 多金属共生矿生态化冶金教育部重点实验室,辽宁 沈阳 110819)
稀土复盐是稀土回收过程中的中间产物,需要经过转化并进一步加工提纯。工业稀土复盐通常是通过焙烧—硫酸浸出法得到,杂质含量较多,现有转化工艺主要有碳酸盐转化法[1-3]、草酸沉淀焙烧法[4]、氢氧化钠转化法[5]。这些方法的转化效果都较好,但有关转化机制研究尚未见报道。配合解离法[6-7]针对氟碳铈矿的分解效果较好,所得复盐本身杂质含量较低,但现有研究对此条件下所得稀土复盐的转化机制研究较少。
试验研究了氟碳铈矿的HCl-AlCl3配合解离液中加入Na2SO4得到硫酸稀土复盐,再通过加入氢氧化钠进行碱转化,将硫酸稀土复盐转化为稀土氢氧化物同时去除杂质成分,通过反应动力学分析及XRD、SEM-EDS等手段,探讨了稀土复盐碱转化反应机制。
1 试验部分
1.1 试验原料、试剂与设备
原料:硫酸稀土复盐,氟碳铈矿的HCl-AlCl3配合解离液中加入Na2SO4沉淀所得,化学成分见表1,XRD物相分析结果如图1所示,SEM-EDS分析结果如图2所示。可以看出:硫酸稀土复盐的主要物相为NaRE(SO4)2·H2O,有少量CaSO4·0.5H2O存在;硫酸稀土复盐主要形貌为六棱柱状,表面较为光滑,长度1~5 μm;主要成分是Na,O,S,Ca,RE。

表1 硫酸稀土复盐的化学组成 %
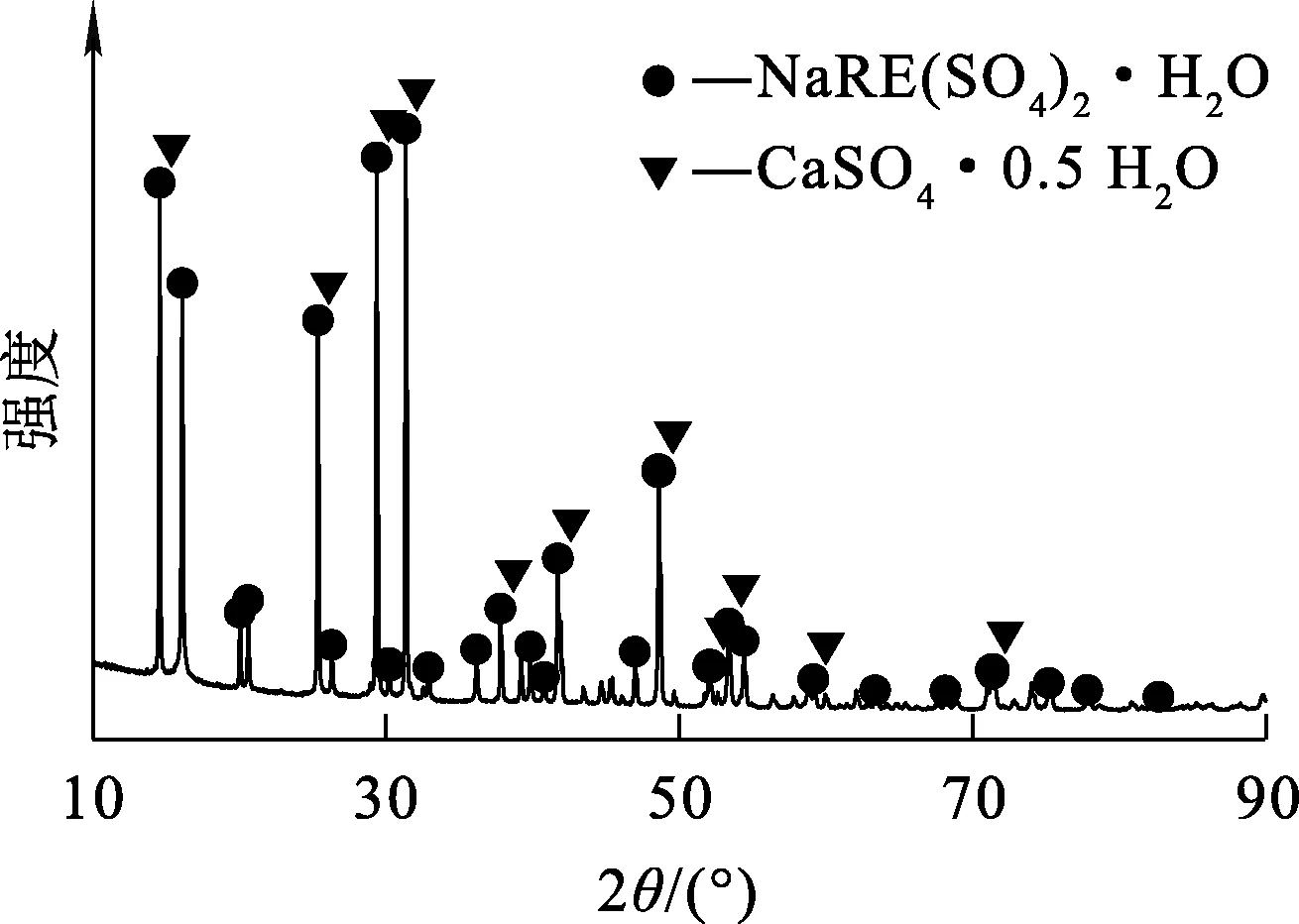
图1 硫酸稀土复盐的XRD图谱
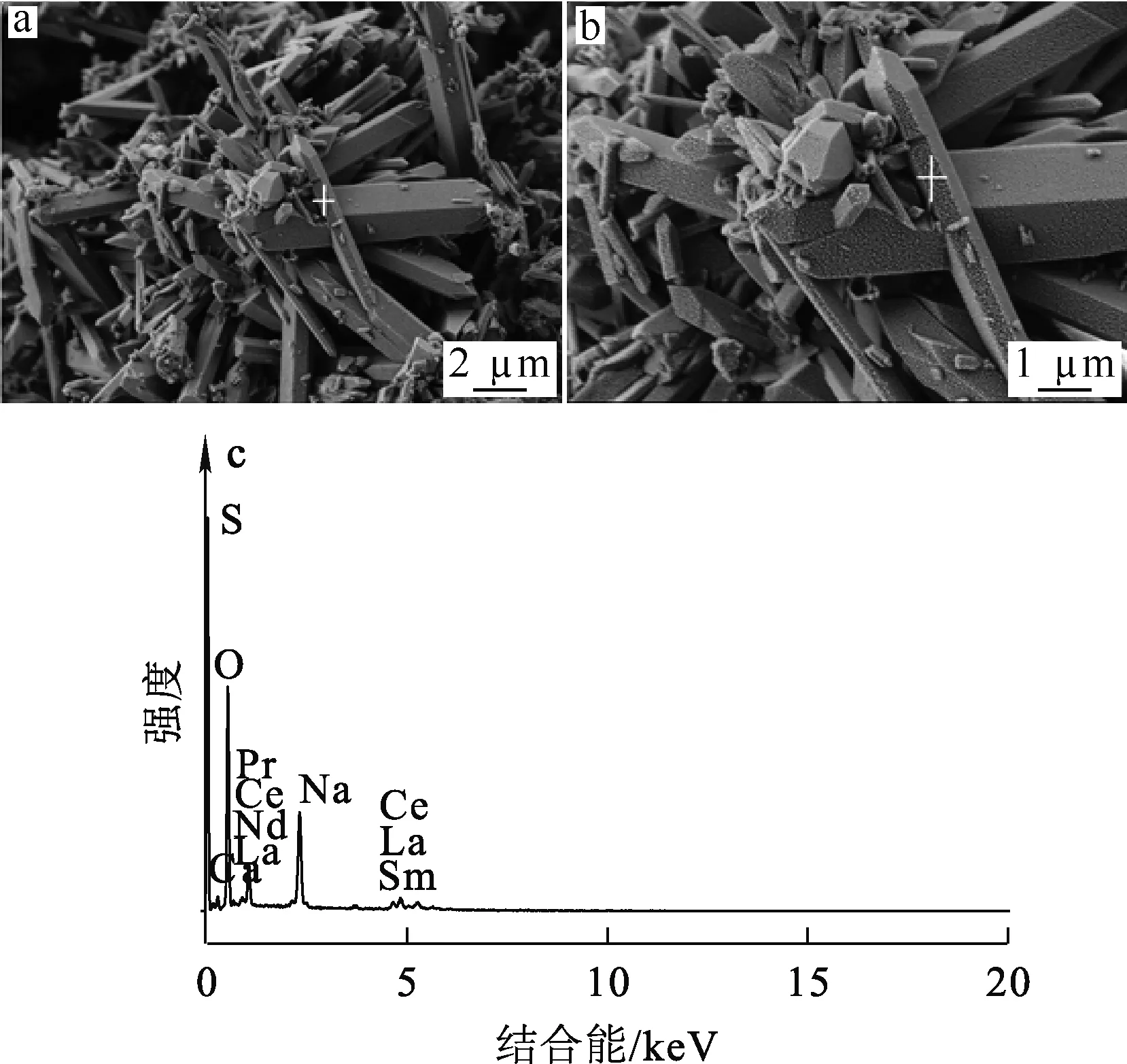
a—低倍电镜;b—高倍电镜;c—EDS能谱。
试剂:硫酸亚铁铵,N-苯代邻氨基苯甲酸,硫酸,磷酸,高氯酸,尿素,NaOH,均为分析纯。
设备:电子分析天平(上海佑科,FA2004B),智能磁力搅拌器(上海越众,ZNCL-GS190×90),X射线衍射仪(日本理学,SmartLab 9kW),真空干燥箱(上海一恒,DZF-6090),扫描电子显微镜(德国,Sigma300)。
1.2 试验方法与原理
取2 g硫酸稀土复盐于1 000 mL烧杯中,加入500 mL去离子水,搅拌溶解,烧杯放入智能磁力搅拌器中加热;温度达到设定温度后,加入一定量NaOH,磁力搅拌;一定时间后,趁热过滤,滤渣即为碱转化后的稀土氢氧化物。
产物中稀土质量分数采用GB/T 39193—2020重量法测定。
硫酸稀土复盐转化率计算公式为:
(1)
式中:x—稀土复盐转化率,%;m1—转化产物总质量,g;w1—转化产物中稀土质量分数,%;m2—硫酸稀土复盐质量,g;w2—硫酸稀土复盐中稀土质量分数,%。
稀土复盐碱转过程中发生的主要反应如下:

2RE(OH)3↓+4Na2SO4;
(2)

(3)
由上述反应看出,硫酸稀土复盐与氢氧化钠反应后,清液中含有Na2SO4和反应剩余的氢氧化钠,2种物质可进一步回收[8]。而生成的氢氧化钙属于微溶物,且原料中本身钙含量较低,生成的量非常少,故后续没有涉及钙的去除。
2 试验结果与讨论
2.1 NaOH用量对稀土复盐转化的影响
温度60 ℃,转化时间60 min,搅拌速度300 r/min,NaOH用量对稀土复盐转化率和转化产物中杂质质量分数的影响试验结果如图3所示。
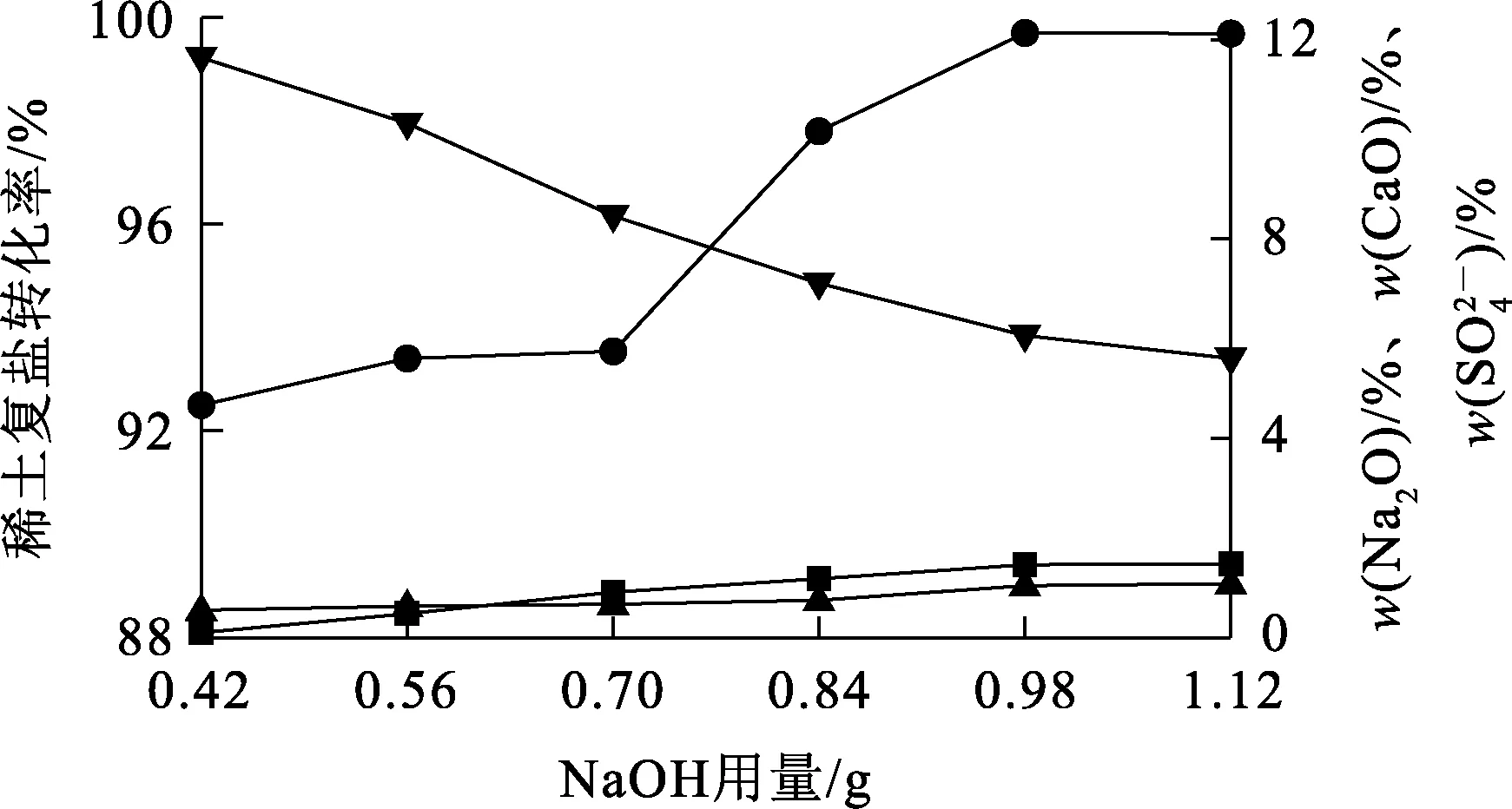
─●─稀土复盐转化率;─▲─w(Na2O);─■─w(CaO);─▼─

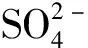
2.2 转化温度对稀土复盐转化的影响
NaOH用量0.98 g(稀土复盐质量2 g),转化时间60 min,搅拌速度300 r/min,转化温度对稀土复盐转化率和转化产物中杂质质量分数的影响试验结果如图4所示。
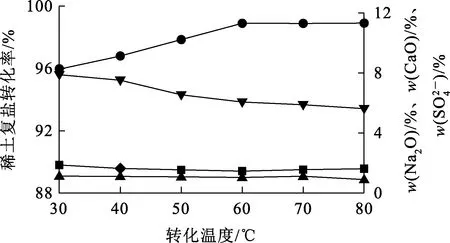
─●─稀土复盐转化率;─▲─w(Na2O);─■─w(CaO);─▼─

2.3 转化时间对稀土复盐转化的影响


─●─稀土复盐转化率;─▲─w(Na2O);─■─w(CaO);─▼─

2.4 搅拌速度对稀土复盐转化的影响
NaOH用量0.98 g(稀土复盐质量2 g),温度60 ℃,转化时间75 min,反应速度对稀土复盐转化率和转化产物中杂质质量分数的影响试验结果如图6所示。

─●─稀土复盐转化率;─▲─w(Na2O);─■─w(CaO);─▼─
搅拌可促进液固反应中的传质与扩散,有利于反应(2)正向进行,促进转化率提高,转化产物中杂质质量分数降低;但搅拌速度增大至500 r/min后,因搅拌太快导致稀土复盐和NaOH接触时间过短,影响表面反应进行,反而不利于反应进行。搅拌速度为400 r/min时,稀土复盐转化率及产物中杂质质量分数都比较理想,综合考虑,确定搅拌速度以400 r/min为宜。
2.5 转化产物表征
转化产物的XRD物相分析结果如图7所示,SEM-EDS分析结果如图8所示,成分分析结果见表2。可以看出:XRD衍射曲线中出现馒头峰[8],表明产物晶化程度较低,以非晶态为主。晶化程度一般与温度有关,温度越低,生成物的过饱和度越低,产生的晶核越少;反之,如果温度适宜,生成物的晶化程度较高。转化产物以颗粒状形式存在,大小不一,硫酸稀土复盐的六棱柱状全部被破坏;主要成分为O、RE元素,有微量S、Ca存在。Ca元素的出现是过量的NaOH与溶液中的Ca2+反应生成微溶物Ca(OH)2所致;铁、氟、磷、钍等元素含量非常低,铝和硫酸根含量相对较高,可能是水洗不充分和少量硫酸钍夹杂其中所致。
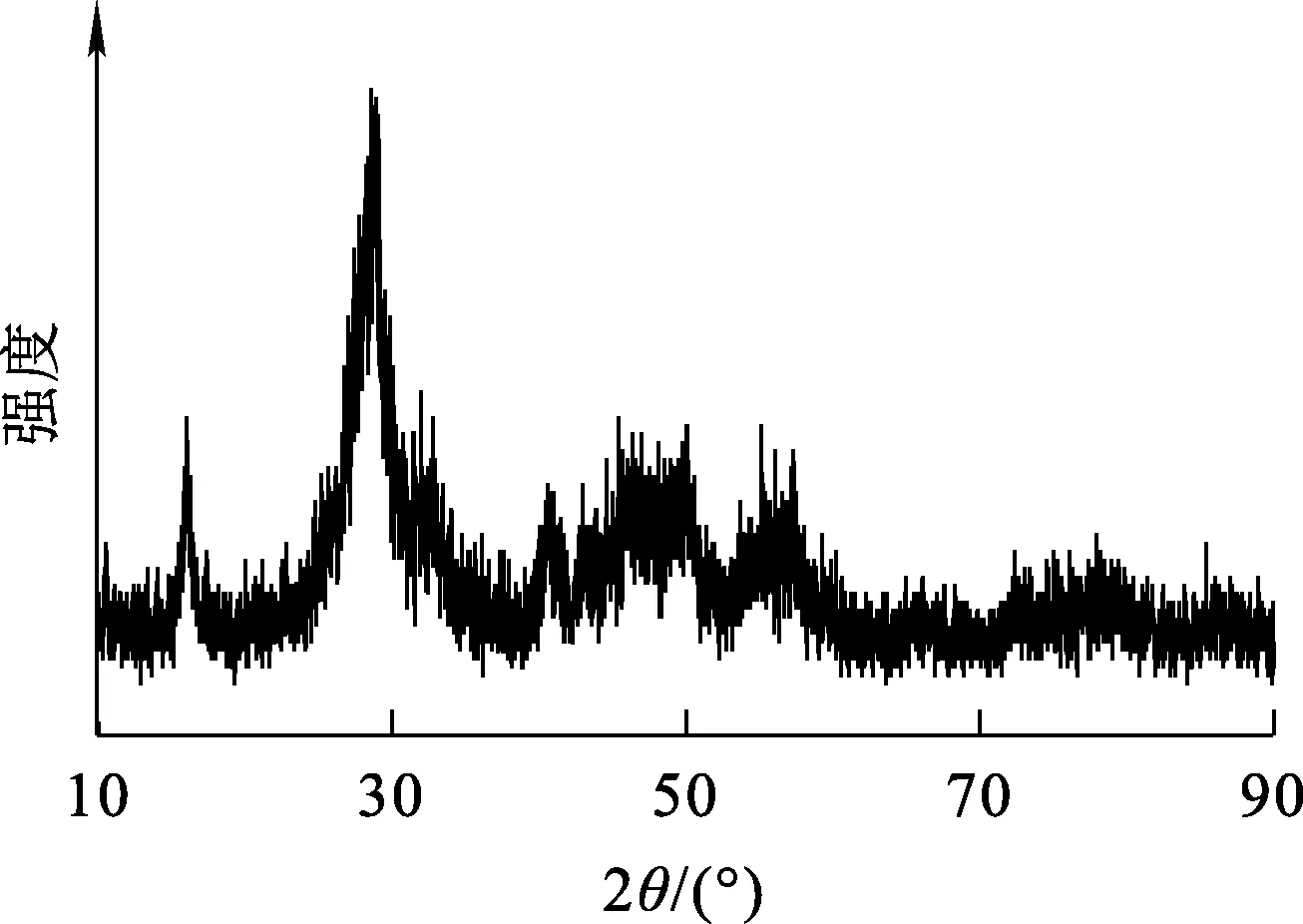
图7 转化产物的XRD图谱

a—低倍电镜;b—高倍电镜;c—EDS能谱。

表2 转化产物的化学组成 %
2.6 转化反应动力学分析
对不同温度和时间条件下所得稀土复盐转化率数据进行动力学拟合。结果如图9所示。其他反应条件:稀土复盐质量2 g,NaOH用量0.98 g,搅拌速度400 r/min。

图9 转化温度及时间对稀土复盐转化率的影响
转化反应属于液-固反应,两相界面上的反应受扩散和化学反应控制。假定反应受化学反应控制,则反应速率随温度和反应物浓度升高而快速增大,反应表观活化能大于40 kJ/mol;假定反应受扩散控制,则主要影响因素为温度和搅拌速度,反应表观活化能介于4~12 kJ/mol;如果反应表观活化能在12~40 kJ/mol之间,则反应可能受混合控制,反应温度、反应物浓度、搅拌速度都对反应有较大影响[9-10]。
相关动力学分析模型如下:
(4)
(5)
(6)
(7)
式中:k1、k2、k3、k4—反应速率常数,min-1;x—转化率,%;t—转化时间,min。
为了确定限制因素,将图9转化率代入式(4)~(6)中,所得结果对t进行线性拟合,结果线性相关系数均小于0.95,线性相关性均相对不高。由此考虑,反应可能不单独受某一种模型控制,故根据图9,将转化过程分为前30 min和后30 min,分段进行拟合。拟合所得反应速率常数和线性相关系数见表3、4。表3中,外扩散模型(4)的相关系数均大于0.95,可以很好地拟合前30 min的反应过程。但经计算,30 min内,反应表观活化能为13.27 kJ/mol,不符合化学反应控制活化能范围,故推断,前30 min的反应并不完全受化学反应控制。为了进一步确定前30 min的反应动力学,采用一种由扩散和界面传质混合控制[11-12]模型(式(7))进行拟合,结果见表3,求得反应表观活化能为33.76 kJ/mol,介于12~40 kJ/mol 之间,故推断前30 min反应受扩散和界面传质混合控制。表4中内扩散模型(5)的拟合相关系数均大于0.95,且求得反应表观活化能为11.17 kJ/mol,表明反应30 min之后受内扩散控制。

表3 不同温度下,反应前30 min的反应速率常数与相关系数
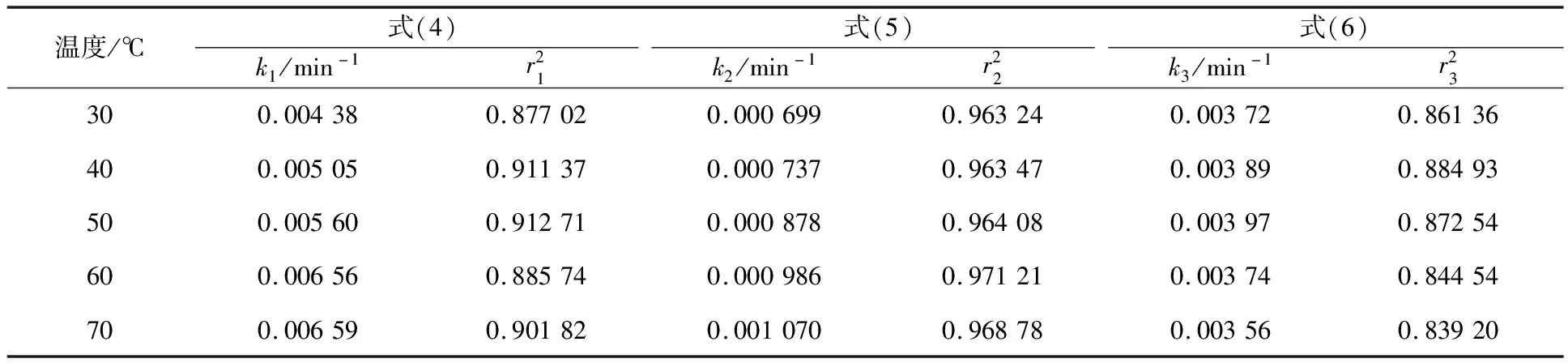
表4 不同温度下,反应30 min后的反应速率常数与相关系数
反应前30 min,1/3ln(1-x)-1+(1-x)-1/3对t的拟合曲线如图10所示,反应30 min后,1-2/3x-(1-x)2/3对t的拟合曲线如图11所示。

─●──▲──▼──■──◆─
图10~11中,直线斜率是反应速率常数k。由Arrhenius公式[13-14]对每条直线斜率取对数,构建反应30 min前、后的lnk与1/T的Arrhenius关系,结果如图12所示。对Arrhenius公式取对数,得
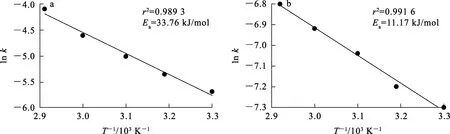
图12 反应30 min前(a)、后(b)转化反应的Arrhenius曲线
(8)
式中:Ea—反应表观活化能,kJ/mol;R—摩尔气体常数,8.314 J/(mol·K);A—指前因子。
由式(8)可知,图12中直线斜率为-Ea/R,所以可分别求得反应30 min前、后的表观活化能分别为33.76 kJ/mol和11.17 kJ/mol。
3 结论


