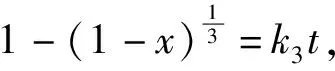铬铁矿液相氧化浸出及动力学研究
封承飞,曾 奎,田仪娟,秦险峰,全学军,李 纲,邱发成
(重庆理工大学 化学化工学院,重庆 400054)
目前,铬盐的清洁生产技术研发受到国内外广泛关注[1-3]。如中科院过程工程研究所提出的熔盐液相氧化法及钠系液相氧化法,不仅提高了生产率,也有效降低了能耗与排渣量,生产出市场需求量较大的铬酸钠[4-6]。
铬铁矿液相加压氧化浸出涉及气-液-固三相反应,且反应须在高碱浓度及氧压条件下进行,各相间传质阻力较大,从而影响反应进程[7]。目前,该浸出反应通常在加压搅拌釜中进行[8-10]。加压反应釜中,液面上空的氧气与液相间的传质、液相内固-液界面上的传质都会影响浸出过程;搅拌过程中易出现流体“打旋”或“死区”现象,使体系内物相间接触不充分,进而影响浸出效率。针对这些问题,可从搅拌桨的结构改进和在搅拌槽内添加挡板等方式强化流体混合过程[11]。这些方式在设备结构改进上各有不同,强化方法与效果也各不相同。目前,通过优化搅拌桨结构,强化固液混合体系中的传质效果已有较多成果[12];但在强化铬铁矿-氢氧化钠-氧气三相体系混合行为方面鲜见有报道。加压条件下,铬铁矿液相氧化浸出遵循未反应核模型[13-15],搅拌模式会影响浸出动力学行为。
根据铬铁矿液相氧化浸出过程中气-液-固三相传质特点[16],研究设计了一种动-静耦合搅拌系统,通过破坏反应釜中的流体旋转体,使形成多位点液面卷吸涡流,从而强化气-液-固三相传质,提高浸出效率。采用此设备,研究了铬铁矿液相氧化浸出效果及浸出反应动力学,以期为开发利用铬铁矿提供参考。
1 试验部分
1.1 试验材料与试剂
铬铁矿:取自南非,磨成粉末,中位粒径D50=28.747 μm,主要粒径在0.102~4.972 μm和13~116 μm范围内;105 ℃下干燥12 h。其主要化学成分及XRD物相分析结果分别见表1和图1。其主要物相为(Mg,Fe)(Cr,Al)2O4,可以看成是MgO·Cr2O3、FeO·Cr2O3、MgO·Al2O3、FeO·Al2O3等二元体系的固溶体。SiO2一般以MgSiO3形式存在于铬铁尖晶石晶粒之间。

表1 铬铁矿的主要化学组成 %

图1 铬铁矿的XRD分析结果
试剂:氢氧化钠、铬天青S、乳化剂OP、乙二胺、丙酮、溴代十六烷基吡啶、二苯碳酰二肼,成都科隆化工有限公司;盐酸、硫酸、磷酸、硝酸、氨水,川东化工有限公司。所有试剂均为分析纯。水为自制去离子水。
1.2 试验装置与方法
研发了一种可以强化反应釜中流体混合的动-静耦合搅拌系统。高压釜内围绕搅拌轴平行设置多个距离不等、高度不一的空心圆管静态搅拌桨。高压反应釜结构如图2所示,材质为纯镍,有效容积2 L,槽体直径和深度分别为0.11 m和0.23 m。

图2 装有动-静耦合搅拌系统的高压反应釜结构示意
称取一定质量预处理的铬铁矿于反应釜中,控制一定碱矿质量比加入氢氧化钠,再加入一定量去离子水,封闭反应釜。控制反应温度,开启搅拌。当反应温度达到设定值(控温精度±0.5 ℃)时,打开通气阀通入氧气;待氧气压力达到设定值(控压精度±0.02 MPa)开始计时;反应一定时间后,打开排气阀泄气,并冷却至90 ℃以下,开启反应釜。采用离心分离器进行固液分离,用去离子水反复洗涤滤渣。采用化学分析法测定滤液及滤渣中铬、铝含量,分别计算铬、铝浸出率。
1.3 分析表征方法
浸出液中的铬、铝质量浓度分别采用二苯碳酰二肼分光光度法(GB/T 15555.4—1995)和铬天青S分光光度法(GB/T 5750.6—2006)测定,均在相同条件下测定3次,取平均值,相对误差不超过5%。
分别采用X射线衍射仪(XRD-7000,日本岛津公司)、激光粒度仪(Bettersize 2000,丹东百特科技有限公司)、场发射扫描电镜(FEI Quanta 200,荷兰FEI公司)、波长色散X射线荧光光谱仪(XRF-1800,日本岛津公司)对铬铁矿物化性质和形貌进行表征。
采用CFD方法模拟计算动-静搅拌反应器内流场状况。模拟计算中,采用多重参考系,将桨叶所在区域设定为动区域,其他部分流域设定为静区域。采用ANSYS FLUENT 15.0稳态求解计算,模拟体系为单相,介质为液相水。
2 试验结果与讨论
2.1 不同搅拌系统的浸出效果
分别在装有动态搅拌桨和动-静耦合搅拌桨的2种反应釜中进行液相氧化浸出,试验条件:碱矿质量比5/1,铬铁矿粉(粒度300目≈48 μm)质量125 g,氢氧化钠质量分数55%,温度250 ℃,氧分压2.6 MPa、搅拌速度900 r/min。2种搅拌系统中,铬浸出率随反应时间的变化曲线如图3所示。
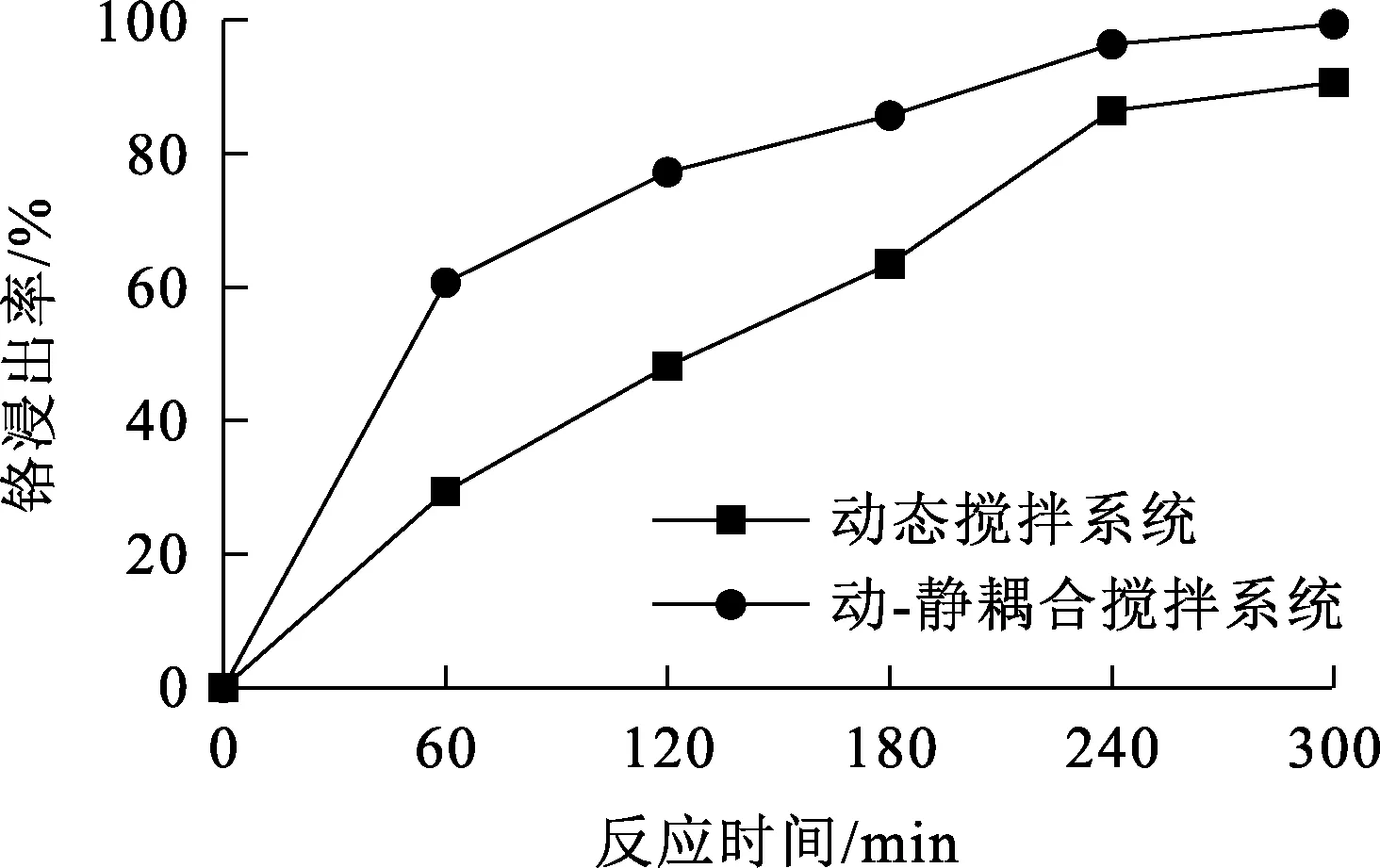
图3 2种搅拌系统的铬浸出率随反应时间的变化
由图3看出:动-静耦合搅拌系统的铬浸出率远高于动态搅拌系统的铬浸出率,仅需240 min,铬浸出率已达99%。说明动-静耦合搅拌系统对气-液-固相间传质起到了明显的强化作用[17]。
在搅拌速度500 r/min条件下,不同搅拌系统的流场数值模拟结果如图4所示。
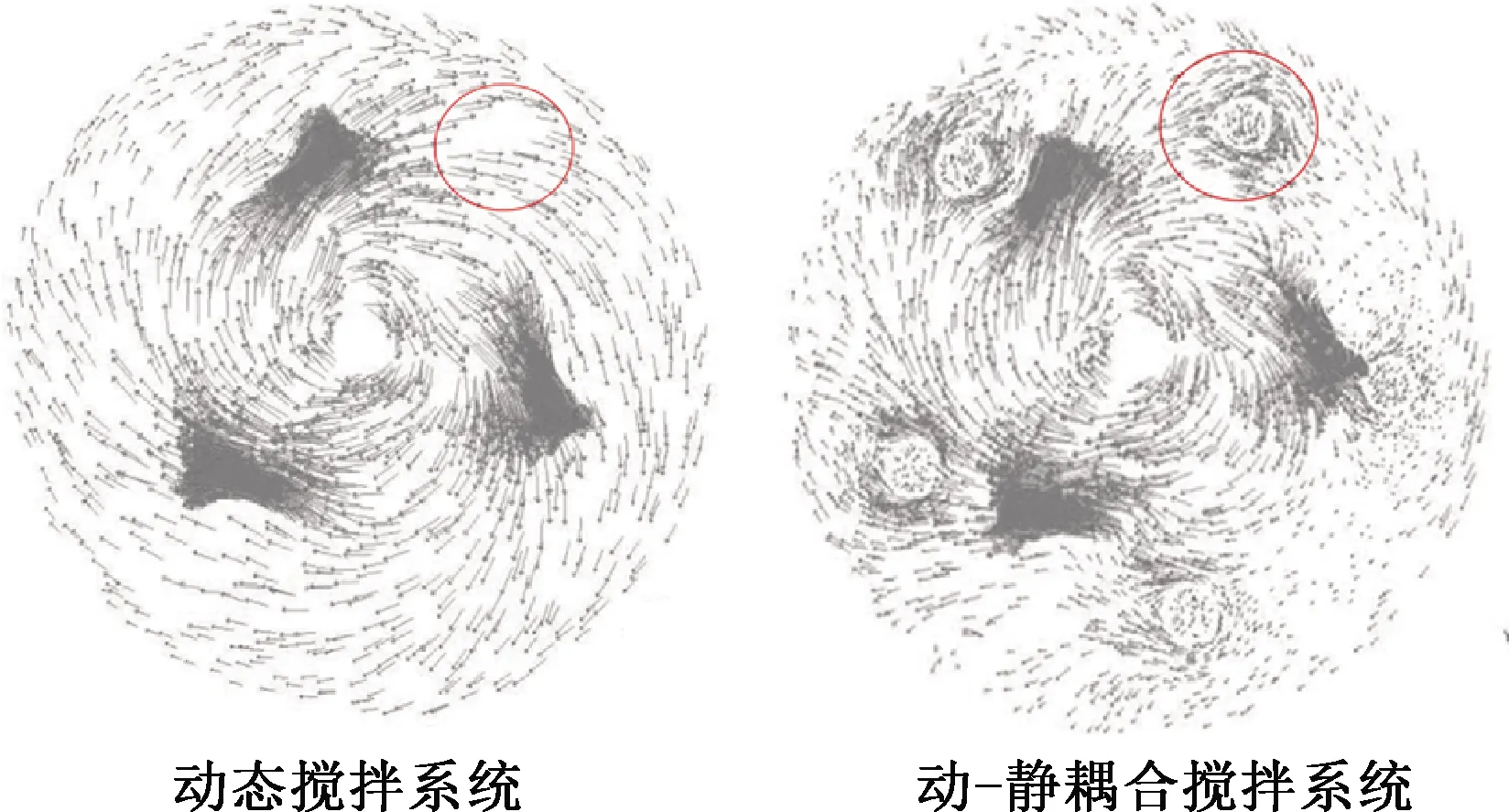
图4 不同搅拌系统的流场数值模拟
由图4看出:动-静耦合拌系统打乱了动态搅拌桨转动形成的稳定旋转体,破坏了原有稳定流场的对称性,从而使流体回转、分流,流体界面失稳;在静态搅拌桨区域形成多个局部卷吸、涡流,实现了流场中流体混合过程的调控,三相之间的传质得以加强,从而使浸出反应更充分。
2.2 铬铁矿的液相氧化浸出
2.2.1 铬铁矿粒径对铬、铝浸出率的影响
温度240 ℃,氧压2.4 MPa,搅拌速度900 r/min,碱矿质量比4/1,氢氧化钠质量分数60%,铬铁矿粒径对铬、铝浸出率的影响试验结果如图5所示。

图5 铬铁矿粒径对铬、铝浸出率的影响
由图5看出:随铬铁矿粒径减小,铬、铝浸出率提高;粒径减小至58 μm时,铬、铝浸出率均高于95%,且继续提高幅度较小。铬铁矿粒径越小,比表面积越大,越有利于与碱及氧反应。综合考虑,确定铬铁矿粒径以小于58 μm为宜。
2.2.2 碱矿质量比对铬、铝浸出率的影响
铬铁矿粒径小于58 μm,温度240 ℃,氧压2.4 MPa,搅拌速度900 r/min,氢氧化钠质量分数60%,碱矿质量比对铬、铝浸出率的影响试验结果如图6所示。
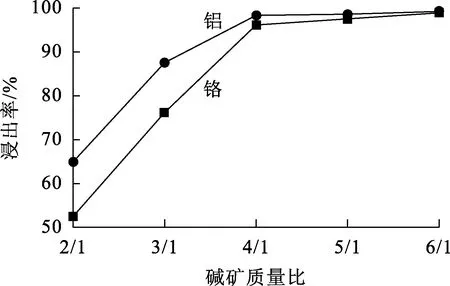
图6 碱矿质量比对铬、铝浸出率的影响
由图6看出:随碱矿质量比增大,铬、铝浸出率迅速提高;碱矿质量比增大到4/1后,铬、铝浸出率为96%左右;再进一步增大碱矿质量比,铬、铝浸出率变化不大。液相氧化反应中,实际参与反应的氢氧化钠的量较少,碱液过量会改善反应介质的流动性,提高传质速度,有利于介质间的有效混合[13]。综合考虑,为避免氢氧化钠过量导致成本过高,确定碱矿质量比以4/1为宜。
2.2.3 氧气压力对铬、铝浸出率的影响
铬铁矿粒径小于58 μm,温度240 ℃,搅拌速度900 r/min,碱矿质量比4/1,氢氧化钠质量分数60%,氧气压力对铬、铝浸出率的影响试验结果如图7所示。

图7 氧气压力对铬、铝浸出率的影响
2.2.4 搅拌速度对铬、铝浸出率的影响
铬铁矿粒径小于58 μm,温度240 ℃,碱矿质量比4/1,氢氧化钠质量分数60%,氧压2.4 MPa,搅拌速度对铬、铝浸出率的影响试验结果如图8所示。
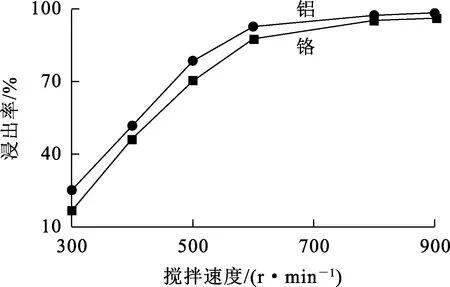
图8 搅拌速度对铬、铝浸出率的影响
由图8看出:铬、铝浸出率随搅拌速度增大而迅速提高,搅拌速度增大至800 r/min之后,铬、铝浸出率均稳定于95%左右。搅拌速度增大可以减小液-固界面间的液膜,有利于体系中各相间的混合传质,从而加速反应。综合考虑,确定搅拌速度以800 r/min为宜。
2.2.5 氢氧化钠质量分数对铬、铝浸出率的影响
铬铁矿粒径小于58 μm,氧压2.4 MPa,温度240 ℃,搅拌速度900 r/min,碱矿质量比4/1,氢氧化钠质量分数对铬、铝浸出率的影响试验结果如图9所示。
其实,数字出版产业的发展与传统出版的发展是相辅相成的。传统出版的发展会为数字出版的发展提供广阔的平台;数字出版的发展也会相应地带动传统出版的发展。如果读者在阅读完电子图书后,很喜欢此书,他会再次购买纸质图书进行阅读,因为两种阅读方式会有不同的阅读感受。所以,有的图书需要电子和纸质两种介质共同存在。电子图书适合快速阅读或消遣阅读,而纸质图书更适合慢速阅读或反复阅读。所以,数字出版物与传统出版物是相互促进、共同发展的。
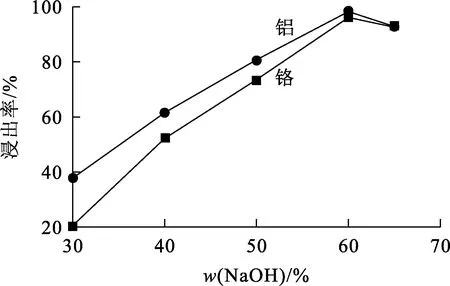
图9 氢氧化钠质量分数对铬、铝浸出率的影响
由图9看出:随氢氧化钠质量分数增大,铬、铝浸出率先快速升高,在氢氧化钠质量分数为60%时达最大,分别为96%和98%;之后,随氢氧化钠质量分数增大而下降。合适的氢氧化钠浓度可使铬铁矿与OH-充分接触,促进铬铁矿氧化分解,提高铬、铝浸出率;但氢氧化钠质量分数超过65%而碱矿质量比一定时,体系中液固体积质量比会降低,体系黏度增大,液相与反应界面之间产物浓度差减小,产物扩散脱附受阻,导致铬、铝浸出率降低[18]。综合考虑,确定氢氧化钠质量分数以60%为宜。
2.2.6 温度和时间对铬、铝浸出率的影响
铬铁矿粒径小于58 μm,氧压2.4 MPa,氢氧化钠质量分数60%,搅拌速度900 r/min,碱矿质量比4/1条件下,温度和时间对铬、铝浸出率的影响试验结果如图10所示。

—●—180 ℃;—■—200 ℃;—▲—220 ℃;—▼—240 ℃;—◆—260 ℃。
由图10看出:随温度升高,铬、铝浸出率升高;温度在180~240 ℃范围内,铬、铝浸出率增幅明显;温度在240~260 ℃范围内,铬、铝浸出率增幅逐渐变小。升温有利于各相间的传质,可促进铬铁矿的分解反应;另外,升温会降低体系黏度和矿粒周围的液膜阻力,提高界面扩散效率,加快浸出反应进程[19]。反应时间为240 min、反应温度为240 ℃时,铬、铝浸出率均超过96%,再进一步升温和延长反应时间,浸出率变化不明显且会增大能耗,综合考虑,确定反应时间为24min、温度以240 ℃为宜。
3 铬铁矿氧化浸出动力学
3.1 铬铁矿的浸出反应
铬铁矿的分子通式为(Mg,Fe)(Cr,Al)2O4,铬铁矿液相氧化浸出主要反应如下[20]:

2Na2CrO4+0.5Fe2O3+2H2O;
(1)

2Na2CrO4+MgO+2H2O;
(2)

2NaAlO2+0.5Fe2O3+H2O;
(3)

MgO+H2O。
(4)
由式(1)~(4)可知,在氢氧化钠质量分数较高(60%)和碱矿质量比较大条件下,铬铁矿液相氧化反应中实际碱耗较少,因此,碱浓度可视为基本恒定。
浸出过程中,铬铁矿颗粒表面与液相中的碱和溶解氧接触,由式(1)~(4)可知,反应生成物主要是Na2CrO4、NaAlO2、Fe2O3和MgO,其中,Na2CrO4、NaAlO2可以溶解在液相中,Fe2O3或MgO为固相。动-静耦合搅拌系统可促使矿物颗粒表面上的反应物和可溶性生成物相互扩散,以及固相产物从未反应颗粒表面剥离。随反应进行,未反应固体颗粒逐渐被反应界面包裹,导致颗粒尺寸逐渐缩小,直至反应完全后消失,浸出过程动力学符合未反应核模型[21-22]。
铬铁矿颗粒在液相氧化浸出过程中的表面形貌如图11所示。可以看出:铬铁矿颗粒表面光滑、致密,随反应进行(铬浸出率为58%),表面仍光滑但出现一些结构疏松的颗粒物黏附于表面;反应完全时(铬浸出率为96%),剩余物几乎是疏松多孔团聚体(铬渣)。铬浸出率为96%时的铬渣的主要化学组成见表2,其主要成分为Fe2O3和MgO。

a—铬铁矿;b—铬浸出率为58%时的铬渣;c—铬浸出率为96%时的铬渣。

表2 铬渣的主要化学组成 %
3.2 浸出反应动力学
铬铁矿液相氧化浸出,宏观上属于气-液-固三相反应,加压条件下,氧气溶解及溶氧在液相的传质阻力远小于固液界面上的传质阻力,因此,反应实质上可视为固-液反应,常用缩核模型描述[23]。
根据缩核模型,假设浸出过程受外扩散和内扩散控制,浸出动力学表达式如下:
x=k1t;
(5)
(6)
假设浸出过程受化学反应控制,浸出动力学表达式则为
(7)
式中:k1、k2、k3—外扩散控制、内扩散控制、化学反应控制的表观速率常数,min-1;t—反应时间,min;x—金属浸出率,%。
铬铁矿液相氧化浸出过程在260 ℃下的缩核模型拟合曲线如图12~13所示。可以看出:反应速度为界面化学反应控制时,铬、铝浸出反应的拟合效果最好,相关系数分别为0.997 0和0.996 2。这表明,氧化浸出过程属于界面化学反应控制。这与图10(b)所显示的颗粒浸出过程形态变化一致,即铬铁矿颗粒反应过程中表面仍然比较光滑、致密,固体产物和固-液界面之间的液膜不是整个反应的控制步骤。

—●—▲—■
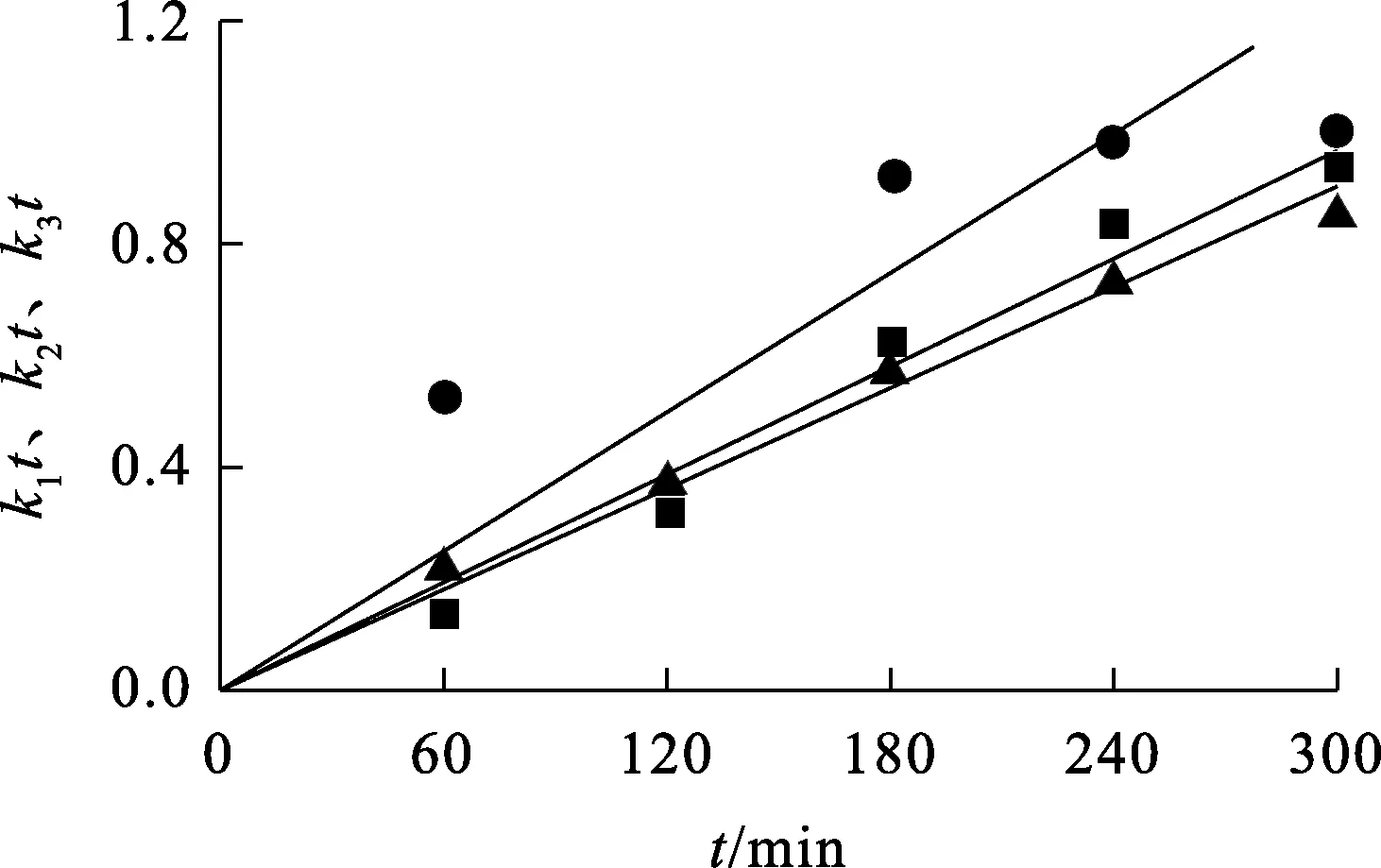
—●—▲—■
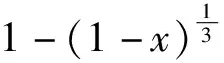

图14 不同温度下铬浸出动力学拟合曲线

图15 不同温度下铝浸出动力学拟合曲线
结果进一步表明,各温度下的动力学数据都可用界面化学反应控制模型描述。
铬、铝浸出过程中反应速率常数随温度的变化见表3。

表3 铬、铝浸出过程中反应速率常数随温度的变化
浸出反应的活化能用Arrhenius方程变形式计算[24]:
(8)
式中:Ea—反应表观活化能,kJ/mol;R—摩尔气体常数,8.314 J/(mol·K);T—热力学温度,K;A—指前因子,min-1。
以铬、铝浸出动力学的反应速率常数的对数lnk3与T-1作图,结果如图16~17所示。可以看出,拟合曲线的线性相关性良好,斜率-Ea/R分别为4.133和3.69 K/min;计算得到,铬浸出反应的表观活化能Ea和指前因子A分别为34.36 kJ/mol和7.1 min-1,铝浸出反应的表观活化能Ea和指前因子A分别为30.69 kJ/mol 和3.41 min-1。

图16 ln k3(Cr)与T-1之间的关系
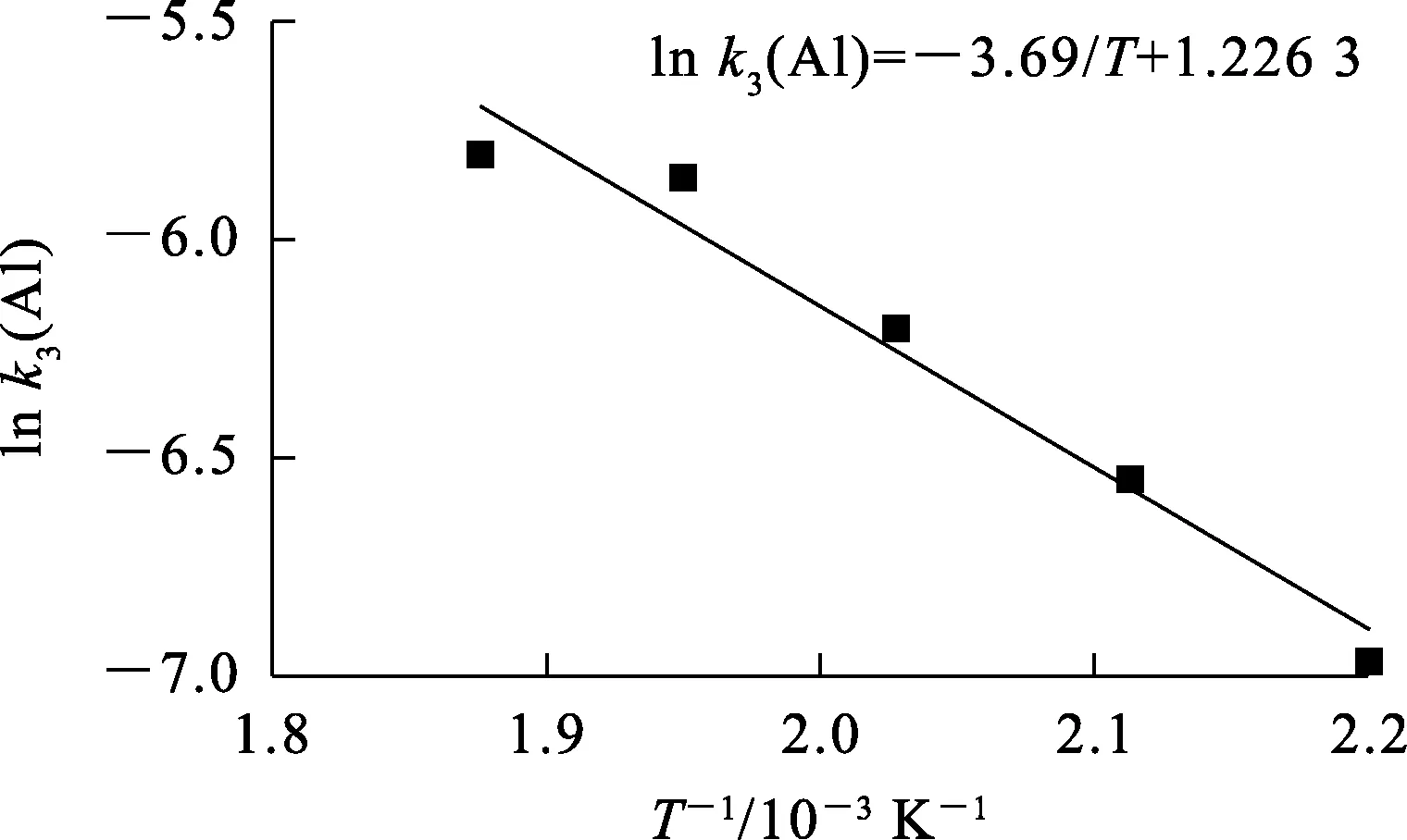
图17 ln k3(Al)与T-1之间的关系
4 结论
动-静耦合搅拌系统通过破坏反应釜中流体旋转体的对称性,可以大大提升铬铁矿液相氧化反应中的传质速度,提高铬、铝浸出率,适宜条件下,铬、铝浸出率均可达97%以上。