用绿矾从氧化锌中氧压浸出锌并同步分离铁
张 爽,李 杨,冯 好,冯伟光,张 华,倪红卫
(1.武汉科技大学 材料与冶金学院,湖北 武汉 430081;2.青岛睿海兴业管理咨询服务有限公司,山东 青岛 266041)
随高品位闪锌矿资源的减少,异极矿及其他低品位氧化锌矿物的开发利用成为了研究热点。氧化锌矿物的传统处理方法主要是用硫酸浸出,得到含有Zn2+、Fe3+等离子的浸出液,然后再通过黄钾铁矾法去除Fe3+,最后通过电积得到单质锌。该工艺具有锌浸出率较高的优点,但浸出选择性较差,后期除杂较为困难[1-2]。而采用碱性浸出或配位浸出法虽可选择性浸出锌[3-4],但矿石中的硅也进入溶液,也会造成后期除杂困难[5-8],且氨性配位浸出液易产生二次污染。Fe3+经过水解、干燥后可形成不溶于水的Fe2O3沉淀[9-11],减少溶液中的铁离子;FeSO4来源广泛,成本低廉:所以,用FeSO4作浸出剂,可在浸出锌的同时实现锌、铁同步分离,且铁盐水解产生的H+全部与矿石中的酸性氧化物反应,不会产生大量酸性废水,能有效降低浸出成本[12-14]。
试验研究了以绿矾(FeSO4·7H2O)为浸出剂,采用加压氧化法从氧化锌矿物中浸出锌,并探讨了氧压浸出过程中锌、铁的分布走向,以期为其他氧化锌矿物的无酸氧压浸出提供参考。
1 试验部分
1.1 试验原料与设备
异极矿:取自云南兰坪,为精选后的异极矿精矿,主要化学成分和物相结构分别见表1和图1。
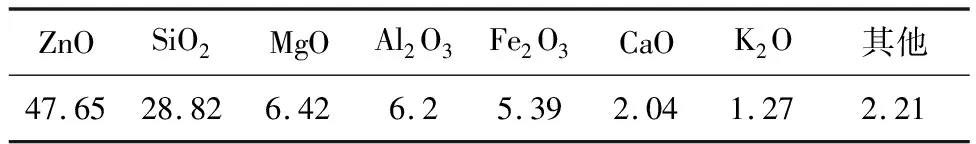
表1 异极矿精矿的主要化学成分 %
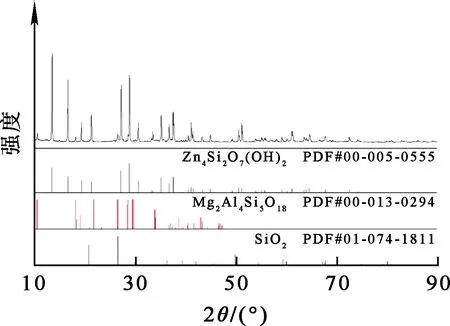
图1 异极矿精矿的XRD图谱
由图1看出:异极矿的主要成分为Zn4Si2O7(OH)2。精矿中的脉石矿物主要为石英(SiO2)和堇青石(Mg2Al4Si5O18)。
绿矾、氧化锌:化学纯,上海国药试剂集团有限公司。
试验仪器:快开250 mL高压反应釜,广州霍桐仪器有限公司。
1.2 试验原理与方法
浸出过程中发生的化学反应见式(1)~(4)[14-15]。首先,氧气溶解(式(1)),水合硫酸亚铁溶解并电离出Fe2+(式(2));在一定温度及搅拌条件下,Fe2+发生氧化、水解(式(3));同时,随Fe2+氧化水解产生大量H+,并与ZnO发生反应(式(4))。由式(4)可知,浸出渣的主要组分为Fe2O3,浸出液主要成分为ZnSO4,过滤后,即可实现锌、铁有效分离。

(1)
(2)


(3)


(4)

由图2所示的Fe-S-H2O系电位-pH图可知:在强酸性条件下,Fe主要以FeSO4·H2O形式沉淀出来;而在中性氧化条件下,溶液中的Fe更易以Fe2O3形式稳定存在。值得注意的是,FeSO4在反应过程中涉及Fe2+氧化、Fe3+水解和FeSO4溶解、结晶等系列非均相反应过程[16-18]。根据文献[17],[H+]对Fe3+水解产物的类型影响显著:低酸度下,水解产物是Fe2O3(式(4));中高酸度下,水解产物是碱式硫酸铁(式(5)),并且升温或适当延长反应时间有利于亚稳态碱式硫酸铁向赤铁矿转化。对比式(4)和式(5),不同的水解产物影响产生H+的量,进而影响浸出液酸度,因此,控制合适的反应温度和时间对锌的浸出十分重要。
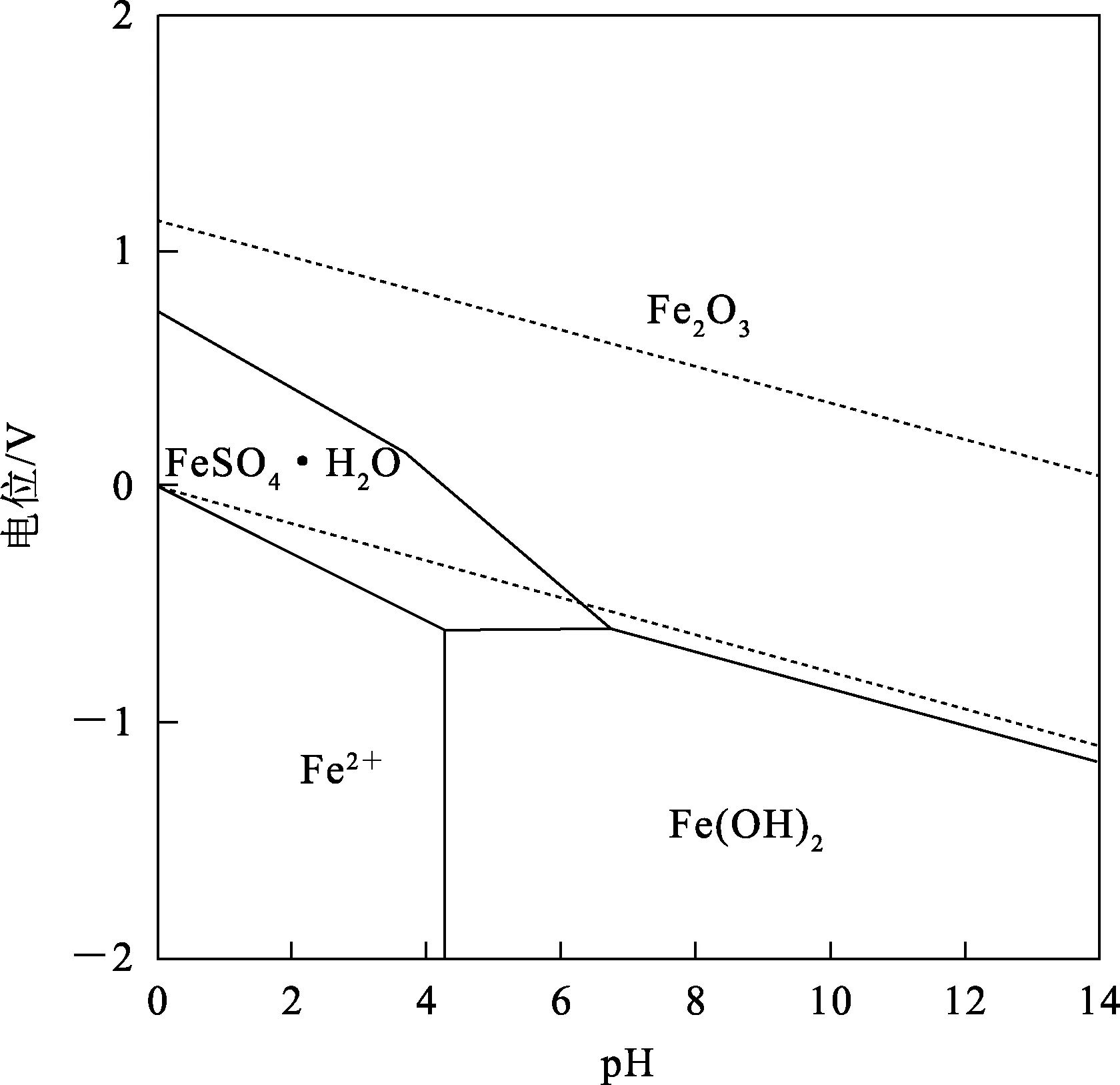
图2 150 ℃条件下Fe-S-H2O系电位-pH关系

(5)
鉴于氧化锌矿物中ZnO的反应活性较好,所以试验先以分析纯ZnO和FeSO4·7H2O为原料,采用加压氧化法从纯ZnO中浸出锌,确定适宜浸出条件,然后根据优化的浸出条件对异极矿进行氧压浸出,验证绿矾直接氧压浸出锌同步分离铁的可行性。
试验方法:取一定质量FeSO4·7H2O与4 g ZnO(或异极矿)混合均匀后放入反应釜内胆中,加入100 mL去离子水,密闭反应釜并开启搅拌,控制搅拌速度300 r/min;然后,加热反应釜,待温度升至设定温度后通入氧气并开始计时,保温至预设时间后停止加热并停止通氧;温度降至室温时,打开反应釜,取出矿浆并过滤;最后,对滤渣进行干燥,对滤液定容,分别分析其成分含量。
1.3 分析方法
采用X射线衍射仪(XRD,BRUKER D8 ADVANCED)分析滤渣的主要物相结构,采用电感耦合等离子体发射光谱仪(ICP-OES,EXPEC-6500)测定滤液中Fe3+和硅的质量浓度,采用EDTA快速滴定法[15]测定滤液中Zn2+质量浓度。
Zn浸出率计算公式为
Fe、Si沉淀率计算公式为
“充满关爱、和谐的家庭环境更有利于孩子的成长。抚养孩子无论采用哪种形式,没有对错好坏之分,只要适合家庭情况,就是最佳方式。”刘主任表示。
式中:rB—元素B浸出率,%;yB—元素B沉淀率,%;B—Zn,Fe或Si元素;m—加入试剂质量,g;wB—物料中元素B质量分数,%;V—浸出液体积,mL;ρB—浸出液中元素B质量浓度,g/mL。
2 试验结果与讨论
2.1 n(FeSO4·7H2O)/n(ZnO)对Zn浸出率和Fe沉淀率的影响
温度150 ℃,氧分压1.0 MPa,反应时间2 h,n(FeSO4·7H2O)/n(ZnO)对Zn浸出率、Fe沉淀率的影响试验结果如图3所示,浸出渣的XRD图谱如图4所示。
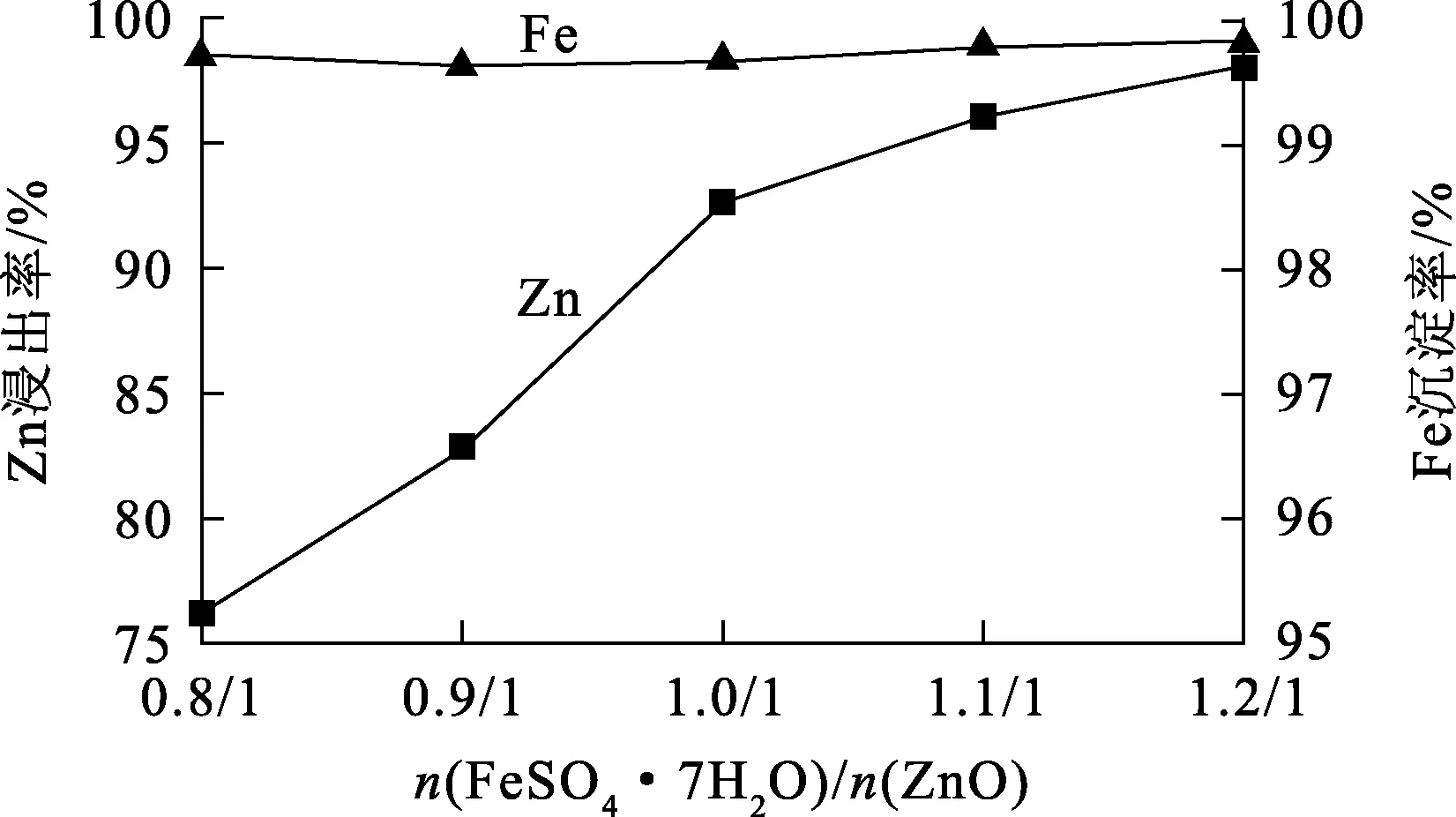
图3 n(FeSO4·7H2O)/n(ZnO)对Zn浸出率、Fe沉淀率的影响

图4 不同n(FeSO4·7H2O)/n(ZnO)条件下所得浸出渣的XRD图谱
由图3看出:随n(FeSO4·7H2O)/n(ZnO)增大,Zn浸出率逐渐提高;n(FeSO4·7H2O)/n(ZnO)=1.2/1时,Zn浸出率达98.24%。FeSO4·7H2O用量增加可促进水解反应正向进行,使溶液中产生更多的H+,进而促进ZnO溶解反应进行。根据反应式(2),ZnO完全溶解所对应的n(FeSO4·7H2O)/n(ZnO)=1/1。试验中,此条件下,Zn浸出率为90%。FeSO4·7H2O氧化水解产生的H+不足以完全溶解ZnO,会导致Zn浸出率有所下降。
由图4看出:渣中的主要物相为Fe2O3,且随n(FeSO4·7H2O)/n(ZnO)增大,Fe2O3衍射峰增强,说明Fe2+浓度增大有利于水解反应进行,有利于产生更多Fe2O3。值得注意的是,n(FeSO4·7H2O)/n(ZnO)<1/1时,谱图中2θ=30°附近存在少量ZnFe2O4衍射峰,这是未完全反应的ZnO和生成的Fe2O3在高温高压条件下反应生成的ZnFe2O4;而当n(FeSO4·7H2O)/n(ZnO)>1/1 时,ZnO浸出率达92.58%,近于完全溶解,不再有多余的ZnO与Fe2O3反应生成ZnFe2O4,因此,ZnFeO4的衍射峰随之消失。此外,滤液中Fe沉淀率变化不大,始终维持在较高水平(99.68%~99.82%),说明FeSO4·7H2O中的Fe2+可以完全水解形成Fe2O3进入浸出渣中,从而实现Zn、Fe同步分离。
2.2 温度对Zn浸出率和Fe沉淀率的影响
n(FeSO4·7H2O)/n(ZnO)=1.1/1,氧分压1.0 MPa,反应时间2 h,温度对Zn浸出率和Fe沉淀率的影响试验结果如图5所示,浸出渣的XRD图谱如图6所示。

图5 温度对Zn浸出率和Fe沉淀率的影响
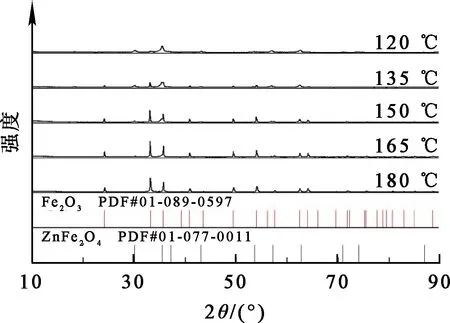
图6 不同温度条件下所得浸出渣的XRD图谱
由图5看出:温度在120~150 ℃范围内,随温度升高,Zn浸出率逐渐提高。温度升高有利于水解反应(4)进行,产生更多H+,促使Zn浸出反应正向进行;但温度超过150℃后,Zn浸出率出现浮动,先降低至83.32%,然后上升至96.69%。一方面,随温度升高,FeSO4·7H2O发生结晶[16,19-20],一定程度上抑制了Fe2+氧化水解,使溶液中H+浓度发生波动;另一方面,在165 ℃附近,Fe2+水解过程会发生副反应(式(5))生成碱式硫酸铁[21],导致Fe3+和Fe2+浓度下降,使得溶液中H+浓度发生波动,从而导致Zn浸出率下降。Fe在浸出液中的沉淀率随温度升高一直呈上升趋势,说明温度升高有利于溶液中更多的Fe离子转化为Fe2O3而进入浸出渣中。
2.3 氧分压对Zn浸出率和Fe沉淀率的影响
n(FeSO4·7H2O)/n(ZnO)=1/1,温度150 ℃(饱和蒸气压≈0.5 MPa),反应时间2 h,氧分压对Zn浸出率和Fe沉淀率的影响试验结果如图7所示,浸出渣的XRD图谱如图8所示。

图7 氧分压对Zn浸出率和Fe沉淀率的影响

图8 不同氧分压条件下所得浸出渣的XRD图谱
由图7看出:随氧分压升高,Zn浸出率大幅升高;氧分压升至0.8 MPa时,Zn浸出率达最大98.24%。反应釜内氧分压升高,有利于Fe2+氧化水解反应进行,使溶液中H+浓度增大,进而有利于ZnO浸出;但氧分压升至1.5 MPa后,会加速FeSO4·7H2O结晶[22],导致溶液中Fe2+浓度降低,H+浓度亦随之下降,最终ZnO浸出率降低。氧分压的变化对浸出液中Fe沉淀率影响不大。
由图8看出:浸出渣的主要物相为Fe2O3,未出现ZnO衍射峰;氧分压为0.3 MPa和1.5 MPa时,ZnO浸出率相对较低,未浸出的少量ZnO与Fe2O3反应生成少量ZnFe2O4,因而该条件下存在微弱的ZnFe2O4衍射峰。
2.4 反应时间对Zn浸出率和Fe沉淀率的影响
n(FeSO4·7H2O)/n(ZnO)=1/1,温度150 ℃,氧分压1.0 MPa,反应时间对Zn浸出率和Fe沉淀率的影响试验结果如图9所示,浸出渣的XRD图谱如图10所示。

图9 反应时间对Zn浸出率和Fe沉淀率的影响

图10 不同反应时间条件下所得浸出渣的XRD图谱
由图9看出:随反应时间延长,锌浸出率逐渐升高;反应3 h,Zn浸出率达最大,为98.75%,之后略有下降。Fe沉淀率随反应进行略有下降,反应3 h时保持在0.2%左右。随反应进行,亚稳态铁盐(如碱式硫酸铁、铁矾等)会转化为更加稳定的Fe2O3,从而使Fe沉淀率降低[18]。
由图10看出:浸出渣的成分几乎全部为Fe2O3;反应3 h,ZnO几乎完全溶解,浸出渣中未有ZnFe2O4出现。
2.5 异极矿中硅锌氧化物的浸出
基于上述试验结果,以绿矾(FeSO4·7H2O)为浸出剂,从异极矿精矿中浸出锌同步沉淀铁,验证无酸氧压浸出工艺处理异极矿精矿的可行性。
控制绿矾与异极矿精矿质量比(FeSO4·7H2O质量7 g,异极矿精矿质量2.13 g),Fe与Zn的物质的量比为1.1/1,温度150 ℃,氧分压1.0 MPa,反应时间3 h,异极矿精矿和浸出渣的主要化学成分见表2,XRD图谱如图11所示。

表2 异极矿精矿和浸出渣的主要化学成分 %

图11 异极矿和浸出渣的XRD图谱
由图11看出:浸出渣中Zn4Si2O7(OH)2和堇青石(Mg2Al4Si5O18)衍射峰全部消失,仅剩下SiO2和Fe2O3衍射峰,说明异极矿完全溶解,脉石矿物堇青石也分解进入滤液;同时,有明显的Fe2O3衍射峰出现,且SiO2衍射峰强度显著增强,说明绿矾中的Fe和异极矿中的Si也几乎完全转化为Fe2O3和SiO2进入浸出渣中。
浸出液中,Zn、Fe、Si质量浓度分别为31.27、0.12、0.31 g/L,锌浸出率达96%,而Fe、Si沉淀率也达99.28%和89.10%。浸出渣中,Fe2O3、SiO2质量分数分别为72.08%、17.20%,有少量Al、Ca氧化物杂质,未发现含锌氧化物,这与浸出渣的XRD分析结果一致。
异极矿精矿和浸出渣的SEM分析结果如图12所示。可以看出:异极矿精矿的微观形貌主要为不规则粒状结构,主要元素为Zn、Fe、Si、O等;浸出渣主要为球状团聚体,可能是水解产生的Fe2O3颗粒[23];浸出渣的主要成分为Fe、O、Si等,几乎看不到Zn的能谱峰,说明锌全部进入浸出液中,得到有效浸出,并与硅、铁同步分离。
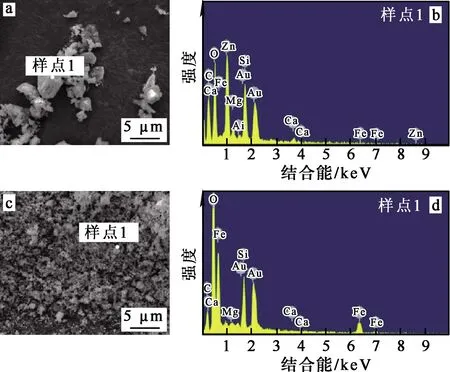
图12 异极矿精矿和浸出渣的SEM(a、c)和EDS(b、d)分析结果
3 结论
用绿矾(FeSO4·7H2O)作浸出剂,采用氧压浸出工艺,在无强酸条件下可以实现Zn的高效浸出并沉淀分离Fe,Zn浸出率达98.75%,Fe沉淀率在98%以上。用此工艺处理异极矿精矿,Zn浸出率也高达96%,Fe、Si沉淀率在92%以上及90%左右,锌可与铁、硅同步分离。

