青春期多囊卵巢综合征患者AMH与25(OH)D3的关联性研究
陈见辉 冯奕习 李汉秋 曹 婷
东莞市中医院检验科(东莞 523000)
与成年女性相似,青春期女性多囊卵巢综合征(polycystic ovary syndrome, PCOS)的发病风险较高,但由于下丘脑垂体轴不成熟,青少年更可能有在初潮后可持续长达5年的生理上的月经间隔期[1]。青少年更容易长痤疮,而不会伴随睾酮的差异。此外,对于青少年人群中多囊卵巢的定义也存在分歧[1]。鉴于此,成人PCOS的诊断标准难以适用于青春期人群。
与窦状卵泡计数相比,抗苗勒管激素(anti-Müllerian hormone, AMH)可能是更好的判定PCOS典型卵巢卵泡过多的因素,较高的AMH水平与月经紊乱和更大的卵巢体积有关[2]。25-羟基维生素 D3[25(OH)D3] 的缺乏被认为是PCOS症状的伴随状态[3]。已证明补充 25(OH)D3可降低PCOS女性的血清雄激素水平、多毛症、胰岛素抵抗状态等,并可使月经周期正常化[4]。但国内尚未见有关于青春期PCOS人群体内AMH与25(OH)D3的关联性研究,现我院对上述人群的体内生物学指标进行探讨。
1 资料与方法
1.1 研究对象
参照更新的《鹿特丹标准》[5]内容,根据青春期PCOS的诊断标准,纳入在2019年1月—2020年12月在我院妇科门诊就诊的PCOS青春期女性79名,另选择同期体检的非PCOS健康对照85名作为研究对象。
1.2 方法
对所有受试者测量身高、体质量,计算体质量指数(body mass index, BMI)、诊治医师询问是否有痤疮、多毛以及月经情况。研究对象在月经期的第3~5天空腹采集静脉血用于检测黄体生成素、卵泡刺激素、总睾酮、硫酸脱氢表雄酮、AMH和 25(OH)D3。
1.3 统计分析
2 结 果
2.1 PCOS组与对照组临床特征及实验室检测结果比较
健康对照组的月经稀发/闭经率为44.7%,PCOS组的月经稀发/闭经率高达89.9%,远高于健康对照组,2组比较差异具有统计学意义(P<0.001)。健康对照组的痤疮发生率为32.9%,而PCOS组的痤疮率较高,达49.4%,2组比较差异具有统计学意义(P=0.032)。与健康对照组相比,PCOS组患者的BMI、AMH值、总睾酮和硫酸脱氢表雄酮体内检出水平较高,而25(OH)D3检出水平在PCOS组较低(P值均<0.05),见表1。

表1 PCOS组与对照组临床特征及实验室检测结果比较
2.2 PCOS组与对照组的AMH及25(OH)D3的相关性分析
PCOS组的AMH与总睾酮呈正相关关系,与25(OH)D3呈负相关关系(P值均<0.05),对照组的AMH与25(OH)D3呈负相关关系(P=0.004),见表2。

表2 PCOS组与对照组的AMH及25(OH)D3的相关性分析
2.3 AMH与25(OH)D3缺乏/不足的情况分析
按照文献的定义[6],将25(OH)D3分为不足组和缺乏组,对不足和缺乏组的AMH水平进行分析,结果显示:25(OH)D3缺乏组的AMH水平高于25(OH)D3不足组,对照组和PCOS组的25(OH)D3缺乏组的AMH水平均高于25(OH)D3不足组,两两比较其差异具有统计学意义(P值均<0.05)。健康对照组的25(OH)D3缺乏率为67.1%(57/85),而PCOS组的25(OH)D3缺乏率为96.2%(76/79),2组比较差异具有统计学意义(χ2=22.68,P<0.001),见表3。
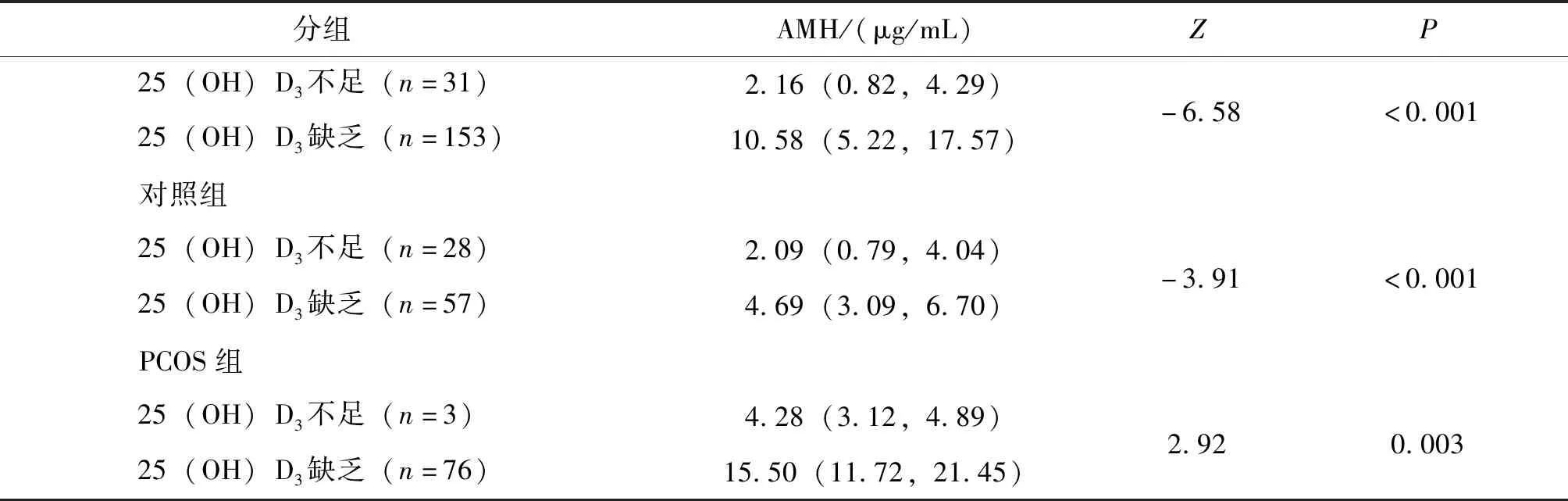
表3 AMH与25(OH)D3缺乏/不足的情况分析
3 讨 论
多囊卵巢综合征是女性不孕的重要潜在原因,其对青春期女性的影响也十分巨大,包括多毛、痤疮等高雄表征以及月经稀发/闭经等[7]。PCOS通常初发于青春期,其患病率可达9.1%[8]。此外,青春期PCOS进展下去,远期发生2型糖尿病、代谢综合征、血脂异常、心血管疾病、抑郁症和睡眠呼吸暂停的风险十分巨大[9]。由于最新的指南建议在初潮后8年内不要在青少年中使用超声标准[5],因此寻找新的生物标志物用于评估PCOS对青春期造成的影响十分重要。而将AMH纳入到评估青春期PCOS患病的影响将会使这部分人群受益,最大的原因为AMH是评估PCOS的非侵入性标志物。从生物学指标的选取上亦具有合理性,因为已有研究证实AMH是评估卵巢卵泡过多的替代标志物[10],且由于在青少年群体中不适宜使用经腹超声检查的技术,因而使用AMH评估PCOS的卵巢及卵泡数将是理想之选。
本研究的结果显示,青春期PCOS人群的月经稀发/闭经率更高,其高雄激素血症(总睾酮、硫酸脱氢表雄酮的水平)高于对照组,且高雄表征(痤疮)的发生率也高于健康对照组,此外PCOS组的BMI指数显著高于对照组,此与郑波[9]等人的研究结果类似。肥胖对于PCOS的发病具有推波助澜的作用,并可导致PCOS症状的恶化,如肥胖可导致机体产生胰岛素抵抗和高胰岛素血症,进而导致肝脏性激素结合球蛋白减少,致使随后产生高雄激素血症。另外,胰岛素通过与其自身受体结合来刺激卵泡膜细胞中卵巢雄激素的产生,过量的雄激素产生可能导致痤疮、脱发和多毛症等,这些都是 PCOS 的主要特征[11]。
本研究的结果显示PCOS患者的血清总睾酮水平显著高于对照组,与张美微[11]等人的研究结果一致。研究结果显示,PCOS患者体内升高的AMH对卵泡刺激素诱导的芳香酶活性具有抑制作用,导致睾酮向雌激素的转化减少,以及睾酮水平升高[12]。AMH 的这种作用解释了本研究中发现的AMH与 PCOS 组总睾酮之间的正相关性,表明高雄激素血症可能有助于小窦卵泡的增加,从而增加 PCOS 中 AMH 的分泌[12]。
本研究结果显示,25(OH)D3的检出水平在青春期女性组低于健康对照组,在PCOS组的25(OH)D3缺乏率高达96.2%,表明低水平的25(OH)D3状态在青春期女性群体中普遍存在。维生素D缺乏状态并不局限于骨骼性疾病中,在不同人群中均已观察到,如代谢综合征患者等。维生素D通过维生素D受体对卵巢功能和机体免疫系统产生作用,对妇女的生育力具有公认的作用[12]。事实上,已有研究在子宫内膜和卵巢颗粒细胞(生殖细胞)上鉴定出维生素D受体,表明维生素D及其受体对机体的生殖免疫具有重要的作用。已有研究证实,低水平的25(OH)D3是导致妇女不孕症的重要原因之一,在子宫内膜异位症或多囊卵巢综合征患者中已观察到[13-14]。低 25(OH)D3水平似乎与代谢综合征有关[15]。众所周知PCOS 女性的胰岛素敏感性下降,高胰岛素血症发生率较高,而肥胖是其表现之一[16],本研究揭示的PCOS组BMI水平高于对照组,且 25(OH)D3水平低于对照组可作为证据之一。此外,研究表明25(OH)D3可以调节脂肪细胞中的脂肪生成并刺激胰腺中的胰岛素细胞合成。已有研究在病态脂肪组织中测量了25(OH)D3水平,25(OH)D3缺乏者肥胖率较高,且与脂肪堆积率血清25(OH)D3水平呈正相关,表明脂肪组织可能是25(OH)D3的储存库[17]。已有研究显示,高患病率25(OH)D3的缺乏已体现在超重/肥胖的儿童和青少年群体中[18]。上述研究可解释PCOS组的25(OH)D3较低的原因。
最近的研究显示AMH与25(OH)D3的关系密切,如基因分析显示,维生素D反应元件已被鉴定出锚定在AMH 启动子基因上,体外实验表明25(OH)D3增强了该启动子的活性[14],表明AMH与25(OH)D3的相关性,不仅仅在青春期PCOS人群中观察到,在高龄育龄妇女人群中也观察到[13-14]。此外,研究者发现,在早育妇女中补充维生素D,AMH的水平也随之增加[19]。AMH可调节原始卵泡的始动,而25(OH)D3对卵泡发育产生影响,如25(OH)D3对AMH的调节预计会影响卵巢储备耗竭的速度等,而AMH是评估卵巢储备能力最有效的生物标志物,因此可解释本研究发现的AMH与25(OH)D3之间存在的负相关关系。
综上所述,青春期多囊卵巢综合征人群的AMH值较高,而25(OH)D3水平较低,可考虑将AMH作为评估青春期PCOS发病潜在的生物标志物。是否积极补充25(OH)D3可改善青春期PCOS人群的高雄激素血症/表征以及月经稀发/闭经等情况,需要进一步的临床研究加以证实。

