鱼藤素抑制舌鳞癌细胞增殖及诱导裸鼠移植瘤细胞凋亡机制的研究
黄莹莹 裴浩
舌鳞状细胞癌(tongue squamous cell carcinoma,TSCC)简称舌鳞癌,是口腔颌面部常见的恶性肿瘤之一,恶性程度及淋巴结转移率较高,同时具有很高的发病率和死亡率[1]。舌鳞癌的发病原因至今还没有明确,大量研究认定其发生与环境因素有关[2]。在近三十年的临床治疗中形成了以手术为主,放化疗为辅的综合治疗体系,然而舌鳞癌的五年生存率仍然处在非常低的水平,主要治疗瓶颈卡在化疗药物的选择上,当前的大部分化疗药物都存在一定的毒副作用,所以很多患者会受到很多的额外困扰[3-4]。鱼藤素(deguelin, DEG)是一种豆科植物鱼藤属的毛鱼藤根茎部提取出来的拟鱼藤酮类药物,同属黄酮类化合物。近年来的研究发现鱼藤素能够能增加多种肿瘤细胞对化疗药物和放射线的敏感性,具有很强的辅助治疗作用;多项体外研究表明鱼藤素对肺癌、乳腺癌、消化道癌等多种癌症产生明显的抗癌效果[5-8]。但是目前国内外对鱼藤素的抗癌作用并没有明确的研究结论。本课题用不同浓度DEG加药干预TSCC细胞,构建裸鼠移植瘤小鼠模型,探讨鱼藤素对舌鳞癌细胞的作用机制。
1 材料与方法
1.1 细胞株和动物分组
CAL27细胞(中国科学院细胞研究所); HOK细胞(人正常口腔上皮角质细胞)(上海通派生物科技有限公司),均用10% FBS的DMEM培养液,置于孵育箱中(37 ℃、 5% CO2)常规培养,取对数生长期细胞用于实验;SPF级BALB/c雌性裸鼠(18~20 g, 5~6 周龄)[动物许可证号: SCXK(京)2016-0006, 北京维通利华实验动物技术有限公司]。分为空白组、顺铂组、低剂量鱼藤素组、中剂量鱼藤素组和高剂量鱼藤素组,每组6 只。分别用生理盐水,30 mg/kg顺铂, 10 mg/kg鱼藤素,20 mg/kg鱼藤素和30 mg/kg鱼藤素处理,动物实验经过伦理委员会批准(批号: 2020-xxgnk012)。
1.2 试剂与仪器
顺铂(CAS:15663-27-1,纯度≥98%)[华中海威(北京)基因科技有限公司]; DMEM培养基(Gibco公司,美国); 一抗和二抗(北京中杉金桥生物技术有限公司); TUNEL试剂盒(武汉菲恩生物科技有限公司); CCK-8试剂盒(南京博研生物科技有限公司); BCA蛋白浓度测定试剂盒(合肥莱尔生物科技有限公司); ECL发光试剂盒(厦门仑昌硕生物科技有限公司)。
CQ-80L二氧化碳培养箱(常州金坛良友仪器有限公司);汇松酶标分析仪MB-580(济南欧莱博科学仪器有限公司);FACSCanto II流式细胞仪(BD有限公司,美国);Western blot电泳仪及转膜仪(Bio-Rad公司, 美国)。
1.3 实验方法
1.3.1 CCK-8检测增殖 当细胞满度约为70%后换液处理,用1% FBS的DMEM孵育2 h,分成空白组、5 μmol/L DEG、 10 μmol/L DEG、 20 μmol/L DEG、 30 μmol/L DEG、 40 μmol/L DEG及50 μmol/L 8 组进行加药处理,设置相同浓度的顺铂组实验。24 h后加入15 μL CCK-8溶液, 490 nm波长重复3 次测量吸光度值,计算细胞存活率和半数致死浓度(IC50值)。
1.3.2 Hochest/PI双染检测细胞凋亡 选择恰好处于对数生长期的CAL27细胞接种于六孔板中,待细胞密度达到75%左右时,加入不同浓度的鱼藤素(5、10、30及50 μmol/L),培养箱中继续培养24 h后,加入Hochest/PI染色剂,随后通过倒置荧光显微镜观察细胞凋亡情况,并对其进行拍照记录。
1.3.3 流式细胞术法检测细胞凋亡 将CAL27细胞接种至6 孔板,过夜培养。按浓度为IC50的DEG分别处理CAL27细胞3、 6、12和24 h,随后收集细胞于Tube管中, 5 000 r/min离心4~5 min,舍去上层清液,按照试剂盒说明书将1×结合缓冲液、Annexin V-FITC及PI染料以195∶3∶2重悬细胞将细胞染色,流式细胞仪上机检测凋亡细胞比例。
1.3.4 流式细胞术检测活性氧(ROS)水平变化 用IC50值为终浓度的DEG分别处理细胞3、 6、 12和24 h后,将细胞收集到Tube管中,PBS清洗并重悬,加入5 μL DCFH-DA并置于37 ℃ 恒温水浴锅中避光孵育0.5 h,离心后用PBS重悬洗涤1 次, 500 μL PBS重悬细胞后流式细胞仪检测细胞内活性氧水平。随后进一步检测加入ROS清除剂NAC之后DEG对CAL27细胞凋亡变化情况。
1.3.5 构建裸鼠移植瘤模型及分组药物处理 将细胞密度为2×107/mL的CAL27以5×106个细胞/只的浓度以腋下接种的方式注入到裸鼠皮下,注入细胞后用指肚轻轻按压注射的位置,每天观察裸鼠及肿瘤状况。当接种裸鼠均出现直径大5 mm3的皮下质硬结节时,将30 只荷瘤鼠根据分组的实验方案,灌胃给药,每两天一次并持续4 周,停药后牺牲裸鼠并剥离肿瘤。
1.3.6 对裸鼠瘤小鼠肿瘤体积及重量的测定 隔2 d用游标卡尺测量瘤体,通过公式V=1/2×长径×短径2计算瘤体体积;实验周期完成后剥离肿瘤,记录瘤体质量;肿瘤抑制率计算公式为:(空白对照组瘤重均值-实验组瘤重均值)/空白组对照瘤重均值×100%。
1.3.7 检测组织中的凋亡细胞状况 OTC包埋组织,调整切片机厚度为4 μm连续切片,并参照TUNEL检测试剂盒说明书对肿瘤组织中的细胞凋亡情况进行检测。在400 倍的光学显微镜下观察计数, 细胞凋亡率=凋亡细胞数/肿瘤细胞总数。
1.3.8 Western blot检测相关蛋白变化 利用超声波破碎仪将组织中的蛋白裂解出来,在4 ℃离心机中离心后取上清蛋白配样,将蛋白通过10%~15%的SDS-PAGE凝胶分离,然后将凝胶转移至NC膜表层,将NC膜用脱脂乳封闭2 h。随后用PBS洗去脱脂乳浮液,然后一抗加入NC膜上4 ℃过夜,TBST洗膜,随后二抗室温孵育2 h, ECL显色,再通过化学发光成像系统进行拍照、 ImageJ软件对蛋白条带进行灰度分析。
1.4 统计学分析
2 结 果
2.1 CCK-8实验检测CAL27细胞的增殖情况
从表 1中可以看出,随着鱼藤素处理浓度的不断提升细胞存活率逐渐降低,具有明显的浓度依赖性,当50 μmol/L DEG处理24 h时,细胞存活率仅为14.6%±3.3%,经计算IC50为17.8 μmol/L;对正常口腔上皮细胞的检测结果显示,鱼藤素对正常细胞的毒副作用较小,当50 μmol/L DEG处理24 h时,细胞存活率为81.3%±1.9%。

表 1 鱼藤素对CAL27细胞和HOK细胞的增殖抑制作用
2.2 鱼藤素对舌鳞癌CAL27细胞的诱导凋亡作用
鱼藤素对CAL 27细胞形态的影响如图 1,当处理浓度较小时,CAL27细胞体积有所增大,细胞密度逐渐变得稀疏;处理浓度增大后,CAL27细胞大量漂浮,细胞间隙明显增大。在荧光条件下,CAL27细胞的红色荧光强度随着鱼藤素的处理时间逐渐增强,说明细胞出现凋亡。流式细胞术的结果如图 2,鱼藤素处理6 h后,细胞开始出现明显的凋亡,并且在处理24 h时,凋亡细胞比例达到最高57.5%±3.2%。同时凋亡相关蛋白检测结果如图 3,Caspase-9和pro-caspase-3表达量降低,cleaved-caspase-3表达量升高。
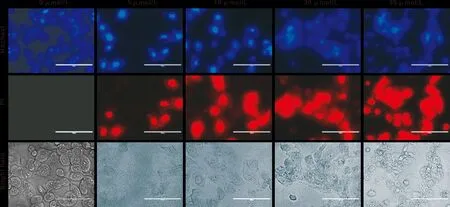
图 1 鱼藤素对CAL27细胞的诱导凋亡作用

图 2 CAL27细胞凋亡流式细胞术检测结果
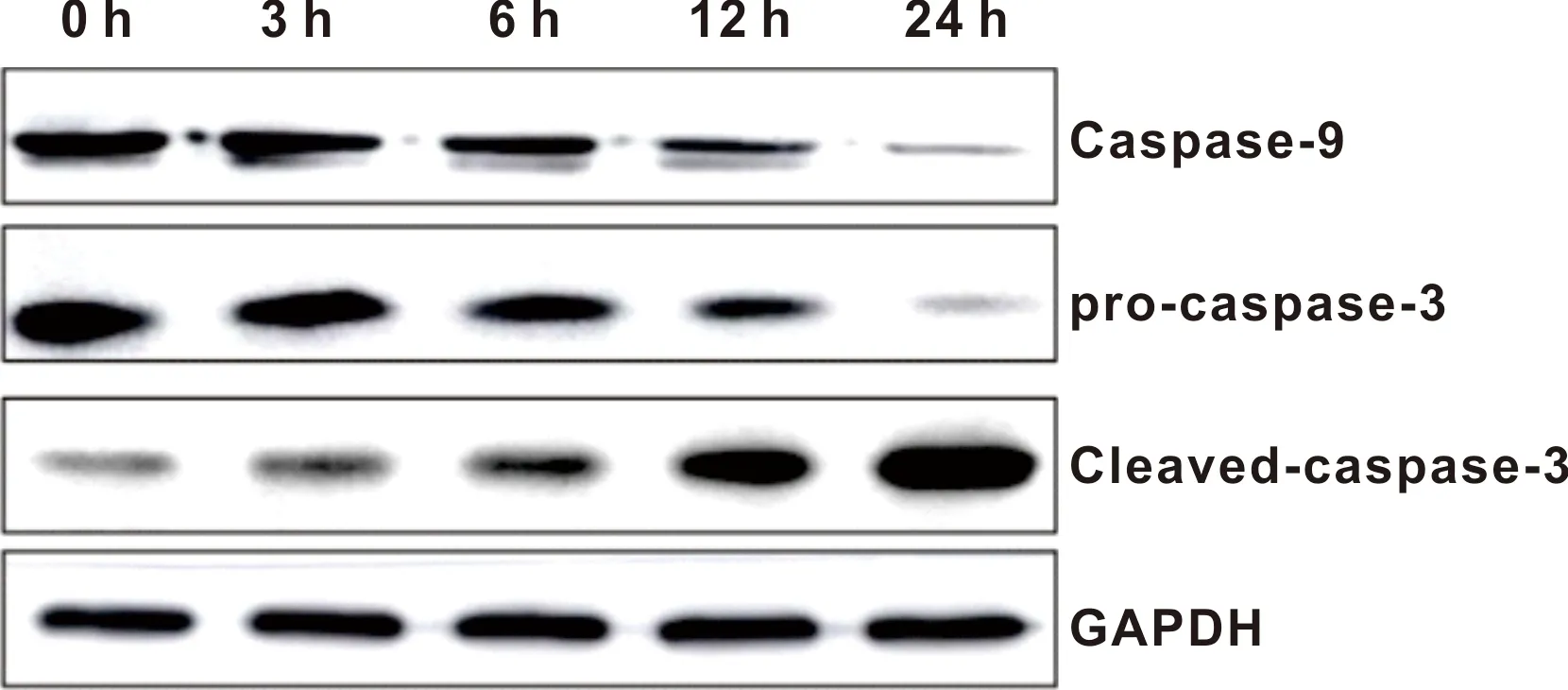
图 3 CAL27细胞中凋亡相关蛋白的表达
2.3 鱼藤素对舌鳞癌CAL27细胞的ROS调控作用
为了探究鱼藤素诱导CAL27细胞发生凋亡是否与细胞内活性氧水平有关, 以IC50浓度的鱼藤素处理CAL27细胞不同时间(3、 6、 12及24 h)后,加入DCFH-DA荧光探针, 并通过流式细胞术检测细胞内活性氧水平变化情况。从图 4中可以看出,随着鱼藤素处理时间的不断增加,CAL27细胞中ROS水平呈现时间依赖性逐渐升高。在鱼藤素处理后再加入ROS清除剂NAC后,细胞凋亡情况被明显抑制,与鱼藤素处理组相比具有显著性差异(图 5)。
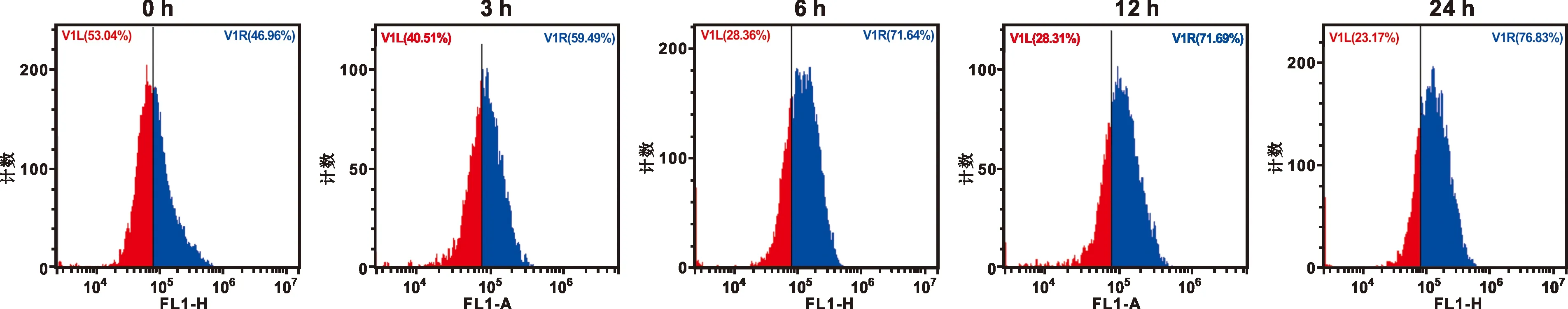
图 4 鱼藤素增强CAL27细胞的ROS水平
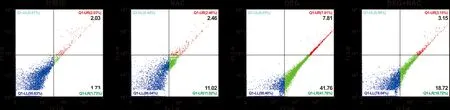
图 5 DEG和NAC对CAL27细胞凋亡的影响
2.4 鱼藤素上调ROS水平调节PI3K/AKT信号通路
Western blot结果如图 6,鱼藤素处理组的PI3K和p-AKT的表达量降低,但是当鱼藤素和NAC共同处理后,PI3K和p-AKT的表达量升高,基本恢复到与对照组相近的水平,说明ROS处于PI3K/AKT通路的上游。
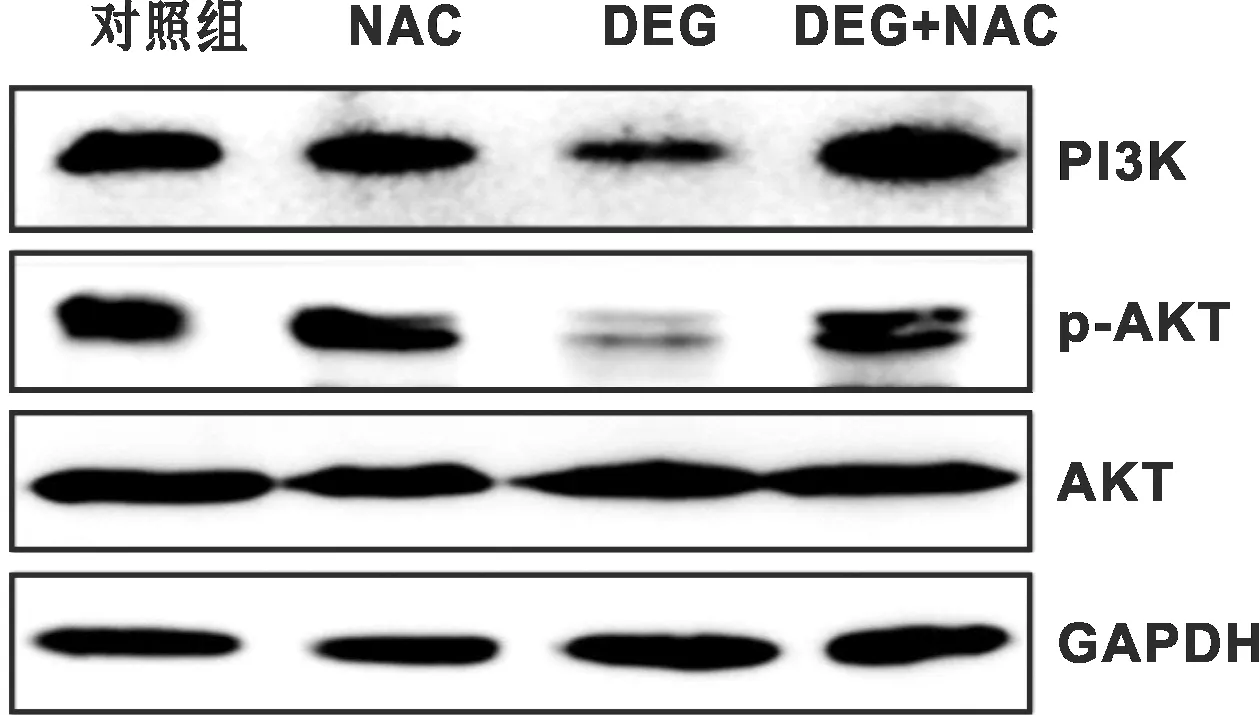
图 6 鱼藤素通过调节ROS水平来抑制PI3K/AKT信号通路
2.5 鱼藤素抑制舌鳞癌裸鼠移植瘤生长
与对照组相比, 裸鼠移植瘤的瘤体积随着DEG剂量的加大而明显减小(P<0.05),平均瘤重明显减轻(P<0.05)(图 7)。TUNEL实验结果显示(图 7),随着鱼藤素处理剂量的不断增加,凋亡细胞数量逐渐增加,具有一定的浓度依赖性(图 7)。经计算,DEG低、中、高剂量组肿瘤抑制率和瘤重如表 2,分别为20.1%, 56.1%和72.6%,与相同浓度的顺铂相比, DEG的肿瘤抑制效果要更强(P<0.05),表明鱼藤素能够在一定范围内以浓度梯度来抑制体内肿瘤的生长。

图 7 DEG促进裸鼠移植瘤中细胞凋亡

表 2 DEG对裸鼠移植瘤抑制率的影响
3 讨 论
舌鳞癌患者的五年生存率近年来一直徘徊在50%左右,这一数字在晚期患者的身上则降为25%,已经严重危害了人类的健康和生存[9]。传统的治疗手段中化疗特异性低,毒副作用较大,所以寻找更安全有效的化疗药物是提高舌鳞癌患者生存率和生存质量的重点。鱼藤素是近年来被发现的Akt特异性抑制剂,对多种癌症均具有很强的抗癌效果,有研究显示,鱼藤素发挥作用主要是通过抑制前列腺癌、肺癌及乳腺癌等多种癌细胞的Akt(Thr308)、PTEN(Ser380)和PDK1(Ser241)的磷酸化有关,但是其上游的调控机制是如何进行的还尚不明确[10-11]。本研究首先验证了鱼藤素对舌鳞癌CAL27细胞的增殖抑制作用,可以看出鱼藤素能够以浓度依赖性的方式抑制CAL27细胞增殖,与阳性对照药物顺铂相比,鱼藤素的增殖抑制效果要更强。同时验证其对正常细胞的毒副作用发现,鱼藤素对人正常口腔上皮角质HOK细胞的毒副作用要低于顺铂。经计算,鱼藤素对舌鳞癌CAL27细胞的半数致死浓度(IC50)为17.8 μmol/L,这也与文献报道的对其他癌症的半数致死浓度在相近的范围内。
虽然临床上常用的化疗药物具体的作用机制不尽相同,但是都有一个相同的“目的”——诱导癌细胞凋亡,以诱导细胞凋亡为方向来开发抗化疗药物已经逐渐被认可,并发展成为肿瘤治疗研究中的新热点[12]。在凋亡过程中可以在显微镜下观察到细胞体积缩小,结构更加紧密,胞膜不断出芽、脱落,细胞变成数个大小不等的凋亡小体。Caspase-3和Caspase-9蛋白在各类癌的发生、发展中都起着十分重要作用[13]。在凋亡过程中,pro-caspase-3会被剪切成具有执行功能的cleaved-caspase-3执行凋亡“任务”。本研究双染实验结果可以初步看出,鱼藤素能够改变CAL27细胞形态,随后的流式细胞术进一步证明了鱼藤素能够诱导CAL27细胞发生细胞凋亡,并进行了Western blot实验检测凋亡相关蛋白的表达,从分子水平上证明了鱼藤素的诱导凋亡能力。
当癌细胞中的ROS水平过高后会直接调控细胞中的多条信号通路及多个信号因子,细胞中的多种生理进程会因此而改变,其中就包括细胞凋亡[14]。在鱼藤素处理后,CAL27细胞中的活性氧水平逐渐升高,并且具有明显的时间依赖性,为了验证ROS水平上升是否和凋亡有关,加入了NAC后继续检测细胞凋亡情况,可以看出NAC大幅降低了鱼藤素诱导的细胞凋亡比例。PI3K/AKT通路是一条经典的信号通路,鱼藤素被认为是Akt抑制剂,但是鱼藤素是怎样调控Akt信号通路的还尚不明确,在查阅了大量文献后得知ROS可以直接调控Akt的磷酸化,进而调控整条PI3K/AKT信号通路[15-16]。所以为了验证鱼藤素是否是通过上调ROS水平来实现对Akt通路的抑制的,加入NAC检测Akt通路蛋白的表达,可以看出鱼藤素和NAC共同处理组的p-Akt和PI3K表达量要远高于鱼藤素单独处理组,说明调控ROS水平是鱼藤素发挥Akt抑制剂作用的关键要素。
体内裸鼠瘤实验是验证药效和检测毒副作用的关键,有研究表明30 mg/kg顺铂对大部分瘤体的生长抑制较强,因此本研究同样选取了30 mg/kg顺铂为阳性对照组。从结果中可以看出鱼藤素能够抑制裸鼠移植瘤的生长,并且具有一定的浓度依赖性,相同浓度下对瘤体的抑制效果要强于顺铂,30 mg/kg的鱼藤素对瘤体的抑制率高达72.6%,并且在实验过程中,小鼠没有死亡,体重也没有明显的变化,说明鱼藤素的体内毒副作用较小。
综上所述,Akt抑制剂鱼藤素对舌鳞癌细胞具有很强的抑制增殖作用,其作用机制是通过上调细胞中ROS水平,进而抑制PI3K/Akt信号通路,最终引起舌鳞癌细胞发生凋亡,为中药鱼藤素在舌鳞癌中的应用提供了一定的基础。

