N-糖基化修饰对异源蛋白在毕赤酵母中表达的作用研究进展
韩铭海 王未鲜 于志海
摘要 毕赤酵母是目前工业上生产重组蛋白最常用的宿主之一,而蛋白高水平表达技术一直是该领域的研究热点。目前,成熟的分子生物学技术手段使改造N-糖基化修饰位点成为一种操作性较强的提高目标蛋白表达水平的策略。综述了毕赤酵母中蛋白N-糖链的结构、其介导的CNX循环和对蛋白折叠的作用以及通过N-糖基化修饰位点改造促进蛋白表达的应用研究。
关键词 毕赤酵母;N-糖基化修饰;异源蛋白;蛋白折叠
中图分类号 Q78 文献标识码 A 文章编号 0517-6611(2022)11-0014-04
doi:10.3969/j.issn.0517-6611.2022.11.005
开放科学(资源服务)标识码(OSID):
Research Progress on the Effect of N-glycosylation on Production of Heterologous Proteins in Pichia pastoris
HAN Ming-hai,WANG Wei-xian,YU Zhi-hai
(Guizhou Institute of Technology,Guiyang,Guizhou 550000)
Abstract Pichia pastoris is one of the most popular eukaryotic hosts for producing heterologous proteins.However,increased secretion of certain proteins valued for their applications is essential in this field.Due to promoted techniques in molecule biology,engineering N-glycosylation sites of target proteins was easily manipulated and an effective way to increase their productions.This paper reviewed the structure of N-glycan of glycoproteins in Pichia pastoris, the effect of its participation in CNX cycle on protein folding,and engineering N-glycosylation sites of the target proteins for stimulating their productions.
Key words Pichia pastoris; N-glycosylation;Heterologous protein;Protein folding
毕赤酵母( Pichia pastoris,最新分类名为Komagataella pastoris或Komagataella phaffii) 是科学研究和工业化生产蛋白类产品最常用的表达宿主。这种蛋白表达宿主具有高密度细胞培养、高效而可控的启动子、蛋白翻译后修饰、异源蛋白高效分泌表达、胞外蛋白易于分离和纯化以及公认的安全性等优点[1],是当今最受欢迎的蛋白表达体系之一[2]。
获得高水平表达一直是商业化生产蛋白类产品的重要前提条件之一。当前,提高毕赤酵母蛋白表达水平的主要技术有:一是发酵条件优化策略,包括培养基和发酵条件优化、诱导策略优化和高密度培养等传统手段[3];二是分子生物学技术,如优化密码子、选用强启动子和高效的信号肽、增加基因拷贝数等[3-4];三是改造蛋白、折叠、修饰和分泌途径,以提高细胞蛋白合成速度和产量[3-4],如通过共表达分子伴侣和PDI[5-6]等来提高内质网对异源蛋白的加工和折叠。近期的研究表明,在宿主细胞内质网中的错误折叠或是折叠的低效性是抑制某些异源蛋白高效表达的重要原因之一[7-10]。
1 新生肽高效折叠是其高水平表达的关键
在真核细胞内质网(ER)中,种类和数量较多的分子伴侣和辅助因子参与了新生肽的折叠加工,而细胞严谨的质量控制(quality control)机制确保了多肽的正确折叠,该复杂机制的低效性常常成为宿主表达蛋白的限速步骤[7-10]。另外有研究表明,通过采用优化启动子或增加基因拷贝数等策略,可以促进毕赤酵母表达外源蛋白,但相当含量的蛋白仍然滯留在胞内而未被分泌表达。究其原因,可能是蛋白在内质网中不能快速折叠,致使大量未折叠多肽聚集,这是限制蛋白高效分泌表达的主要因素[7-10]。肽链在ER中合成只需数十秒至几分钟,而新生肽在ER中停留时间可长达数十分钟,最终,只有正确折叠的多肽才能被细胞输送至高尔基体,接受进一步的修饰加工,非正确折叠蛋白被ER识别并进入内质网关联降解途径(ERAD),被泛素缀合酶修饰,最终在细胞质中被蛋白酶体彻底消化[5,7,9]。因此,提高新生肽折叠效率对蛋白的高水平表达至关重要。有研究表明,N-糖基化修饰对新生肽折叠有重要作用[11-12]。
2 N-糖基化修饰对蛋白表达的作用
一般来说,N-糖基化修饰参与了蛋白质合成折叠和转运,有助于酵母中蛋白质的高效表达和分泌[13-14]。其作用主要有以下几个方面:第一,没有N-糖链的协助将可能会严重影响新生肽折叠的效率,而内质网内多肽的低效折叠将会被严格的内质网质量控制体系所识别,从而可能进入ERAD途径而被降解[15];第二,N-糖链上的甘露糖可以与ERGIC-53结合。ERGIC-53是一种甘露糖凝集素受体,在从内质网转运糖蛋白到高尔基体的过程中发挥重要作用[16];第三,N-糖链可有效地屏蔽多肽表面的疏水性区域从而抑制蛋白的聚集[17]。
2.1 毕赤酵母中糖蛋白的N-糖链结构
自然界中,蛋白糖基化修饰主要有两类:N-糖基化修饰和O-糖基化修饰[18]。在原核和真核生物中,O-糖基化是蛋白常见的翻译后修饰方式,在酵母细胞中,O-糖基化主要形式是丝氨酸和苏氨酸羟基被O-甘露糖基化修饰[18]。毕赤酵母中蛋白O-糖基化修饰广泛存在,但没有N-糖基化修饰普遍[19]。
N-糖基化修饰是指β-构型的N-乙酰葡糖胺异头碳与天冬酰胺的γ-酰胺N原子共价链接而成的N-糖苷键修饰[20]。在自然界中,蛋白氨基酸序列Asn-Xaa-Ser/Thr(Asn为天冬酰胺、Xaa是除了Pro以外任意氨基酸、Ser为丝氨酸、Thr为苏氨酸)中,高达70%~90%的天冬酰胺残基是被糖基化修饰的[21]。
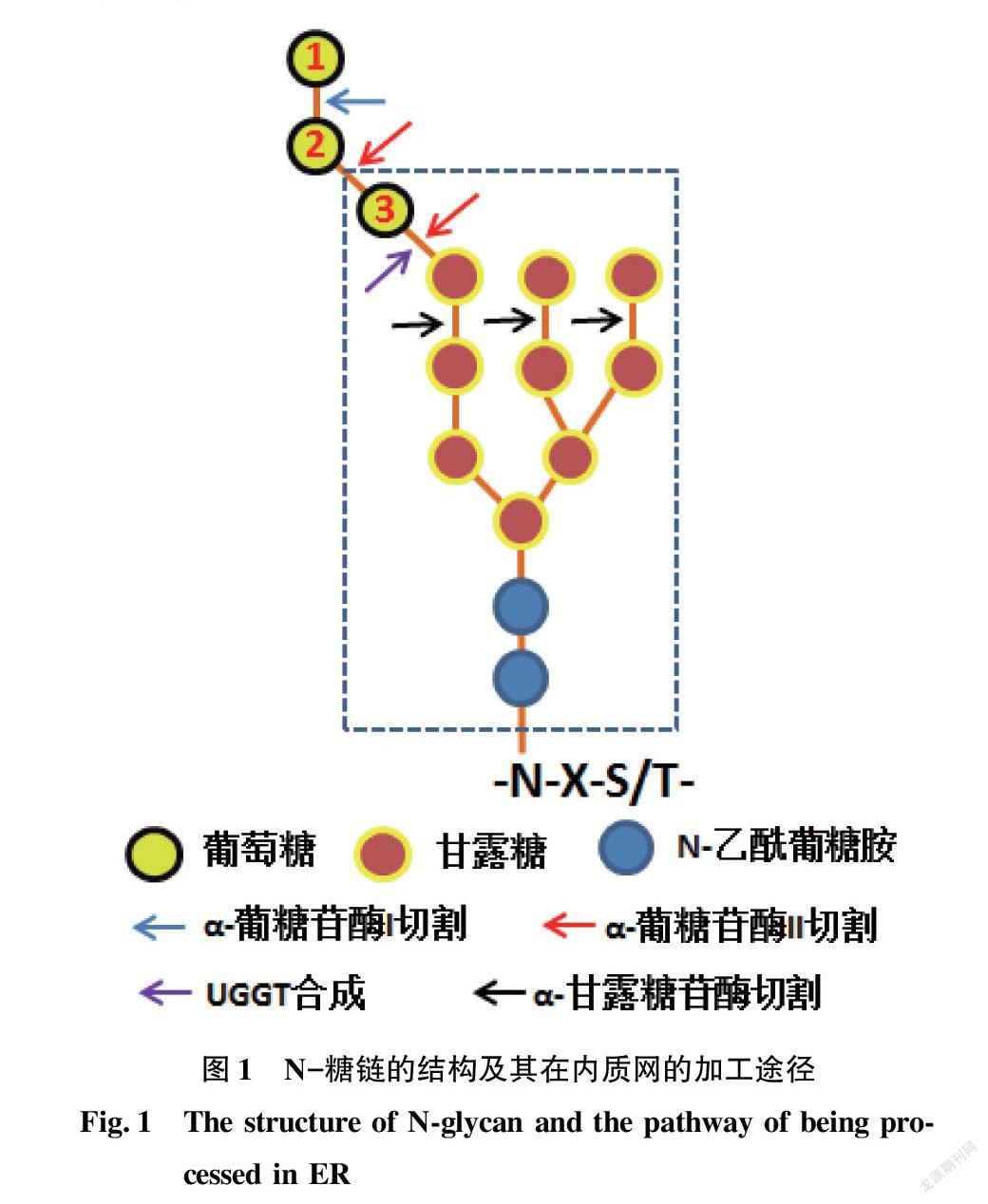
根据结构差异,N-糖链可分为3类:高甘露糖型、复杂型和杂合型[20-21]。毕赤酵母中N-糖链是高甘露糖型(high mannose)(图1),85%的N-糖鏈的结构为GlcNAc2Man8-14(GlcNAc表示N-乙酰葡糖胺,Man表示甘露糖),而GlcNAc2Man2为毕赤酵母中糖蛋白N-糖链最典型的结构[21]。
2.2 N-糖链对蛋白折叠的作用 一般说来,N-糖基化修饰促进蛋白折叠有两种机制[22-23]。
2.2.1
N-糖链起分子伴侣的作用。一般说来,在内质网中,疏水作用是引起蛋白折叠的驱动力,非折叠状态的蛋白的表面比天然活性状态的蛋白的表面具有更多的疏水区域,这使得非折叠状态的蛋白在细胞中拥挤的环境中易于发生聚集。目前,研究者普遍认可的关于N-糖基化修饰促进蛋白折叠的一种机理是:由于N-糖链是亲水基团,肽链的N-糖基化能够避免修饰位点附近与其他蛋白发生的疏水作用,提高了蛋白折叠的可逆性,从而促进了蛋白的折叠[11]。
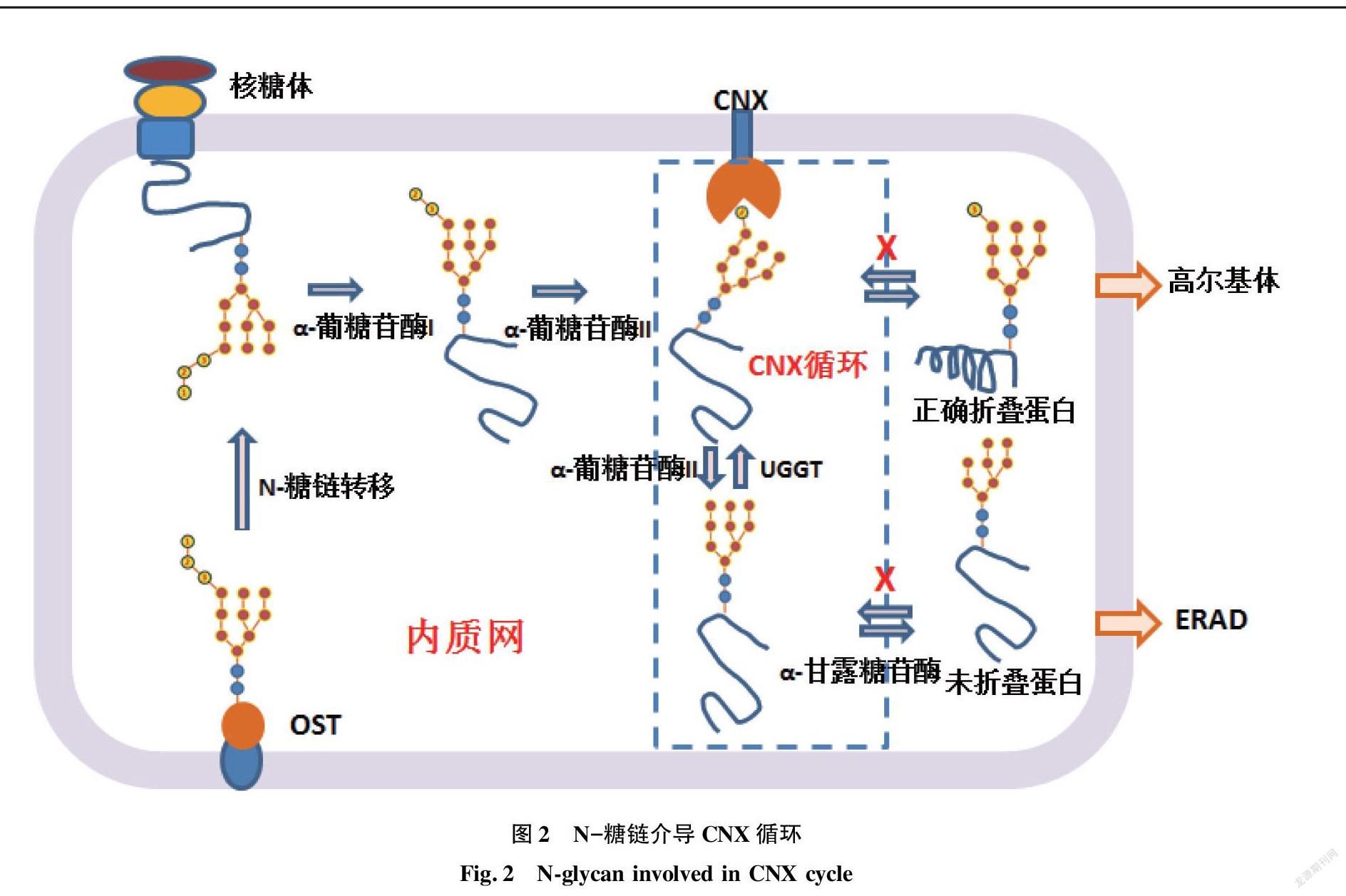
2.2.2 N-糖链介导新生肽参与钙联蛋白(CNX)循环。基于作用机制的差异性,ER中分子伴侣系统可以分为2类:①经典分子伴侣系统(classical chaperones),主要是热休克蛋白类,存在于整个细胞内,直接作用于多肽链,例如Bip(酵母中为Kar2p)、PDI和PPI等[23-24];②CNX循环系统,包括了钙联蛋白(CNX)和钙网蛋白(CRT,酵母没有钙网蛋白),属于凝集素分子伴侣,特异性地存在于内质网中,招募ERp57、UGGT、CypB等蛋白与N-糖链结合发生作用,通过CNX循环,促进新生肽蛋白的折叠(图2)。同时,这些蛋白也具有经典分子伴侣的某些功能[23-24]。
2.3 N-糖链在内质网中的加工及介导CNX循环
在内质网中,寡糖转移酶(OST)转移结构为Glc3Man9GlcNAc2的糖链到新生肽N-糖基化位点(Asn-Xaa-Ser/Thr)的天冬酰胺残基上,此糖链依次被α-葡糖苷酶I和α-葡糖苷酶II切除最末端的两个葡萄糖,形成GlcMan9GlcNAc2结构(图1)[21],此结构的糖链被CNX(酵母中为Cne1p蛋白)和CRT(酵母细胞中不存在这种蛋白)识别并结合[23-24]。CNX与新生肽结合后,招募ERp57和CypB(Cyclophilin B)等蛋白协同作用促进多肽的折叠。ERp57属于二硫键异构酶(PDI)家族,CypB属于肽基脯氨酸异构酶(PPI)家族,分别催化二硫键改组和脯氨酸异构化过程,是多数蛋白折叠过程中的限速步骤。α-葡糖苷酶II切除糖链末端的第三个葡萄糖,该切除过程速度小于切除第二个葡萄糖的速度,得到Man9GlcNAc2结构的糖链,其与CNX结合较弱,导致新生肽与CNX脱离(图2),得到游离新生肽。如果游离新生肽正确折叠,将会被转运到高尔基体,接受下一步的修饰和加工,而未正确折叠的新生肽将会被糖基转移酶(UGGT)识别,并且催化糖链重新添加葡萄糖,再次得到GlcMan9GlcNAc2结构,并再次结合CNX,即又获得再次折叠的机会[23-24]。经过多次CNX循环而未获得活性结构的多肽,其糖链结构中的甘露糖将被α-甘露糖苷酶水解(图1),这将阻止UGGT与新生肽结合,导致新生肽被淘汰出该CNX循环(图2),最终被细胞的ERAD通路降解[23-24]。
3 毕赤酵母中N-糖基化修饰对蛋白表达作用的研究
3.1 N-糖基化修饰促进异源蛋白表达
较多研究表明,N-糖基化修饰对蛋白表达是有促进作用的。Han等[25]报道,去除弹性蛋白酶Asn-43、Asn-212和Asn-280位点的N-糖基化修饰,分别降低了其在毕赤酵母GS115中分泌表达水平的23.9%、63.6%和63.7%。Yang等[26]也报道,去除脂酶Asn-60位点的N-糖基化修饰完全抑制了其在毕赤酵母GS115中的表达。另外有研究表明,鸡蛋卵清蛋白Asn-292的N-糖基化修饰对其在毕赤酵母中的折叠和高水平表达至关重要,而Asn-311位点的N-糖基化修饰对其表达作用不明显[27]。在角质酶和美洲驼VHH抗体片段引入N-糖基化修饰可促进其在毕赤酵母中的折叠和表达,而在蛋白的N端引入N-糖基化修饰比在C段的效果更好[28]。Wei等[29]通过研究也发现,Asn-224位点的N-糖基化修饰对于真菌β-葡糖苷酶在毕赤酵母中折叠和高水表达也是必须的。Wang等[30]报道了破伤风毒素片段C蛋白的表达水平与其N-糖基化修饰水平也呈负相关。
另外,某些蛋白前导肽上的N-糖基化修饰对前导肽的切除和成熟蛋白的分泌也有着重要的作用。Han等[31]报道,在弹性蛋白酶前导肽Asn-51和Asn-93位置引入N-糖基化位点分别提高了其在毕赤酵母中表达量的104%和57%。Liu等[32]也报道,除去脂肪酶前导肽上的N-糖基化修饰则抑制了其在毕赤酵母中的表达。可以推测,前导肽上的N-糖基化修饰可能对蛋白的成熟和折叠以及分泌表达起着非常重要的作用。
3.2 N-糖基化修飾抑制异源蛋白表达
研究表明,蛋白的N-糖基化修饰对其表达有着负面影响。例如,Hoshida等[33]报道去除α-淀粉酶所有的N-糖基化位点提高了其在酿酒酵母中表达量的3倍;在破伤风毒素片段C蛋白Asn-320引入N-糖基化位点也抑制了其在毕赤酵母中的表达[30]。Han等[34]研究发现,在弹性蛋白酶Asn-67位点引入N-糖基化位点则完全抑制了其在毕赤酵母中的表达。
3.3 N-糖基化修饰对异源蛋白表达影响不显著
研究表明,一些蛋白的N-糖基化修饰与其分泌表达水平几乎没有关系。Ito等[27]报道了卵清蛋白Asn-311位点的N-糖基化修饰不影响其在酿酒酵母中的分泌表达;Wang等[35]研究发现,尿激酶的N-糖基化修饰对其在毕赤酵母中的表达没有显著影响。
3.4 提高N-糖基化位点的修饰效率促进异源蛋白表达
研究者通过定点突变的技术可以研究异源蛋白上N-糖基化修饰对其表达水平的影响,也可以去除或引入N-糖基化修饰位点以提高其表达水平。一旦确定有利的N-糖基化修饰位点,那么可以通过采用更高效的N-糖基化修饰序列Asn-Xaa-Thr替代Asn-Xaa-Ser以提高特定位点的N-糖基化修饰效率,以此来增强N-糖基化修饰促进蛋白的效应。Han等[36]通过这种策略提高了弹性蛋白酶的N-糖基化修饰水平,而且也提高了其在毕赤酵母中的表达水平。另外,在N-糖基化修饰序列上游特定位点引入芳香族氨基酸序列也可以有效地提高N-糖基化位点的修饰效率[37-38],可以推测,通过这种提高N-糖基化修饰效率的策略也可有效地促进目标蛋白的表达水平。
4 展望
毕赤酵母是目前工业上生产异源蛋白最常用的宿主,提高异源蛋白在毕赤酵母中的表达水平的新技术、新策略一直是该领域的研究热点。N-糖基化修饰是毕赤酵母细胞中最常见的翻译后修饰,N-糖链作为蛋白折叠的凝集素分子伴侣,介导新生肽参与内质网蛋白折叠质量控制以及转运,因此对蛋白表达水平有着重要的影响。通过成熟分子生物学技术,研究者可以便捷地在目标蛋白的氨基酸序列中添加或是去除N-糖基化修饰位点,以研究其对蛋白表达水平的影响。已经有多篇文献报道了通过引入N-糖基化修饰位点提高目标蛋白表达水平的研究,因此,通过N-糖基化修饰位点的改造是一种有效地提高目标蛋白表达水平的策略。
另外,目前关于N-糖基化修饰作用于蛋白折叠表达的理论还不够完善,存在一定的不足。例如,CNX循环作用于新生肽的折叠过程与其N-糖链的蛋白位点特异性没有关联性,而实际研究发现,某些蛋白的不同位点N-糖链对其表达的作用是截然不同的。这些问题还有待研究者做进一步的研究以继续完善相关的理论,从而进一步优化通过N-糖基化位点改造促进蛋白表达的策略。
参考文献
[1]
MACAULEY-PATRICK S,FAZENDA M L,MCNEIL B,et al.Heterologous protein production using the Pichia pastoris expression system[J].Yeast,2005,22(4):249-270.
[2] BAGHBAN R,FARAJNIA S,RAJABIBAZL M,et al.Yeast expression systems:Overview and recent advances[J].Molecular biotechnology,2019,61(5):365-384.
[3] IDIRIS A,TOHDA H,KUMAGAI H,et al.Engineering of protein secretion in yeast:Strategies and impact on protein production[J].Applied microbiology and biotechnology,2010,86(2):403-417.
[4] YU P,ZHU Q,CHEN K F,et al.Improving the secretory production of the heterologous protein in Pichia pastoris by focusing on protein folding[J].Applied microbiology and biotechnology,2015,175(1):535-548.
[5] RUGGIANO A,FORESTI O,CARVALHO P.Quality control:ER-associated degradation:protein quality control and beyond[J].Journal of molecular cell biology,2014,204(6):869-879.
[6] SCHR DER M.Engineering eukaryotic protein factories[J].Biotechnology letters,2008,30(2):187-196.
[7] KITAMURA M.The unfolded protein response triggered by environmental factors[J].Seminars in immunopathology,2013,35(3):259-275.
[8] ARAKI K,NAGATA K.Protein folding and quality control in the ER[J].Cold spring harbor perspectives in biology,2011,3(11):1-25.
[9] PREISSLER S,RON D.Early events in the endoplasmic reticulum unfolded protein response[J].Cold spring harbor perspectives in biology,2019,11(4):1-18.
[10] CEREGHINO J L,CREGG J M.Heterologous protein expression in the methylotrophic yeast Pichia pastoris J].FEMS microbiology reviews,2000,24(1):45-66.
[11] TANNOUS A,PISONI G B,HEBERT D N,et al.N-linked sugar-regulated protein folding and quality control in the ER[J].Seminars in cell & developmental biology,2015,41:79-89.
[12] GE F,ZHU L B,AANG A N,et al.Recent advances in enhanced enzyme activity,thermostability and secretion by N-glycosylation regulation in yeast[J].Biotechnology letters,2018,40(5):847-854.
[13] ROTH J,ZUBER C,PARK S,et al.Protein N-glycosylation,protein folding,and protein quality control[J].Molecules and cells,2010,30(6):497-506.
[14] PUXBAUM V,MATTANOVICH D,GASSER,B.Quo vadis? The challenges of recombinant protein folding and secretion in Pichia pastoris [J].Applied microbiology & biotechnology,2015,99(7):2925-2938.
[15] KOSTOVA Z,WOLF D H.For whom the bell tolls:Protein quality control of the endoplasmic reticulum and the ubiquitin-proteasome connection[J].EMBO journal,2003,22(10):2309-2317.
[16] HAURI H P,APPENZELLER C,KUHN F,et al.Lectins and traffic in the secretory pathway[J].FEBS letters,2000,476(1/2):32-37.
[17] DE POURCQ K,DE SCHUTTER K,CALLEWAERT N.Engineering of glycosylation in yeast and other fungi:Current state and perspectives[J].Applied microbiology and biotechnology,2010,87(5):1617-1631.
[18] KIELISZEWSKI M J.The latest hype on Hyp-O-glycosylation codes[J].Phytochemistry,2001,57(3):319-323.
[19] BRETTHAUER R K,CASTELLINO F J.Glycosylation of Pichia pastoris -derived proteins[J].Applied biochemistry and biotechnology,1999,30 (3):193-200.
[20] SKROPETA D.The effect of individual N-glycans on enzyme activity[J].Bioorganic & medicinal chemistry,2009,17(7):2645-2653.
[21] GEMMILL T R,TRIMBLE R B.Overview of N-and O-linked oligosaccharide structures found in various yeast species[J].Biochimica et biophysica acta,1999,1426(2):227-237.
[22] IMPERIALI B,O'CONNOR S E.Effect of N-linked glycosylation on glycopeptide and glycoprotein structure[J].Current opinion in chemical biology,1999,3(6):643-649.
[23] LEDERKREMER G Z.Glycoprotein folding,quality control and ER-associated degradation[J].Current opinion in structural biology,2009,19(5):515-523.
[24] BRAAKMAN I,HEBERT D N.Protein folding in the endoplasmic reticulum[J].Cold spring harbor perspectives in biology,2013,5(5):1-17.
[25] HAN M H,WANG X F,DING H Y,et al.The role of N-glycosylation sites in the activity,stability,and expression of the recombinant elastase expressed by Pichia pastoris [J].Enzyme and microbial technology,2014,54:32-37.
[26] YANG M,YU X W,ZHENG H Y,et al.Role of N-linked glycosylation in the secretion and enzymatic properties of Rhizopus chinensis lipase expressed in Pichia pastoris [J].Microbial cell factories,2015,14(1):1-14.
[27] ITO K,ISHIMARU T,KIMURA F,et al.Importance of N-glycosylation positioning for secretion and folding of ovalbumin[J].Biochemical and biophysical research communications,2007,361(3):725-731.
[28] SAGT C M,KLEIZEN B,VERWAAL R,et al.Introduction of an N-glycosylation site increases secretion of heterologous proteins in yeasts[J].Applied and environmental microbiology,2000,66(11):4940-4944.
[29] WEI W,CHEN L,ZOU G,et al.N-glycosylation affects the proper folding,enzymatic characteristics and production of a fungal β-glucosidase[J].Biotechnology and bioengineering,2013,110(12):3075-3084.
[30] WANG N,WANG K Y,XU F F,et al.The effect of N-glycosylation on the expression of the tetanus toxin fragment C in Pichia pastoris [J].Protein expression and purification,2020,166:1-7.
[31] HAN M H,WANG W X,JIANG G C,et al.Enhanced expression of recombinant elastase in Pichia pastoris through addition of N-glycosylation sites to the propeptide[J].Biotechnology letters,2014,36(12):2467-2471.
[32] LIU Y,XIE W P,YU H W.Enhanced activity of Rhizomucor miehei lipase by deglycosylation of its propeptide in Pichia pastoris [J].Current microbiology,2014,68(2):186-191.
[33] HOSHIDA H,FUJITA T,CHA-AIM K,et al.N-glycosylation deficiency enhanced heterologous production of a Bacillus licheniformis thermostable α-amylase in Saccharomyces cerevisiae [J].Applied microbiology and biotechnology,2013,97(12):5473-5482.
[34] HAN M H,WANG X F,YAN G L,et al.Modification of recombinant elastase expressed in Pichia pastoris by introduction of N-glycosylation sites[J].Journal of biotechnology,2014,171:3-7.
[35] WANG P,ZHANG J,SUN Z,et al.Glycosylation of prourokinase produced by Pichia pastoris impairs enzymatic activity but not secretion[J].Protein expression and purification,2000,20(2):179-185.
[36] HAN M H,WANG W X,WANG X F,et al.Enhanced expression of recombinant elastase in Pichia pastoris through the substitution of Thr for Ser in Asn-Xaa-Ser sequons[J].Applied biochemistry and biotechnology,2015,175(1):428-435.
[37] AGUILA S,MARTNEZ-MARTNEZ I,DICHIARA G,et al.Increased N-glycosylation efficiency by generation of an aromatic sequon on N135 of antithrombin[J].PLoS One,2014,9(12):1-14.
[38] MURRAY A N,CHEN W T,ANTONOPOULOS A,et al.Enhanced aromatic sequons increase oligosaccharyltransferase glycosylation efficiency and glycan homogeneity[J].Chemistry & biology,2015,22(8):1052-1062.

