葛根素6″-O-木糖苷对ox-LDL诱导HUVECs细胞损伤的影响
袁向科, 江 瑞
(1.河南省中医院周围血管科,河南 郑州 450002;2.河南中医药大学第三附属医院老年病科,河南 郑州 450003)
动脉粥样硬化(atherosclerosis,AS)是心脑血管疾病的共同病理基础,可由高血压、高血糖、高血脂等多种因素引发,严重危害人类健康[1-2]。氧化型低密度脂蛋白(oxidized low-density lipoprotein,ox-LDL)是早期动脉粥样硬化发生和发展的重要因素,其诱导的血管内皮损伤能促进泡沫细胞的形成,释放大量炎性反应因子,进而加重该病病程[3]。因此,减少ox-LDL诱导的内皮损伤是预防和治疗动脉粥样硬化的有效途径。
目前,黄酮类化合物因其抗炎、抗氧化等功能[4-5]在防治动脉粥样硬化方面受到广泛的关注[6-7]。葛根素6″-O-木糖苷是葛根中的主要异黄酮[8],具有显著的抗肿瘤[9-10]、抗骨质疏松[11]活性,但该成分对血管内皮损伤的作用尚未见报道。因此,本研究采用ox-LDL诱导人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)损伤,探讨葛根素6″-O-木糖苷对HUVECs活性、凋亡、炎性损伤及NF-κB信号通路的影响。
1 材料
HUVECs购自美国典型培养物保藏中心。DMEM培养液、胎牛血清、胰蛋白酶购自美国Gibco公司;ox-LDL、维生素E购自美国Sigma公司。葛根素6″-O-木糖苷(纯度大于98%)购自上海同田生物科技有限公司。MTT试剂盒、IL-1β、TNF-α ELISA试剂盒购自江苏凯基生物有限公司;caspase-3活性检测试剂盒、RIPA细胞裂解液、PMSF、BCA蛋白定量试剂盒购自上海碧云天生物技术有限公司;cleaved caspase-3、ICAM1、VCAM1、p-p65、p-IκB-α、GAPDH等一抗购自英国Abcam公司和武汉博士德生物工程有限公司;二抗购自北京中衫金桥生物有限公司。
2 方法
2.1 细胞培养、分组及给药 将HUVECs置于含10%胎牛血清的DMEM培养基中,在37 ℃、5% CO2培养箱中培养。当细胞生长至80%~90%时,用0.25%胰酶进行消化传代培养。将HUVECs随机分为6组,分别为对照组,正常培养48 h;ox-LDL组,正常培养基培养24 h后,100 μg/mL ox-LDL处理24 h;葛根素6″-O-木糖苷10、20、40 μmol/L组,10、20、40 μmol/L葛根素6″-O-木糖苷处理24 h后,100 μg/mL ox-LDL处理24 h;维生素E组,200 μg/L维生素E处理24 h后,100 μg/mL ox-LDL处理24 h。
2.2 MTT检测细胞活性 将细胞接种到96孔板上,按“2.1”项下方法处理,每孔加入10 μL MTT(0.5 mg/mL),在37 ℃培养箱中孵育4 h,弃去培养基,每孔加入150 μL二甲基亚砜溶液,振荡15 min, 在490 nm波长处检测光密度(OD)值,计算细胞活性。
2.3 试剂盒检测细胞caspase-3活性 将细胞接种到6孔板上,按“2.1”项下方法处理,胰酶消化贴壁细胞,4 ℃离心5 min收集细胞,按caspase-3活性检测试剂盒说明书进行操作,在405 nm波长处检测OD值,计算caspase-3相对活性。
2.4 ELISA法检测细胞上清液IL-1β、TNF-α水平 按“2.1”项下方法处理细胞,离心收集细胞上清液,按ELISA试剂盒说明书检测IL-1β、TNF-α水平。
2.5 Western blot 检测细胞相关蛋白表达 将细胞接种到24孔板上,按“2.1”项下方法处理,每孔加入RIPA裂解液与PMSF的混合液(100∶1)裂解细胞15 min,离心收集上清,即为总蛋白,采用BCA蛋白定量试剂盒进行蛋白定量,取适量样本进行SDS-PAGE凝胶电泳,采用半干转方法将蛋白质转移到硝酸纤维素膜上,5%脱脂奶粉室温封闭1 h,加入一抗,在4 ℃下过夜孵育,再加入二抗,室温孵育1 h,采用红外激光成像系统扫描。以GAPDH为内参,分析蛋白相对表达。
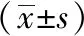
3 结果
3.1 葛根素6″-O-木糖苷对ox-LDL诱导的HUVECs细胞活性的影响 如图1A所示,0、10、20、30、40 μmol/L葛根素6″-O-木糖苷处理HUVECs后,细胞活性无明显变化(P>0.05),表明该成分无细胞毒性。如图1B所示,与对照组比较,ox-LDL可导致HUVECs的细胞活性下降(P<0.05);与ox-LDL组比较,葛根素6″-O-木糖苷呈剂量依赖性地抑制ox-LDL诱导的HUVECs细胞活性下降(P<0.05)。
3.2 葛根素6″-O-木糖苷对ox-LDL诱导的HUVECs细胞caspase-3表达的影响 如图2A所示,与对照组比较,ox-LDL组细胞caspase-3活性升高(P<0.05);与ox-LDL组比较,葛根素6″-O-木糖苷组呈剂量依赖性地抑制ox-LDL诱导的caspase-3活性升高(P<0.05)。如图2B所示,与对照组比较,ox-LDL组细胞cleaved caspase-3蛋白表达升高(P<0.05);与ox-LDL组比较,葛根素6″-O-木糖苷呈剂量依赖性地抑制ox-LDL诱导的cleaved caspase-3表达升高(P<0.05)。
注:与对照组比较,*P<0.05;与ox-LDL组比较,#P<0.05。图2 各组HUVECs细胞caspase-3表达
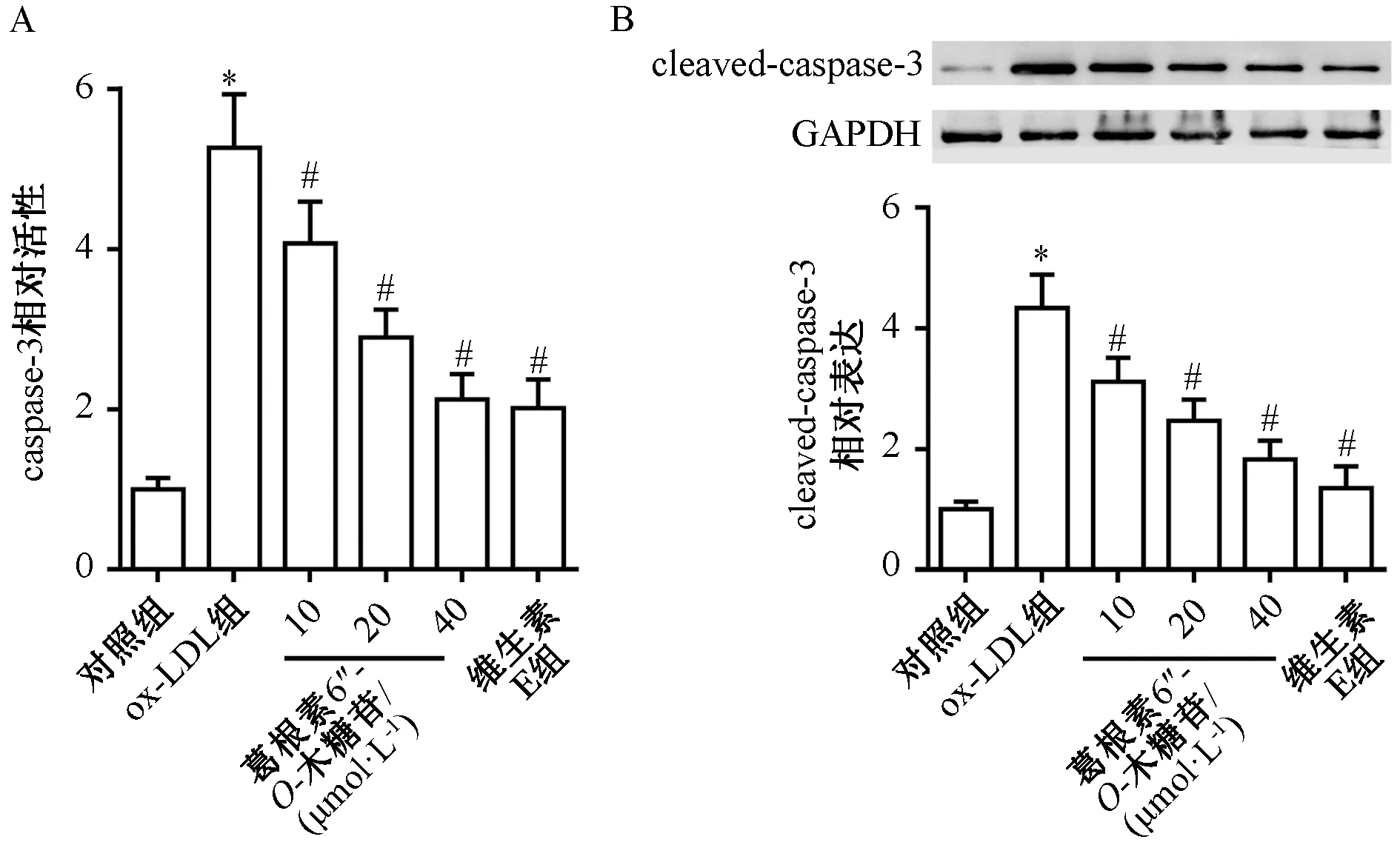
3.3 葛根素6″-O-木糖苷对ox-LDL诱导的HUVECs细胞上清液中炎性因子的影响 如图3所示,与对照组比较,ox-LDL组细胞上清液中IL-1β(图3A)、TNF-α(图3B)水平升高(P<0.05);与ox-LDL组比较,葛根素6″-O-木糖苷呈剂量依赖性地抑制ox-LDL诱导的IL-1β、TNF-α水平升高(P<0.05)。
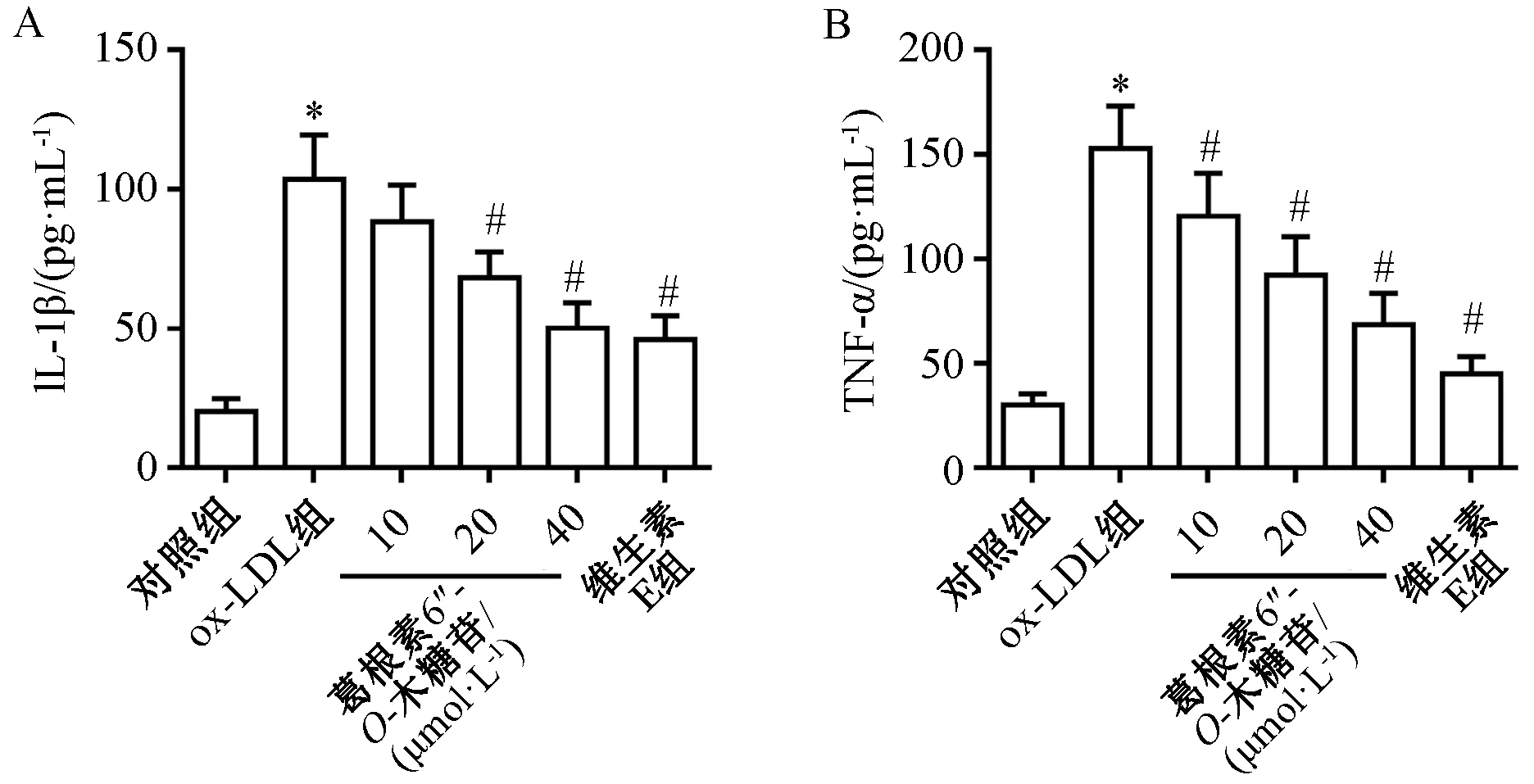
注:与对照组比较,*P<0.05;与ox-LDL组比较,#P<0.05。图3 各组HUVECs细胞上清液中炎性因子水平
3.4 葛根素6″-O-木糖苷对ox-LDL诱导的HUVECs细胞中黏附分子的影响 如图4所示,与对照组比较,ox-LDL组细胞中ICAM1(图4A)、VCAM1(图4B)蛋白表达升高(P<0.05);与ox-LDL组比较,葛根素6″-O-木糖苷呈剂量依赖性地抑制ox-LDL诱导的ICAM1、VCAM1表达升高(P<0.05)。

注:与对照组比较,*P<0.05;与ox-LDL组比较,#P<0.05。图4 各组HUVECs细胞中黏附分子的表达
3.5 葛根素6″-O-木糖苷对ox-LDL诱导的HUVECs细胞NF-κB通路的影响 如图5A所示,与对照组比较,ox-LDL组细胞p-p65蛋白表达升高(P<0.05);与ox-LDL组比较,葛根素6″-O-木糖苷呈剂量依赖性地抑制ox-LDL诱导的p-p65蛋白表达升高(P<0.05)。如图5B所示,与对照组比较,ox-LDL组细胞p-IκB-α表达升高(P<0.05);与ox-LDL组比较,葛根素6″-O-木糖苷呈剂量依赖性地抑制ox-LDL诱导的p-IκB-α蛋白表达升高(P<0.05)。

注:与对照组比较,*P<0.05;与ox-LDL组比较,#P<0.05。图5 各组HUVECs细胞NF-κB通路蛋白表达
4 讨论
血管内皮损伤是导致动脉粥样硬化发展的始动环节[12],在该病病灶部位中ox-LDL水平升高。HUVEC具有与动脉血管内皮细胞相似的生物学特征,用ox-LDL体外诱导HUVECs,可以模拟体内血管内皮损伤。本研究发现,葛根素6″-O-木糖苷能够抵抗ox-LDL 诱导的HUVECs细胞损伤,提高细胞活性,抑制细胞凋亡和炎性反应。
在动脉粥样硬化斑块中存在广泛的内皮细胞凋亡,损伤的内皮细胞能够诱导IL-1β、IL-6和TNF-α等炎性因子和VCAM1、ICAM1等黏附分子的产生,加速白细胞向内皮细胞的黏附和级联炎性反应[13]。通过ox-LDL诱导HUVECs,使得HUVEC细胞活性下降,caspase-3活性和表达提高,且IL-1β、TNF-α、VCAM1和ICAM1表达升高。Bhaskar等[14]发现槲皮素降低ox-LDL诱导的HUVECs中VCAM1、ICAM1、MCP-1和IL-6等炎性介质表达。槲皮素和芦丁调节JAK2通路抑制ox-LDL诱导的内皮细胞凋亡[15]。芳香新塔花总黄酮抑制炎症反应来保护内皮细胞[16]。本研究中葛根素6″-O-木糖苷能够呈剂量依赖性地抑制ox-LDL诱导的HUVECs细胞损伤,包括提高细胞活性,降低caspase-3表达,且下调IL-1β、TNF-α、VCAM1和ICAM1表达。
NF-κB是一种重要的转录因子,广泛参与癌症、炎症和免疫疾病的发展[17-18],其信号通路的激活与动脉粥样硬化的发展进程密切相关[19-21]。Bhaskar等[14]发现槲皮素通过调控NF-κB信号通路减少动脉粥样硬化炎性和黏附分子的表达。Deng等[22]发现葛根素通过抑制NF-κB信号通路可抵抗LPS诱导的血管内皮损伤。本研究发现ox-LDL处理导致HUVECs细胞中p-p65和p-IκB-α表达升高,激活NF-κB信号通路;而葛根素6″-O-木糖苷处理能够呈剂量依赖性地抑制ox-LDL诱导的p-p65和p-IκB-α表达升高。
综上所述,本研究证实了葛根素6″-O-木糖苷在ox-LDL诱导的HUVECs细胞中发挥重要的作用,包括提高细胞活性,抑制细胞凋亡,降低炎性因子和黏附分子水平,与抑制NF-κB信号通路有关。

