致病疫霉对缬菌胺敏感基线的建立及抗性风险评估
杨 坡, 吴 杰, 路 粉, 赵建江, 毕秋艳,韩秀英, 李 洋, 王文桥*,
(1. 河北农业大学 植物保护学院,河北 保定 071000;2. 河北省农林科学院 植物保护研究所,河北 保定 071000)
由致病疫霉Phytophthora infestans(Mont.) de Bary 引起的马铃薯及番茄晚疫病为多循环气传病害,发生范围广,流行速度快,短期内可造成重大损失,严重影响了马铃薯和番茄的生产[1]。化学防治作为重要的防治手段,防效高,见效快,已成为晚疫病的主要防治手段,被广泛应用。自20 世纪70 年代末以来,苯基酰胺类杀菌剂 (甲霜灵、精甲霜灵、霜灵) 、羧酸酰胺类杀菌剂 (烯酰吗啉、双炔酰菌胺、氟吗啉、缬霉威等) 、QoI类杀菌剂(嘧菌酯、吡唑醚菌酯、啶氧菌酯等) 、氰基乙酰类 (霜脲氰) 、吡啶酰胺类 (氟吡菌胺) 和哌啶基噻唑异唑啉类 (氟噻唑吡乙酮) 等一批高效、内吸杀菌剂及其混剂被应用于晚疫病的防治,使晚疫病的防治水平大大提高,但随着内吸性杀菌剂的大量使用,一些国家相继报道了包括致病疫霉对甲霜灵的抗性[2-8]和对嘧菌酯的抗性[9],导致出现相应药剂防效明显降低、病害再猖獗、农产品中农药残留超标等现象,严重影响农产品品质。如今抗药性已成为晚疫病化学防治中的重要问题之一。
杀菌剂抗性风险是指随着病原菌抗药性的发展,存在杀菌剂防病失败或药效降低的可能性。抗性风险由病菌生物与遗传特性及药剂作用机制与作用特点决定的基本风险和药剂的使用对策形成的治理风险组成[10],是制订抗药性治理对策和开发应用杀菌剂的重要依据[11]。缬菌胺是2008 年研发的羧酸酰胺类杀菌剂,可有效防治由卵菌中除腐霉属之外的病原菌引起的局部或系统性侵染病害[12]。66%代森锰锌 • 缬菌胺水分散粒剂已在中国登记用于防治马铃薯晚疫病,目前尚未见有关致病疫霉对缬菌胺的抗性风险的研究报道。
本研究通过建立致病疫霉对缬菌胺的敏感基线,筛选致病疫霉对缬菌胺的抗性突变菌株,研究缬菌胺与现用的其他羧酸酰胺类杀菌剂及非羧酸酰胺类杀菌剂之间的交互抗性,旨在为监测致病疫霉对缬菌胺抗性的发生发展提供参考,为明确致病疫霉对缬菌胺的抗性风险、制定致病疫霉对缬菌胺的抗性治理策略及晚疫病高效化学防治方法提供理论依据。
1 材料与方法
1.1 供试材料
1.1.1 供试培养基及药剂 黑麦蔗糖琼脂培养基(rye sucrose agar,RSA):黑麦80 g,琼脂15 g,蔗糖20 g,蒸馏水定容至1 L。利福平(rifampicin),索莱宝(CAS:13292-46-1);氨苄西林钠 (ampicillin),索莱宝(CAS:69-52-3);95%五氯硝基苯(quintozene)原药,山西三立化工有限公司;98%多菌灵 (polymyxin) 原药,河北冠龙农化有限公司。
1.1.2 供试菌株 于2018 年从河北省、内蒙古自治区、黑龙江省、贵州省和四川省未使用过缬菌胺,且鲜用其他羧酸酰胺类杀菌剂防治晚疫病的马铃薯主产区,采集具有晚疫病典型症状的新鲜病叶。每个省 (自治区) 选2~3 个市(县),每个市(县)选择3~5 个马铃薯集中种植区,每个种植区至少间隔10 km,从5 个不同的地块采集20~40 个病样 (表1)。
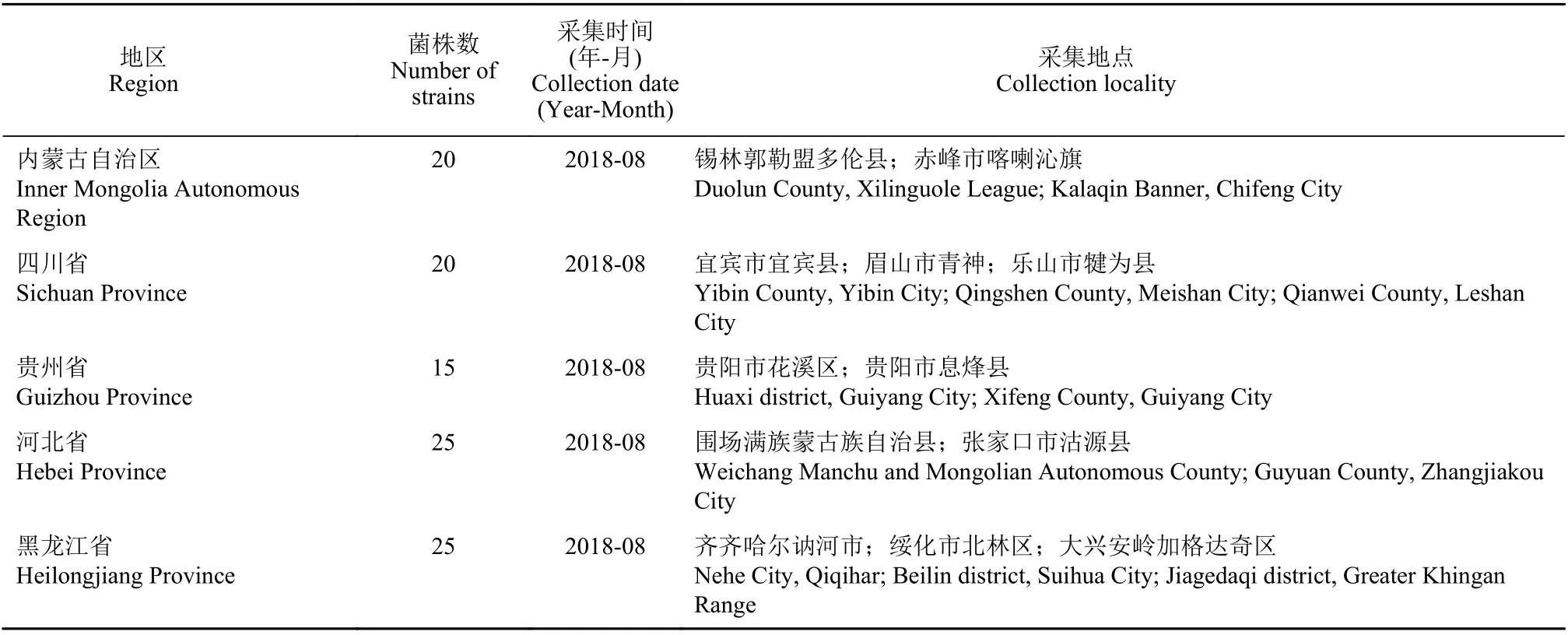
表1 供试菌株采集时间及地点Table 1 Collection time and location of the tested strains
剪取病叶病健交界处,分别夹于健康、感病的马铃薯薯块切口中,置于保温箱内。将马铃薯薯块置于灭菌的、底部铺有湿滤纸的培养皿中的一次性筷子上,并在18 ℃培养箱中黑暗培养至薯块切口边缘长出白色菌丝 (视情况可将健康马铃薯薯块转接多次)。挑取菌丝转接到选择性黑麦蔗糖琼脂培养基平板 (RSA 中加入50 μg/mL 利福平、50 μg/mL 氨苄西林钠、50 μg/mL 五氯硝基苯和50 μg/mL 多菌灵) 上,18 ℃黑暗条件下培养7~10 d。挑取培养后的菌丝块,置于载玻片上镜检观察。接种感病马铃薯叶片,再分离,完成柯赫氏法则检验。将具有致病疫霉的典型特征的菌株保存在RSA 斜面上或平板上待试。共获得105 个致病疫霉菌株,用于测定对缬菌胺的敏感性。
1.1.3 供试药剂 98% 缬菌胺(valifenalate) 原药,江苏省苏州富美实植物保护剂有限公司;95%双炔酰菌胺(mandipropamid)原药,先正达作物保护有限公司;97.6%烯酰吗啉(dimethomorph)原药,河北冠龙农化有限公司;95% 嘧菌酯(azoxystrobin)原药,南京金土地化工有限公司;95%氟吡菌胺(fluopicolide)原药,拜耳作物科学公司;98%霜脲氰(cymoxanil)原药,杜邦公司;97%甲霜灵 (metalaxyl)原药,沈阳化工研究院。
1.2 试验方法
1.2.1 致病疫霉对缬菌胺敏感性测定 采用菌丝生长速率法[13]测定。以二甲基亚砜为溶剂,配制质量浓度为1000 mg/L 的缬菌胺母液,用无菌水将母液依次稀释为10、5、2.5、1.25、0.625、0.3125、0.156 和0.078 mg/L 药液。准确移取6 mL 不同浓度药液,分别添加到事先灭菌并冷却至50~54 ℃的54 mL RSA 培养基中,之后倒入直径9 cm 的培养皿中,制成系列质量浓度分别为1、0.5、0.25、0.125、0.0625、0.03125、0.0156 和0.0078 mg/L的含缬菌胺的RSA 平板。对照组添加相同质量浓度的二甲基亚砜和等量的无菌水,制成不含药剂的RSA 平板。
将分离纯化的致病疫霉菌株接种在不含药剂的RSA 平板上,于18 ℃黑暗条件下培养至菌落长满平板。在菌落边缘打取直径0.5 cm 的菌饼,转移至含有不同质量浓度缬菌胺的RSA 平板中央。每浓度和对照组平板各重复3 次,于18 ℃下黑暗培养7~10 d。当无菌水对照平板菌落长满培养皿时,采用十字交叉法测量各处理菌落直径,按 (1) 式计算各药剂对菌丝生长的抑制率。
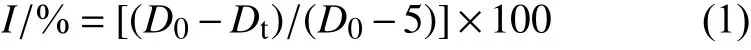
式中:I为抑制率,%;D0为对照组菌落生长直径,mm;Dt为处理组菌落生长直径,mm。
以药剂质量浓度的对数 (x) 为横坐标,抑制率转换成对应的机率值 (y) 为纵坐标,求出缬菌胺对供试菌株的毒力回归方程y= bx+a,计算抑制菌落生长的有效中浓度(EC50)及相关系数。
1.2.2 致病疫霉对缬菌胺敏感基线的建立 参照DBl3/T 1420—2011《马铃薯晚疫病菌抗药性检测技术规程》的方法[13],将供试菌株对缬菌胺的敏感性(EC50值)划分成5 个区段,以每个区段菌株出现的频率 (%) 为纵坐标,以药剂浓度区段为横坐标,画出菌株敏感性分布光滑曲线图,由5 个点连成,每一点以(x, y)来表示,x= 浓度区段中值,y代表该区段菌株出现频率。利用 SPSS 统计软件进行不同区段菌株频率数据正态性分布检验,如果Ρ> 0.05,即在95%置信限内,敏感性呈近似正态分布,则菌株可视为野生敏感菌株,其敏感性(EC50)平均值可作为敏感基线(EC50值),计算结果保留小数点后3 位数字。
1.2.3 致病疫霉对缬菌胺抗性突变体的获得
1.2.3.1 紫外诱变菌丝体 将野生敏感菌株接种在不含药剂的RSA 平板上,在黑暗、18 ℃条件下培养7~10 d,待菌落长满平板后,置于紫外灯(15 W,254 nm,预热 30 min) 下方垂直距离25 cm 处,分别照射10、15、20、25、30 和35 min。每个时间点照射完成后,在黑暗条件下培养至少30 min。在无菌红光条件下打取直径5 mm 菌块,菌丝面向下接种到不含药剂的RSA 平板。每处理10 皿,每皿4 块。在黑暗、18 ℃下培养7~10 d,采用十字交叉法测量菌落直径。观察菌落生长情况,确定照射亚致死时间。
将野生敏感菌株接种在不含药剂的RSA 平板上,在黑暗、18 ℃条件下培养7~10 d,待菌落长满平板后,接种到含1、0.5、0.25、0.125、0.0625 和0.03125 mg/L 缬菌胺的RSA 平板及对照平板上,在黑暗、18 ℃下培养7~10 d后观察菌丝生长情况,确定药剂最低抑制质量浓度(MIC,0.5 mg/L)。
参考赵卫松[14]的方法,先在黑暗无菌条件下,将一批长满敏感菌株的平板置于紫外灯 (15 W,254 nm,预热 30 min) 下方垂直距离25 cm 处照射30 min,再在黑暗条件下培养至少30 min。在无菌红光条件下从菌落边缘切取大小为10 mm ×10 mm 的菌块,菌丝面向下接种至含MIC 或以上浓度缬菌胺的RSA 平板上。每皿4 块,在黑暗、18 ℃条件下培养7~10 d,观察菌块菌丝生长情况。若能在含MIC 及以上浓度缬菌胺的RSA 平板上生长,表明该野生敏感菌株对缬菌胺产生了抗性。按公式 (2) 计算抗性突变频率。
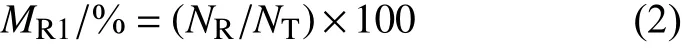
式中:MR1为紫外诱变菌丝体的抗性突变率;NR为出现抗性突变的菌饼数;NT为供试的菌饼总数。
1.2.3.2 紫外诱变孢子囊 将野生敏感菌株接种在RSA 平板上,在黑暗、18 ℃条件下培养15 d后,用无菌水洗下孢子囊,用双层纱布过滤,在显微镜下调孢子囊浓度至 5 × 105个/mL。在无菌条件下,取上述孢子囊悬浮液5 mL 置于距紫外灯(15 W,254 nm,预热 30 min) 下方垂直距离25 cm处,边振荡边分别照射30、60、90、120、150 和180 s。每个时间点照射完成后,再在黑暗条件下培养至少30 min。在无菌红光条件下均匀涂布在不含药剂的R S A 平板上,每个时间点接种10 皿,每皿10 μL,观察菌落生长情况及疏密程度,确定紫外线照射孢子囊亚致死时间。
参照Van Tyul 的方法[15],在无菌条件下,取上述孢子囊悬浮液5 mL,置于距紫外灯 (15 W,254 nm,预热 30 min) 下方垂直距离25 cm 处,边振荡边照射120 s 后,在黑暗条件下培养30 min。在无菌红光条件下均匀涂布在含MIC 及以上浓度缬菌胺的RSA 平板上,每菌株接种10 皿,每皿10 μL,于黑暗、18 ℃条件下培养7~10 d。若能在含MIC 及以上浓度缬菌胺的RSA 平板上长出菌丝,表明该野生敏感菌株对缬菌胺产生了抗性,按公式 (3) 计算突变频率。
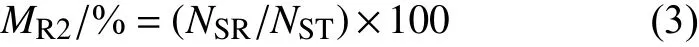
式中:MR2为紫外诱变孢子囊的抗性突变率;NSR为出现抗性突变菌株孢子囊数;NST受紫外线照射的孢子囊总数。
1.2.3.3 药剂驯化 将野生敏感菌株分别接种到含0、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9 和1.0 mg/L 缬菌胺的RSA 平板上,于黑暗、18 ℃条件下培养7~10 d,观察平板上菌丝生长情况,确定缬菌胺对亲本敏感菌株GZGY 的亚致死质量浓度为0.4 mg/L,MIC 为0.5 mg/L,对亲本敏感菌株CFKLQ 的亚致死质量浓度为0.3 mg/L,MIC 为0.4 mg/L。亲本敏感菌株GZGY 在含0.4~6 mg/L (质量浓度逐代递增) 缬菌胺的RSA 平板上继代培养11 代;亲本敏感菌株CFKLQ 在含0.3~1.2 mg/L (质量浓度逐代递增) 缬菌胺的RSA 平板上继代培养11 代,逐代测定驯化过的亲本菌株对缬菌胺的敏感性,方法见1.2.1 节。根据驯化过的亲本菌株在含有大于或等于MIC 缬菌胺的RSA 平板上是否生长,判断其对缬菌胺是否产生了抗性,并测定驯化获得的抗性突变体对缬菌胺的抗性水平。
1.2.4 抗性突变体的抗性水平测定 按照DBl3/T 1420—2011《马铃薯晚疫病菌抗药性检测技术规程》[13],采用菌丝生长速率法分别测定紫外诱导及药剂驯化获得的抗性突变体及其亲本菌株对缬菌胺的EC50值,求出各抗性突变体的抗性水平。抗性水平 = 抗药性突变体EC50值/亲本敏感菌株EC50值。
致病疫霉对缬菌胺抗性等级的划分:敏感(S),敏感性(EC50值)≤敏感基线的95%置信限上限,抗性水平≤(敏感基线的95% 置信限上限/敏感基线);低抗(LR),(敏感基线的95%置信限上限/敏感基线)<抗性水平≤10 倍;中抗(MR),10 倍<抗性水平≤100 倍;高抗(HR),抗性水平>100 倍。
1.2.5 抗性突变体对不同药剂的交互抗性测定 参照罗彦涛等[16]的方法,采用菌丝生长速率法分别测定8 个抗性突变菌株及其6 个亲本敏感菌株对烯酰吗啉、双炔酰菌胺、甲霜灵、嘧菌酯、霜脲氰和氟吡菌胺等6 种常用防治晚疫病内吸性杀菌剂的敏感性。用SPSS 软件进行皮尔逊检验,分析抗性突变菌株及其亲本敏感菌株对缬菌胺的EC50值的对数值与抗性突变菌株及其亲本敏感菌株对其他6 种常用晚疫病防治药剂中每种药剂的EC50值对数值之间的相关性,记录相关系数。如果P> 0.05,即表明在P= 0.05 的水平下差异不显著,说明两种药剂之间无相关性,表明缬菌胺与该药剂之间不存在交互抗性关系;如果P< 0.05,表明缬菌胺与该药剂之间有相关性。相关系数越高,相关性越大,通常相关系数大于0.75 时,则认为两种药剂之间存在交互抗性关系。
1.3 数据分析
采用DPS 7.05、SPSS 26.0 及Microsoft Excel软件对试验数据进行统计分析。
2 结果与分析
2.1 致病疫霉对缬菌胺敏感基线建立
缬菌胺对从河北、内蒙古、贵州、四川、黑龙江等省或自治区未使用过缬菌胺或鲜用其他羧酸酰胺类杀菌剂的地区采集的105 个菌株的EC50值范围为0.0594~0.159 mg/L (图1),敏感性差异为2.7 倍,平均值为(0.102 ± 0.024) mg/L,通过DPS 软件进行W 正态检验:W= 0.980,P=0.141 (> 0.05),敏感性频率分布呈连续单峰曲线,未观察到对缬菌胺敏感性明显下降的抗性亚群体,说明所测菌株均为对缬菌胺敏感的野生菌株,以菌株出现频率为纵坐标、有效抑制中浓度区间为横坐标,画出105 个野生敏感菌株对缬菌胺的敏感性分布曲线 (图2),同时将105 个野生敏感菌株平均EC50值(0.102 ± 0.024) mg/L 作为致病疫霉对缬菌胺的敏感基线。
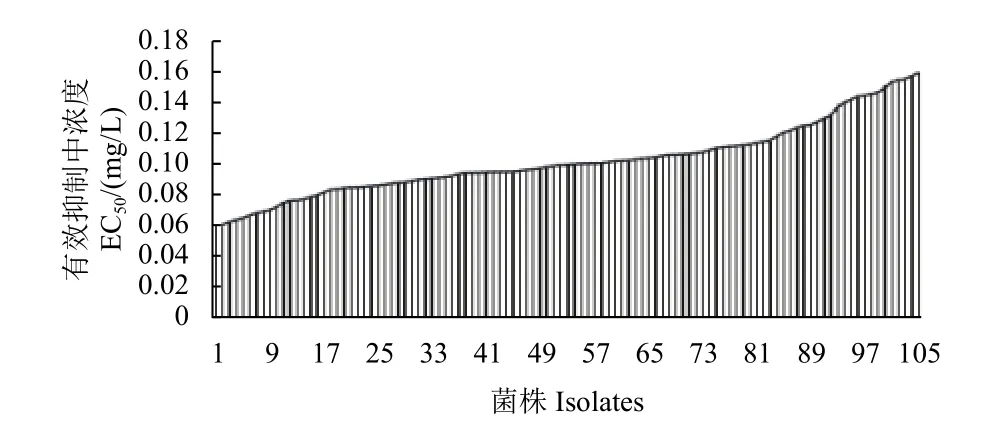
图1 105 株致病疫霉菌株对缬菌胺的敏感性分布Fig. 1 Senisitivity distribution of 105 isolates of Phytophthora infestans to valifenalate
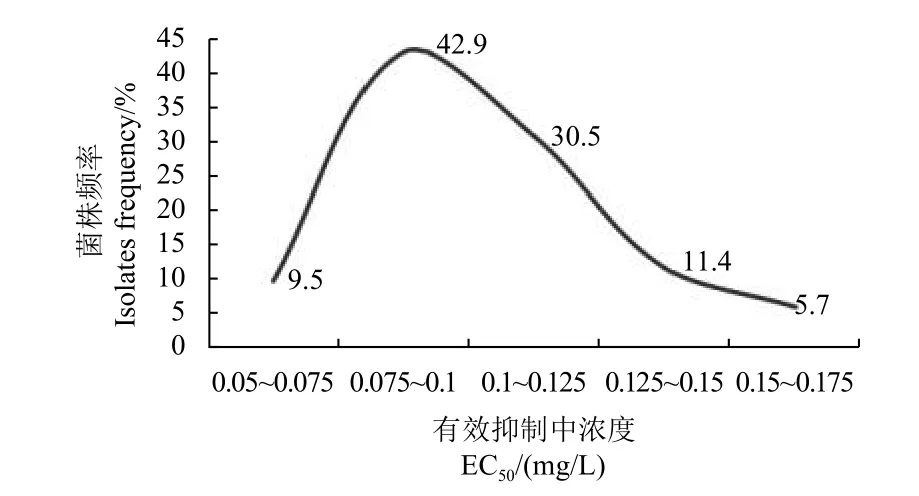
图2 致病疫霉对缬菌胺的敏感基线Fig. 2 Sensitivity baseline of Phytophthora infestans to valifenalate
2.2 致病疫霉对缬菌胺抗性突变体抗性水平
由表2 可知,紫外照射致病疫霉菌丝体的亚致死时间为30 min,紫外照射孢子囊悬浮液的亚致死时间为120 s。
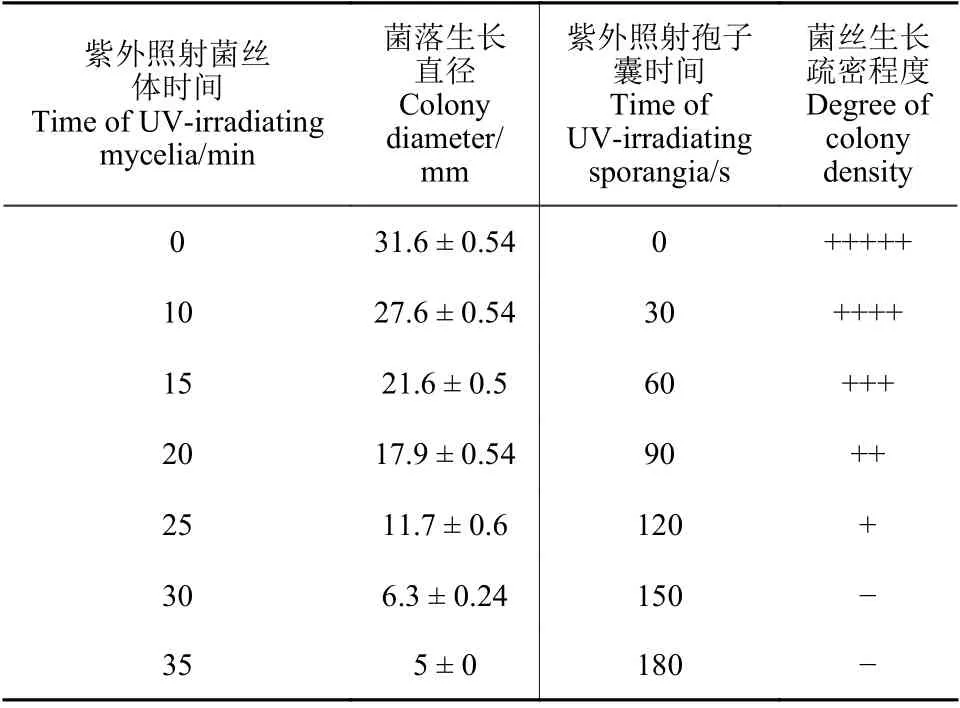
表2 紫外诱变试验亚致死时间的确定Table 2 Determination of sublethal time in ultraviolet mutagenesis test
通过紫外线照射敏感菌株的菌丝体,共处理736 个菌块,获得了4 个对缬菌胺的抗性突变体,抗性水平为3.2~14.9 倍,突变频率为0.54%;通过紫外线照射敏感菌株孢子囊悬浮液,共照射用孢子囊悬浮液涂布的RSA 平板300 皿,获得了2 个对缬菌胺的抗性突变体,抗性水平分别为8.1 倍和8.2 倍,突变频率为1.33 × 10−7;通过对野生敏感菌株进行药剂驯化11 代,获得了2 个抗性水平分别为3.1 倍和9.4 倍的抗性突变体 (表3和表4)。通过紫外诱导和药剂驯化共获得8 个对缬菌胺抗性突变体 (表5)。
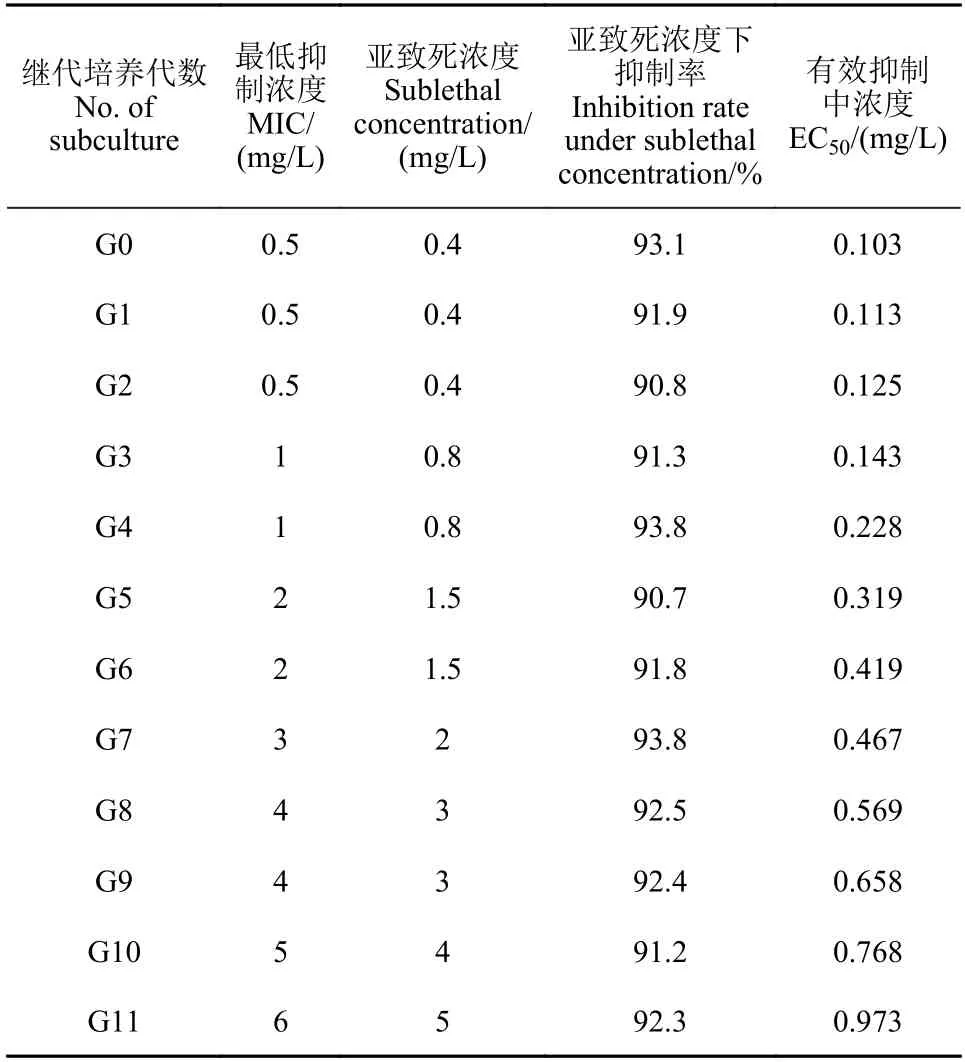
表3 致病疫霉亲本菌株GZGY 经药剂驯化获得对缬菌胺抗性过程Table 3 The acquisition of resistance to valifenalate in Phytophthora infestans parent strain GZGY
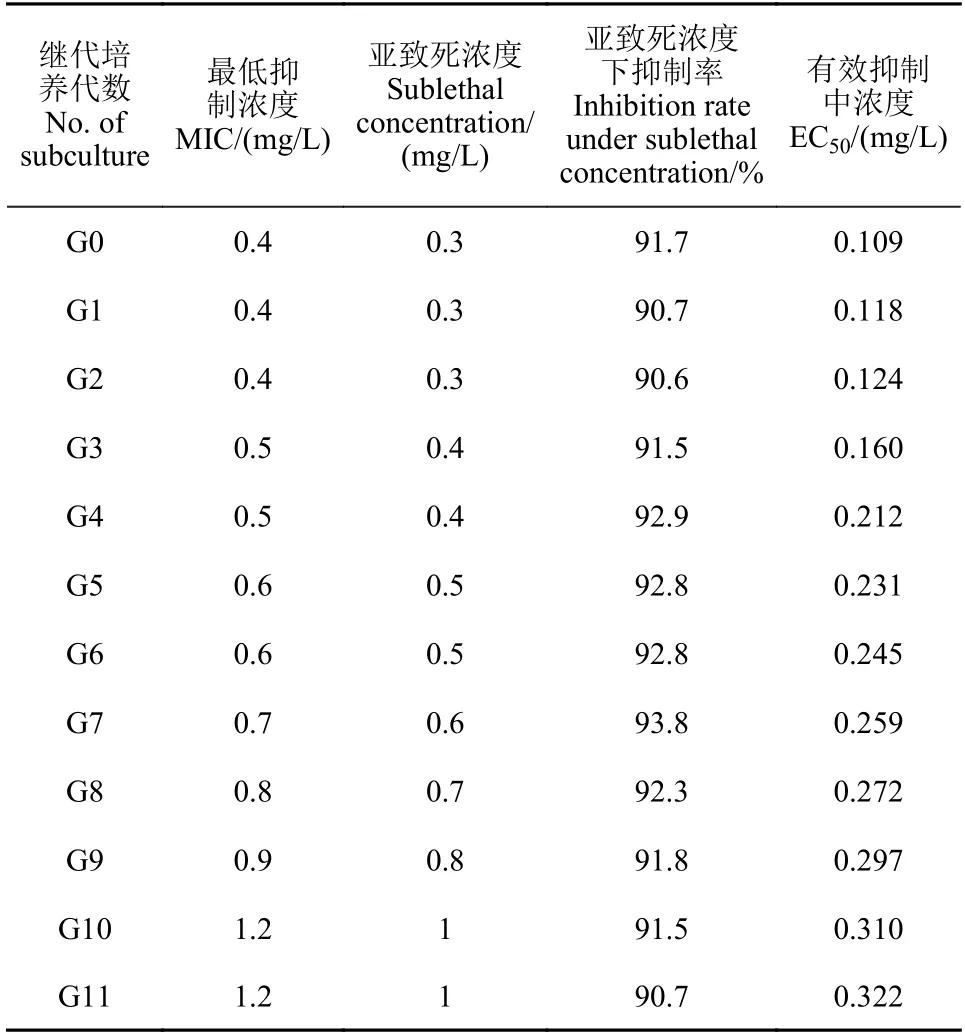
表4 致病疫霉亲本菌株CFKLQ 经药剂驯化获得对缬菌胺抗性过程Table 4 The acquisition of resistance to valifenalate in P. infestans parent strain CFKLQ
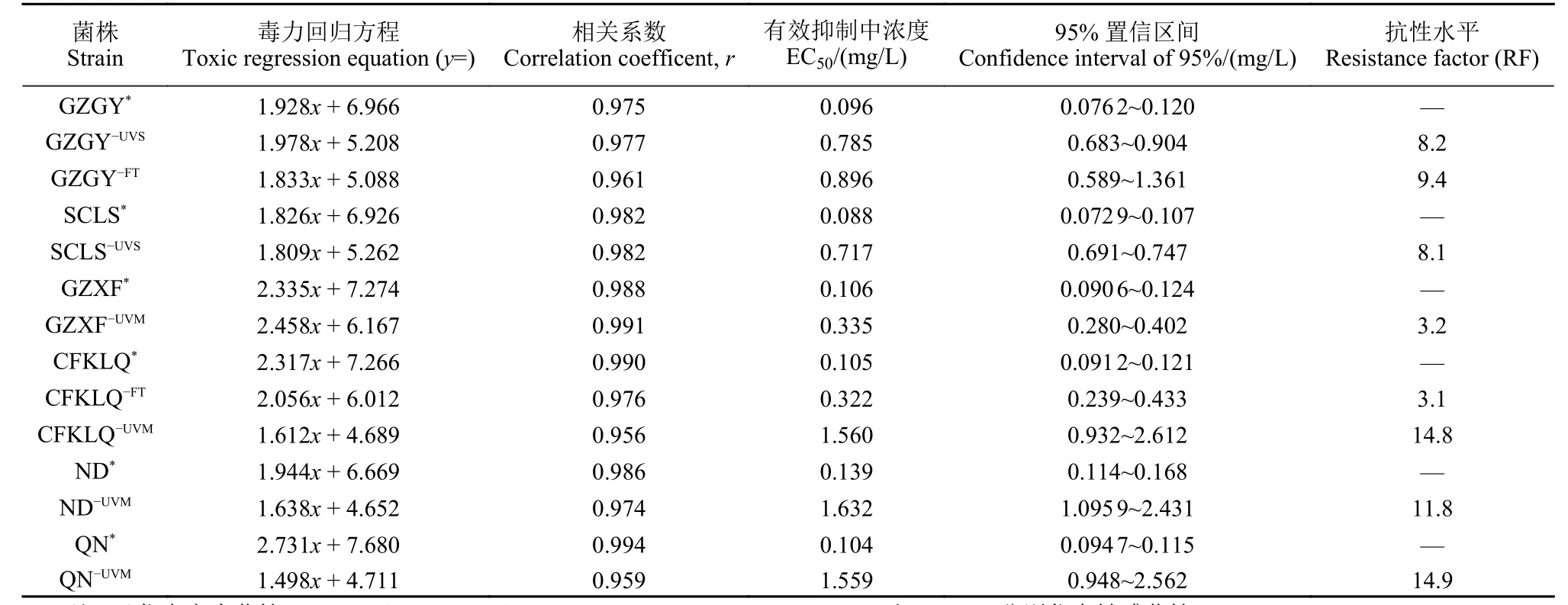
表5 致病疫霉对缬菌胺抗性突变体的抗性水平Table 5 Resistance factor to valifenalate of the valifenalate-resistant mutants of P. infestans
2.3 缬菌胺与其他药剂的交互抗药性
结果表明:致病疫霉对缬菌胺不同抗性突变体及其亲本敏感菌株对缬菌胺 EC50对数值(lgEC50)与对双炔酰菌胺、烯酰吗啉的 EC50对数值(lgEC50)之间相关系数(r)分别为0.862 和0.890,表明缬菌胺与烯酰吗啉、双炔酰菌胺之间存在交互抗性关系;致病疫霉对缬菌胺的不同抗性突变体及其亲本菌株的 lgEC50分别与嘧菌酯、氟吡菌胺、甲霜灵和嘧菌酯lgEC50之间的相关系数分别为0.175、0.281、0.255 和 −0.108,表明缬菌胺与嘧菌酯、氟吡菌胺、甲霜灵和霜脲氰之间无交互抗性 (图3)。
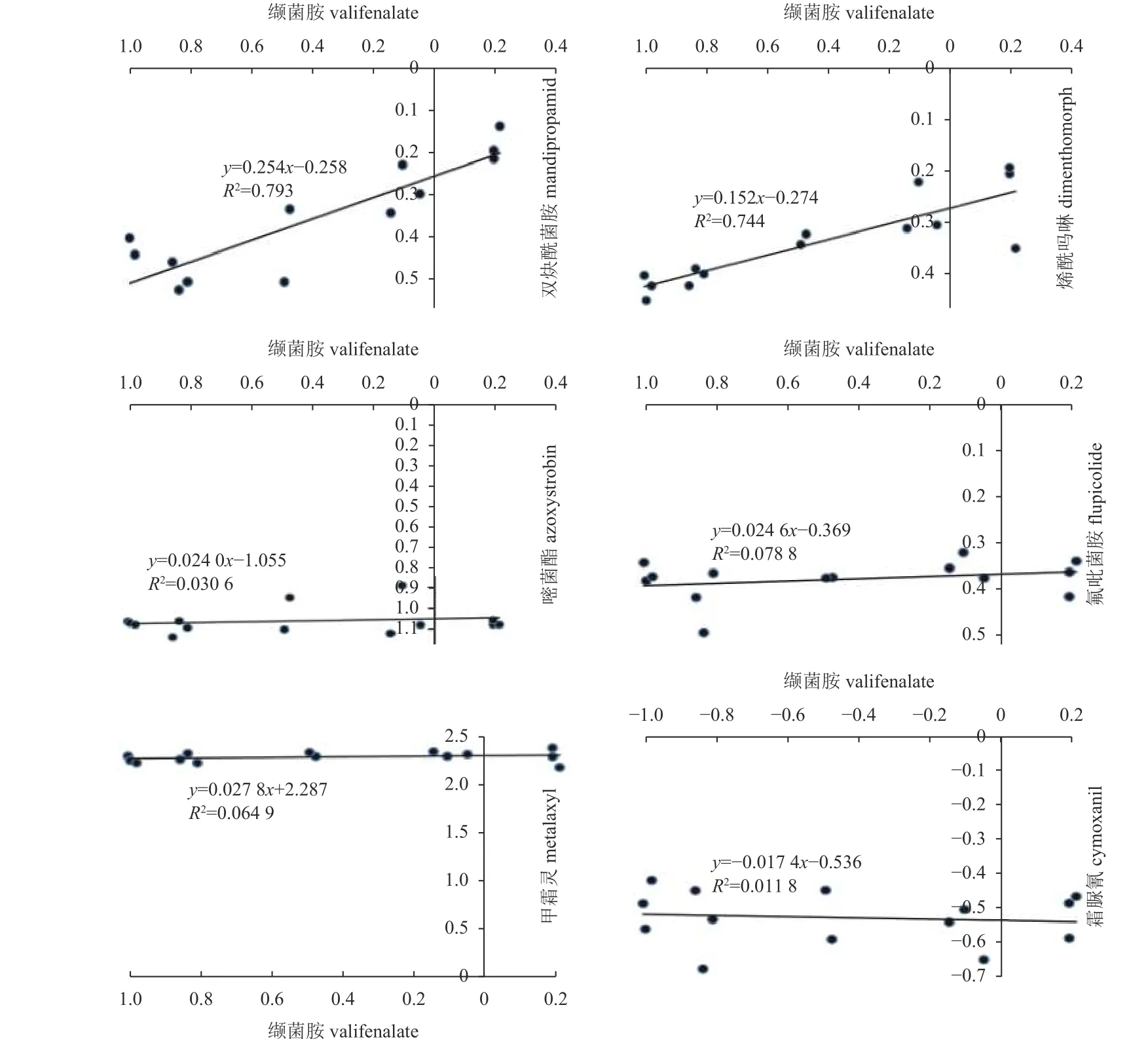
图3 致病疫霉对缬菌胺及其他6 种杀菌剂交互抗性模式Fig. 3 Cross-resistance patterns of P. infestans to valifenalate and the other 6 fungicides
3 结论与讨论
羧酸酰胺(CAA)类杀菌剂是一大类作用机理不同于其他防治作物卵菌病害的苯基酰胺类 (甲霜灵、精甲霜灵、霜灵)、QoI 类杀菌剂 (嘧菌酯、吡唑醚菌酯、啶氧菌酯等)、吡啶酰胺类 (氟吡菌胺)、哌啶基噻唑异唑啉类 (氟噻唑吡乙酮)、氰基乙酰类 (霜脲氰) 和咪唑类 (氰霜唑) 杀菌剂的新型高效内吸杀菌剂,包括烯酰吗啉 (dimenthomorph)、双炔酰菌胺 (mandipropamid)、缬霉威 (iprovalicarb)、氟吗啉 (flumorph)、苯噻菌胺 (benthiavalicarb)、异苯噻菌胺 (benthiavalicarb-isopropyl)、缬菌胺(valifenalate) 和丁吡吗啉 (pyrimorph)。
采用QoI 类杀菌剂嘧菌酯防治黄瓜霜霉病,苯基酰胺类甲霜灵防治马铃薯晚疫病及黄瓜霜霉病2~3 年即出现抗药性问题,这些病原菌对该类药剂已具有中至高度抗性风险[17-18],而致病疫霉等卵菌对羧酸酰胺类杀菌剂烯酰吗啉和双炔酰菌胺存在低至中度抗性风险[19-20],烯酰吗啉、双炔酰菌胺等与QoI 类杀菌剂、苯基酰胺类杀菌剂之间无交互抗性[21-22],除缬菌胺和丁吡吗啉外,烯酰吗啉、氟吗啉、双炔酰菌胺和缬霉威单剂或混剂在田间用于防治马铃薯晚疫病、黄瓜霜霉病、葡萄霜霉病和辣椒疫病的时间已远超10 年,尽管有些国家已检测到田间靶标菌对烯酰吗啉的抗性菌株,如1994 年法国用烯酰吗啉防治葡萄霜霉病8 年后发现田间抗性菌株[23],随后意大利、瑞士、德国及中国检测到黄瓜霜霉病菌、辣椒疫霉等卵菌对双炔酰菌胺和氟吗啉的田间抗性菌株[24-26],但目前羧酸酰胺类杀菌剂防治晚疫病等卵菌病害仍然维持良好的防效。
本研究通过紫外诱导和药剂驯化方法均获得了致病疫霉对缬菌胺的抗性突变体,但抗性突变体抗性水平较低,同时缬菌胺与有低至中度抗性风险的烯酰吗啉及双炔酰菌胺之间有交互抗性关系,与具有高度抗性风险的甲霜灵和嘧菌酯、有中度抗性风险的氟吡菌胺和有低度抗性风险的霜脲氰之间无交互抗性,由此初步推测,缬菌胺与烯酰吗啉和双炔酰菌胺具有相同的作用机理,致病疫霉对缬菌胺有低至中度抗性风险,这一结论尚待研究致病疫霉对缬菌胺抗性突变体的遗传稳定性、竞争力、适合度及机理等生物学性状及监测登记产品缬菌胺 • 代森锰锌使用地区致病疫霉群体对缬菌胺的敏感性下降趋势后进一步评估。虽然缬菌胺与烯酰吗啉和双炔酰菌胺之间存在交互抗性,但是缬菌胺仍可与其他保护性杀菌剂或内吸性杀菌剂混用,以防治马铃薯和番茄晚疫病等卵菌病害。
致病疫霉被国际杀菌剂抗性行动委员会(FRAC)划分为具有高度抗性风险的病原菌[27],因此不能忽视其对羧酸酰胺类杀菌剂的抗性治理。建议在实际应用中,应限制每个生长季节羧酸酰胺类杀菌剂使用不超过3 次,严格按照推荐剂量用药,并与多作用位点的保护性杀菌剂 (代森锰锌、百菌清等) 或与其无交互抗性的其他作用机理的药剂(氟吡菌胺、嘧菌酯、氟噻唑吡乙酮、霜脲氰等)混用或交替使用,以延缓病原菌抗性的产生,延长羧酸酰胺类杀菌剂的使用寿命。此外,在推广使用登记产品缬菌胺 • 代森锰锌制剂防治晚疫病后,应密切关注田间缬菌胺防治晚疫病的防治效果,监测不同年份、不同地区致病疫霉对缬菌胺敏感性的变化,并对缬菌胺田间药效进行验证,进一步评估田间致病疫霉的抗性风险,为缬菌胺等羧酸酰胺类杀菌剂持久发挥良好的防治效果提供参考。

