一株水稻内生菌久留里副伯克霍尔德(Paraburkholderia kururiensis)的分离鉴定及促生功能的评价
王 星,孟炯放,马 荣,何山文,2,郭鹤宝,张晓霞*
(1.中国农业科学院农业资源与农业区划研究所,北京 100081;2.上海市园林科学规划研究院,上海 200232)
“Endophyte”一词释义为内生菌,最早是由德国科学家DeBarry在1886年提出的[1]。植物内生菌可以在宿主体内定居,并与宿主长期共同进化,是一类宿主广泛、种类丰富以及生物学功能多样的微生物[2]。截至目前,在小麦、甘蔗和玉米植物等[3-5]植物的不同部位(根、茎、叶、花、果、种子)中[6-7]均发现了内生菌。根据之前的研究,水稻中也分离出了大量的内生菌,有些内生菌在一定程度上还对植物的生长有利[8],比如,通过固氮[9]、产生植物生长素(IAA)[10]、合成铁载体及抑制病虫害发生等方式促进植物生长[11-12]。许多内生菌也具有可以阻止病原微生物侵染作物的能力[13]。 Fujita等[14]从水稻中分离的一株促生菌Azospirillumsp. B510,通过在番茄根系组织中建立内生定殖后,发现其对由丁香假单胞菌(Pseudomonas syringaepv.tomato)引起的细菌性叶斑病具有抗性。内生菌具有溶解土壤中磷的功能,首先将土壤中难以转化利用的磷分解为可以溶解的磷[15-16],最终实现有效磷的利用[17-18];有些细菌体内还含有1-氨基环丙烷羧酸(ACC)脱氨酶活性,通过控制植物体内的乙烯浓度来调控植物的生长[19];微生物可以诱导合成铁载体,该类物质通过吸收利用环境中的铁,从而作用到自身以及植物身上,当与病原菌竞争有限的铁营养时会抑制病原菌的生长繁殖,从而达到生物防治的作用[20];长期使用化肥已经导致污染环境和危害人类的健康,而利用植物内生菌或次生代谢产物来预防或治疗上述相关的诸多问题是有很多益处的:绿色菌肥不仅不会对作物产生危害,还能在一定程度上抑制病原菌的生长,从而适当提高了植物的抗病力和产量。
本研究从水稻根中分离到一株内生细菌,通过16S rRNA基因初步鉴定为久留里副伯克霍尔德菌(Paraburkholderiakururiensis);通过研究发现其对水稻幼苗有显著促生功能,为水稻专用的微生物肥料提供了优良的菌株资源。
1 材料与方法
1.1 菌株
Paraburkholderia kururiensisHMC50是从稻-稻-黑麦草轮作的水稻根中分离出来的,用于测固氮酶活性的对照菌株为圆褐固氮菌(Azotobacter chroococcumACCC10006),来源于中国农业科学院农业微生物菌种保藏中心。HMC50在TSA培养基中培养,ACCC10006在阿须贝氏培养基[21]中培养,培养温度为30 ℃。
1.2 实验试剂配制
1.2.1 培养基配制
本实验使用的培养基为TSA培养基(Difco)[22]、PKO无机磷培养基[23]、DF培养基和ADF培养基[24]、IAA检测培养基[25]、CAS蓝色定性检测固体培养基[26]、改良的Dobereiner蔗糖苹果酸半固体无氮培养基[27]。血平板购买自北京大宏生物有限公司;LB培养基:蛋白胨10 g、NaCl 10 g、酵母粉5 g、去离子水1 L。
1.2.2 溶液配制
Salkowski比色液:1 mL 0.5 mol/L FeCl3,50 mL 35% HClO4。考马斯亮蓝:100 mg G-250溶入50mL的95%乙醇中,加入100 mL的95%磷酸,去离子水定容到1 L。PBS缓冲液:KCl 0.2 g、NaCl 8 g、KH2PO40.24 g、Na2HPO43.58 g,并用去离子水定容到1 L。CAS检测液:见文献[21]。
1.3 HMC50菌株分子生物学鉴定
利用细菌基因组试剂盒(天根,中国北京)提取菌株HMC50的基因DNA,采用通用引物27F(5’-GTTTGATCMTGGCTCAG-3’)和1492R(5’-TACGGYTACCTTGTTACGACTT -3’)测 定16S rRNA基因序列。PCR反应体系(25μL):3 μL模板DNA,1 μL primers(F/R),2 μL dNTPs,2.5 μL 10×Taq Buffer,0.25 μL Ex taq,16.25 μL ddH2O。PCR 扩增条件为:94℃ 5 min,94℃ 30s,55℃ 1 min,72℃ 90 s,30个 循 环;72℃ 10 min。获得PCR产物后,送测至生工生物工程(上海)股份有限公司。利用NCBI(https://blast.ncbi.nlm.nih.gov/Blast.cgi)网站进行序列比对,与菌株HMC50亲缘关系相近的菌株自EZBioCloud(http://www.ezbiocloud.net/eztaxon)网站下载,利用MEGA 7.0和邻接法(Neighbor-Joining)[28]构建系统发育树,初步确定亲缘关系。
1.4 HMC50 菌株基因组测序与分析
提取菌株HMC50的基因组DNA,送至安诺优达基因科技(北京)有限公司测序。采用SPAdes 2.9.0[29]对去除接头序列的测序数据进行从头拼接,使用27至127(27、47、63、77、89、99、107、115、121和127)范围内的多个k-mer组合进行组装,其中k-mers 127组装效果最佳。使用TYPE(STRAIN)GENOME SERVER(TYGS)网站[30]对该菌株进行基因组水平的鉴定,其中包括DDH(DNA hybridization)值的计算以及使用GBDP(genome blast distance phylogeny)和邻接法构建全基因组树。进一步利用RAST[31]在线网站(https://rast.nmpdr.org/)进行基因注释,并使用antisMASH 3.0[32]在线工具预测与次级代谢产物相关的基因簇,将所得的16S rRNA序列和基因组序列上传提交至NCBI获得登录号。
1.5 HMC50菌株功能特性实验的检测
1.5.1 溶磷实验[33]
将待测菌株分别点接于PKO无机磷培养基上,并于28℃进行培养,设置3个重复,每隔24 h测量一次溶磷透明圈直径(HD)和菌落直径(CD),计算比值(比值为1的菌株无溶磷能力),至比值无变化为止,确定测定菌株溶磷效果。
1.5.2 产IAA实验[34]
实验中选用Salkowski比色法[35]测量植物内生细菌分泌植物生长素(IAA)。定性检测:通过颜色深浅反映产生IAA的多少;定量检测:标准曲线的绘制采用分析纯,将菌悬液离心后的上清液和Salkowski比色液等体积混合后,室温避光静置30min,测定其OD530值,并测量相应菌悬液OD600的值,定量结果计算出的数值越大,表明分泌IAA的量越大。
1.5.3 产铁载体实验[21]
具有产铁能力的细菌微生物可以在备置好的产铁载体定性平板上形成一圈橘黄色的晕圈。定性检测:观察目的菌株在CAS蓝色定性检测平板上的生长情况;定量检测:CAS检测液与菌悬上清液等比混合,静置l h后采用分光光度计测定630 nm波长处的吸光值(A),取培养基(TSB)作为对照调零。CAS检测液与TSB培养基等比混合,测定吸光值即为参比值(Ar),并测量A/Ar值。
1.5.4 ACC脱氨酶活性测定[36]
首先将HMC50菌悬液接种于DF培养基中,180 r/min 30℃培养24 h,之后将DF菌悬液转接两次于ADF培养基中,180 r/min 30℃培养48 h。利用酶标仪测定菌浓度OD600,以不接菌的ADF液体培养基为阴性对照,测得的差值即为实际菌液浓度值,值大于0.1表明菌株能够利用ACC作为唯一氮源生长,初筛后收集菌体,制备粗酶液,绘制α-酮丁酸标准曲线,测定200μL粗酶液中的总蛋白和ACC脱氨酶活性。按照式(1)计算ACC脱氨酶活性(U/mg)。

1.5.5 固氮基因(nifH基因)的扩增
上述已用试剂法提取了菌株HMC50的基因组DNA,用nifH基因引物IGK3和DVV(IGK3 5’-GCI WTHTAYGGIAARGGIGGIATHGGIAA-3’;DVV 3’-CT RCAICAIACRCCICCIAARCGITA-5’)进行PCR扩增。PCR反应体系(25 μL):3 μL 模板 DNA,0.5 μL IKG3(10 μmol/L),0.5 μL DVV(10 μmol/L),2 μL dNTPs,2.5 μL 10×Taq Buffer,0.25 μL Ex taq,16.25 μL ddH2O。PCR 扩增条件为:94℃ 2 min,94℃ 30 s,56℃ 1 min,72℃ 1 min,40个循环;72℃3 min。取2 µL PCR产物进行电泳检测(1%琼脂糖凝胶),110 V,300 mA,35 min,反 应 结 束 后Ethidium Bromide浸 泡10 min观 察条带。
1.5.6 固氮酶活性测定[21]
常用的测定固氮酶活性的方法之一是乙炔还原法,通过气相色谱法检测乙炔是否被还原成乙烯以及数量多少,从而间接测定是否有固氮酶活性及其酶活性的高低,对照菌株选择ACCC10006。先做1 mol C2H4气体的标定,之后用固体法测乙烯的量。按照式(2)计算固氮酶活性
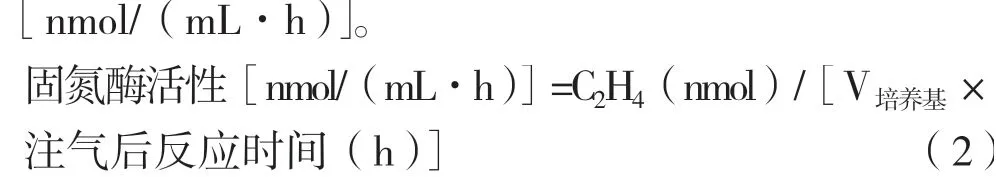
式中:C2H4(nmol)=普析气相检测浓度×V试管×10。
1.6 HMC50菌株促生盆栽试验的验证
1.6.1 盆栽试验材料
已纯化的HMC50菌株接种于LB培养基中,30℃、转速220 r/min、48 h进行培养;水稻品种选用日本晴;土壤采用菜园土与蛭石3∶1混匀后装盆;试验用盆购买自花卉市场,尺寸为上直径15 cm、下直径10 cm、高12 cm。
1.6.2 盆栽试验方法
制备108CFU/mL的菌悬液,水稻种子解除休眠,并催芽,采用灌根方式接种,经过播种、定苗、田间管理培养30 d后,测量植株的单株重(g)、总干重(g)、总鲜重(g)、根重(g)、茎重(g)、茎长(cm)和根长(cm)指标,并将所得数据利用SPSS 20.0进行统计学分析。
2 结果与分析
2.1 HMC50 菌株的鉴定
对已纯化的菌株HMC50进行16S rRNA基因扩增,序列长度为1500 bp左右。将序列在NCBI和EZBioCloud网站中进行BLAST比对,通过分析发现其与Paraburkholderia kururiensissubsp.kururiensisTJCM10599(BAMQ01000301)的16S rRNA 同源性达到100%。使用Neighbor-Joining法构建系统发育树(图1)显示:HMC50与P. kururiensissubsp.kururiensisTJCM10599处于同一个分支,HMC50的16S rRNA序列已经上传GenBank,获得登录号MW276133。
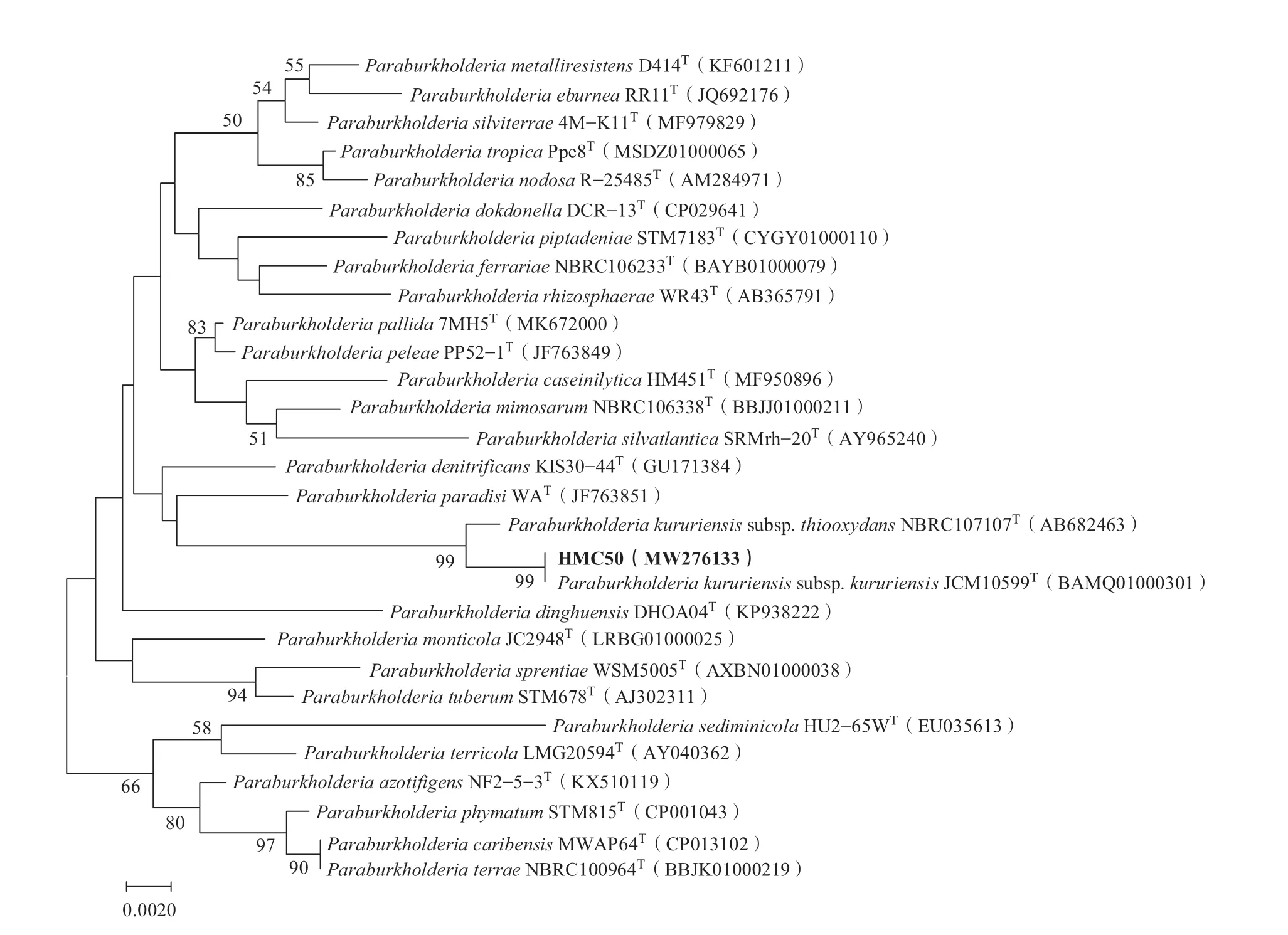
图1 基于16S rRNA基因序列使用邻接法构建系统发育树
2.2 HMC50菌株的基因组概述及特征
对菌株HMC50进行基因组草图测序,并提交GenBank,序列号为 JADCKR000000000。HMC50基因组全长7350161 bp,由171个contigs组成,G+C含量为64.9%。根据TYGS网站默认参数确定最接近的基因组序列,共包含15株参考菌株以及一个外群菌株Trinickia symbioticaJPY345T,同时构建了基于全基因组的系统发育树(图2),发现该菌株与Paraburkholderia kururiensisLMG19447T聚类到一起,并且两株菌的DDH值为83.6%,70%为原核生物分类阈值[37],基于16S rRNA基因及全基因组数据确定菌株HMC50为Paraburkholderia kururiensis,参考菌株的基因组信息和登录号见表1。该基因组共编码7023个基因,其中2180个(35%)是假设蛋白。另外,编码rRNA基因3个、tRNA 21个、ncRNA 32个。表2列出了菌株HMC50可能具有的有益特征,比如与促进植物生长、解毒、运动性等相关的主要特征。通过注释结果发现与固氮相关的基因共有18个,包括固氮酶铁蛋白、固氮酶钼铁蛋白α链(EC 1.18.6.1)和固氮酶钼铁蛋白β链(EC 1.18.6.1)基因。NifBE基因负责铁钼辅因子(FeMo-co)的生物合成,NifOZT基因与固氮酶复合物的生物合成有关,同时发现该菌株携带有固氮酶铁蛋白nifH关键基因。因此,从基因水平上预测菌株HMC50具有固定N2的能力;菌株HMC50携带的基因可能能够抵抗植物组织中存在的有毒化合物,包括过氧化氢酶、谷胱甘肽S转移酶、硝化酶、超氧化物歧化酶、过氧化物酶以及能够摄取硒酸盐和亚硒酸盐;该菌株的基因组还预测到59个趋化性和运动性的基因,注释到的基因全都是由鞭毛运动介导的,同时鞭毛的运动性能够促进细菌与宿主的相互作用;色氨酸是植物生长素吲哚乙酸(IAA)的合成前体,IAA在促进植物生长方面具有调节作用[38-39],在合成生长素的子系统中,发现色氨酸合酶α链(EC 4.2.1.20)和色氨酸合酶β链(EC 4.2.1.20)初步在基因水平预测该菌株能产IAA。基因组还包含一些与Ⅱ、Ⅳ和Ⅴ型分泌系统相关的基因;利用antiSMASH 3.0对基因组进行次生代谢产物的预测,共发现6种次生代谢基因簇(表3)。其中2个属于非核糖体肽合成酶基因簇(Nonribosomal peptide-synthetase,NRPS),分别编码脂肽和半乳糖素,此外还编码萜烯、芳基多烯、芥酸内酯和异胞糖脂合酶类蛋白激酶。

表2 菌株HMC50基因组中与促进植物生长和生物防治相关的基因列表

表3 菌株HMC50基因组预测的次生代谢产物生物合成基因簇列表

图2 基于基因组使用邻接法构建系统发育树
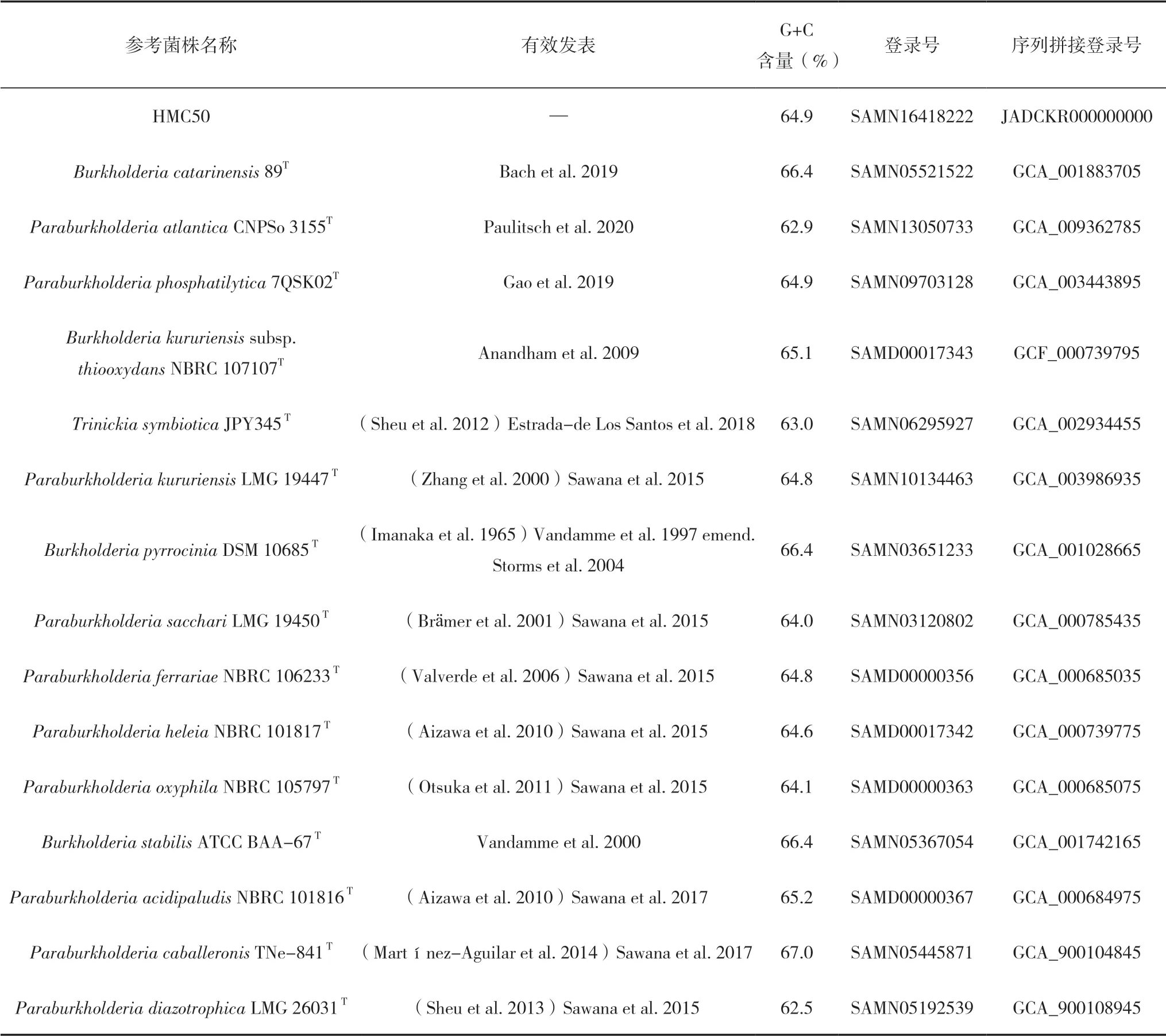
表1 菌株HMC50和参考菌株的基因组以及登录号信息
2.3 HMC50菌株的功能特性
2.3.1 分泌IAA性能定量检测
色氨酸是植物生长素IAA的合成前体[34],在培养基中加入色氨酸可诱导微生物合成IAA,在过氯酸存在的条件下,IAA可以与氯化铁发生显色反应,进而来判断IAA的生成量。定性测量结果:菌株HMC50在白色陶瓷板上颜色变浅红,表示能够分泌IAA。分泌IAA定量检测结果为29.57 mg/L,IAA定量的标准曲线见图3,分泌IAA的能力定性检测结果和定量检测数据见表4。
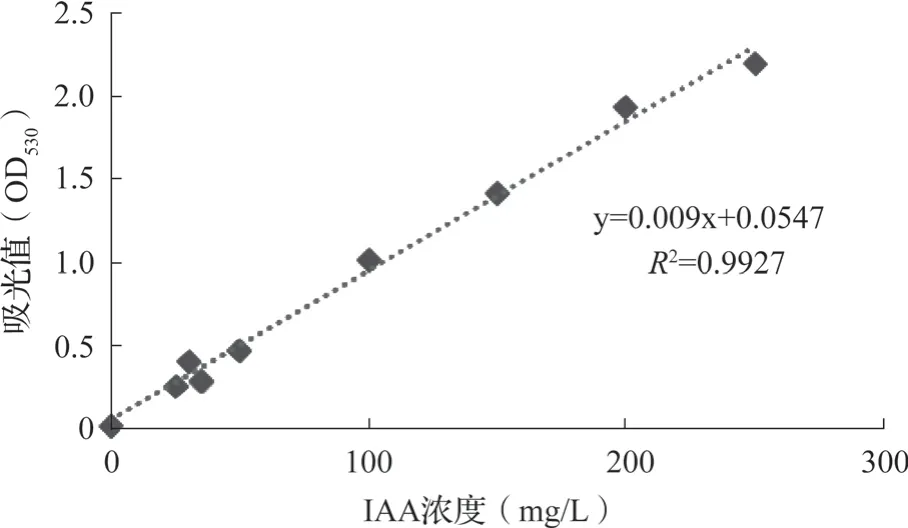
图3 IAA标准曲线

表4 菌株分泌IAA能力定性检测结果和定量检测数据
2.3.2 固氮基因扩增结果以及固氮酶活性能力
基因组预测结果中发现了nifH基因,nifH基因是编码固氮酶的结构基因,也是许多固氮微生物的主要固氮基因之一[40],所以对HMC50菌株进行nifH基因扩增的验证实验,扩增片段长度在340bp左右。图4为nifH基因扩增图,阳性对照圆褐固氮菌ACCC10006为中国农业微生物菌种保藏中心的一株固氮酶活性很强的菌株。进一步利用气相色谱法准确地测定了菌株将乙炔还原成乙烯的量,进而计算出固氮酶活性为11.9 nmol/(mL·h),测得圆褐固氮菌ACCC10006的酶活性为14.5 nmol/(mL·h),说明菌株MHC50具有较高的固氮酶活性,结果见图5。

图4 nifH基因PCR扩增图
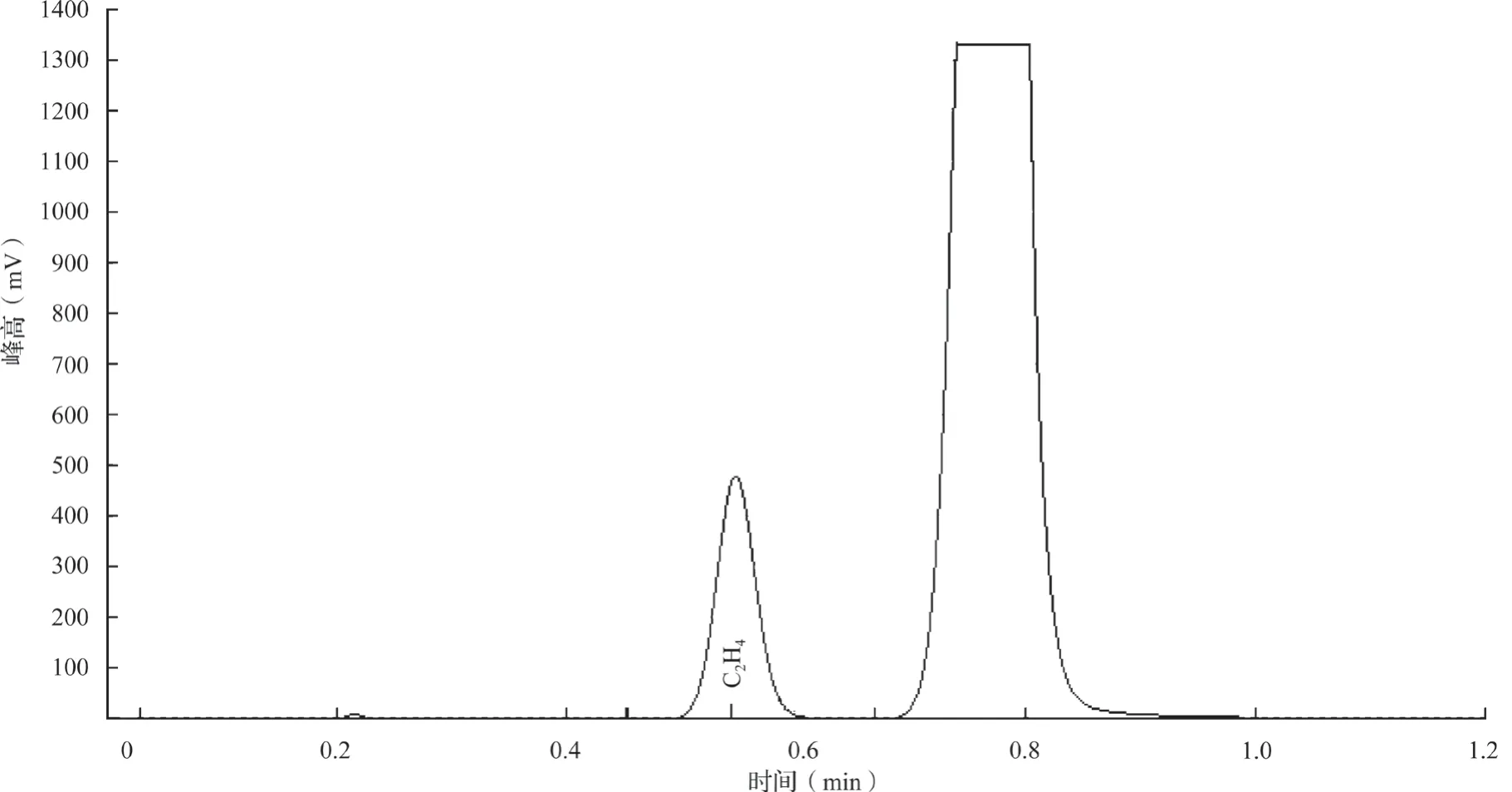
图5 菌株HMC50固氮酶活性
2.3.3 产铁载体能力
铁载体检测通常采用定性初筛及A/Ar值的相对定量实验,认为A/Ar为0~0.6时产铁载体能力较强(+++)、0.6~0.8为中等(++)、0.8~1.0为较弱(+)。经过定量和定性检测结果发现HMC50菌株的产铁载体能力较强,结果见表5。
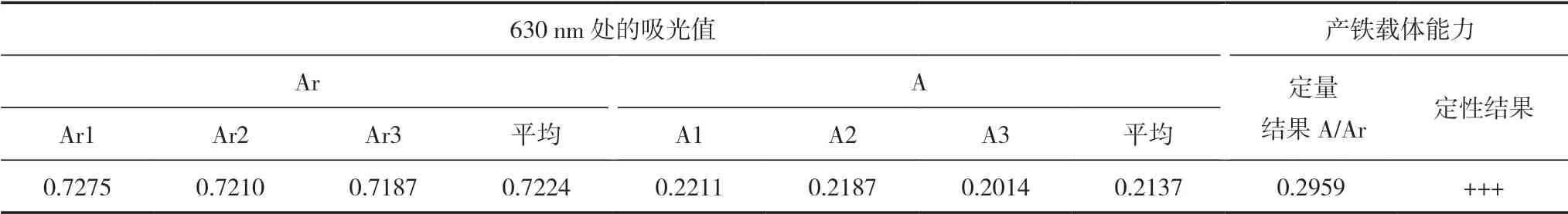
表5 供试菌株HMC50产铁载体能力的定性结果和定量检测数值
2.3.4 ACC脱氨酶活性
利用酶标仪测定菌浓度OD600的平均值为0.35,实际菌液浓度OD600大于0.1以上,初步表明该菌株能够利用ACC作为唯一氮源生长。之后收集菌体净重是0.26 g,α-酮丁酸的物质的量为2.3775 μmol,粗酶液中总蛋白量为0.2264 mg,HMC50的ACC脱氨酶活性是1.34 U/mg。
2.3.5 溶解无机磷能力
点接法培养一周左右,观察计算菌落溶磷透明圈直径(HD)与菌落直径(CD)的比值是3.97,菌株HMC50具有溶解无机磷能力,图6为菌株HMC50的溶解无机磷情况。
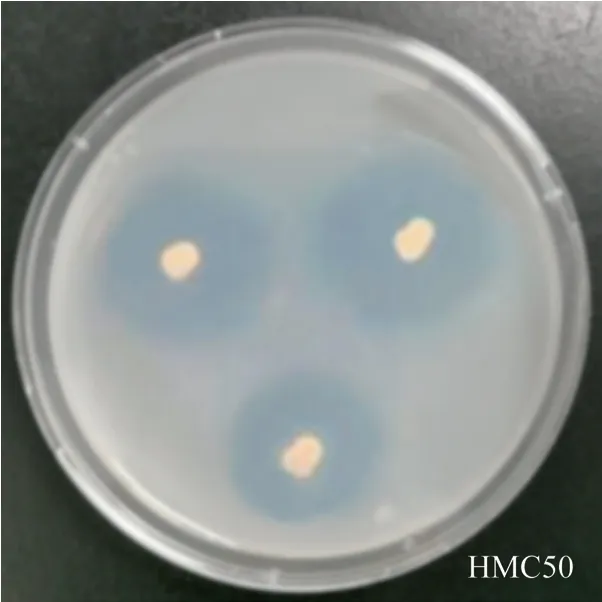
图6 菌株HMC50溶解无机磷能力
2.4 HMC50菌株的促生效果
基于功能特性试验发现菌株HMC50具有产铁载体、分泌IAA、产ACC脱氨酶、提高固氮酶活性、溶解无机磷的功能,进一步设计了盆栽试验探究菌株对水稻生长的促生作用(图7),在育苗1个月后收集并整理所测量的各参数数值,结果显示接种菌株HMC50后,根长、茎长、总鲜重、总干重、茎重 、根重以及单株重等指标相比对照组(CK)都表现出了明显的优势(表6),各水稻性状及相比于CK的方差分析结果见表6。

图7 接种菌株HMC50对水稻生长的影响
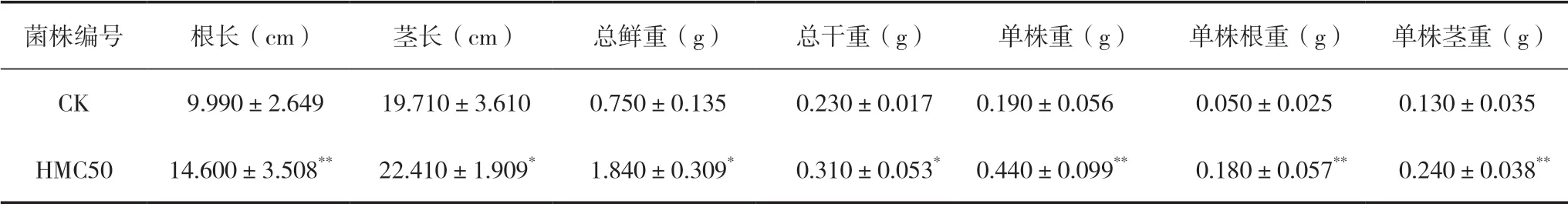
表6 水稻性状方差统计
3 讨论
Sawana等[41]在2014年基于分子标记和系统生物学的分析,提议将原伯克霍尔德菌属(Burkholderia)分为两个属,一类主要为包含人与植物病原微生物的伯克霍尔德菌属(Burkholderia),另一类为不同环境中的微生物,并重新命名为副伯克霍尔德菌属(Paraburkholderia),其中包括P. kururiensis。已有研究显示,伯克霍尔德菌和副伯克霍尔德菌在自然环境中分布广泛,从香蕉、菠萝、甘蔗、烟草和木薯中均发现了这一类群的菌[42-43],且具有生物降解能力[44-45],产生的化合物具有抗菌活性[46],还能够促进植物生长[47],是公认的内生固氮菌[48]。但是对P. kururiensis菌株进行全面系统的功能特性的研究报道较少,本研究对从水稻根中分离到的P.kururiensisHMC50,在基因组水平上预测到其具有固定N2以及分泌IAA的促生潜能,并且发现59个基因与鞭毛的运动性相关,推测这能促进微生物与宿主的相互作用,有利于定殖的发生,产生的化合物具有解毒作用,携带多个参与生物降解能力的相关基因。也有学者初步探究了P. kururiensis的基因组数据[49],本研究不仅在分子水平上进行基因预测分析,也结合了功能评价的验证实验,对该菌株进行了固氮酶活性的测定,结果发现其固氮酶活性达到了11.9 nmol/(mL·h),与具有高固氮酶活性的圆褐固氮菌ACCC10006的酶活性相近。同时也发现此菌株的确具有分泌IAA的能力,IAA是一种植物体内普遍存在的内源生长素,通过不同的信号传导途径激发各种生理效应,促进植物的生长发育[50-52]。除此之外还具有产铁载体、产ACC脱氨酶、溶磷的功能;在盆栽试验中,测量HMC50实验组的各性状指标都优于空白对照,初步认为其具备优良的促生能力,进一步的研究将转入田间自然的生态环境中,验证并挖掘菌株HMC50对植物的有益作用,观察水稻的促生效果能否与室内培养效果达到一致。
4 结论
本研究从水稻根中分离到一株内生细菌HMC50,鉴定为久留里副伯克霍尔德菌(Paraburkholderia kururiensis),通过基因组预测和功能特性实验的验证,发现其具有产铁载体、分泌IAA、产ACC脱氨酶、固氮、溶解无机磷的功能,可以显著促进水稻幼苗的生长,为水稻特用的微生物肥料研究方面提供了优良的菌株资源。

