改性ZrO2基催化剂催化乙醇转化制备正丁醇
魏 玲,霍霄妮,汪艳霞 ,董春娟,张铁明
(1.太原学院公共实验中心,山西 太原 030024; 2.太原学院建筑与环境工程系,山西 太原 030032;3.太原科技大学化学与生物工程学院,山西 太原 030032)
近年来,随着人类环保意识不断的提升,以减少环境污染,节约化石燃料为目标,开发可代替化石燃料的研究越来越多,绿色能源技术被提到了新的高度。正丁醇是一种洁净、用途广、可持续发展的化学试剂,可以作为多种涂料的溶剂、有机合成物的原料、有机实验的萃取剂、表面活性剂、增塑剂、脱蜡剂等[1-3]。除此之外,正丁醇可以做为柴油、喷气燃料的添加剂,其汽化热较低、能量密度较高、疏水性较强,是一种更优越的可再生生物燃料[4]。
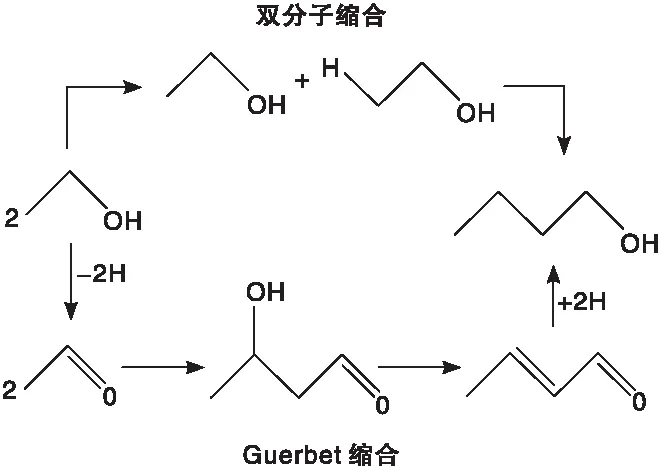
目前,正丁醇的工业制法主要有发酵法、丙烯羰基合成法和乙醛缩合法3种。发酵法生产效率偏低,且原料为粮食,存在“与人争粮”的局面;而丙烯羰基合成法是一条石油基路线,基于我国“富煤贫油”的现状,开辟一条非石油正丁醇合成路线更加迫切。乙醛缩合法先将两分子的乙醛通过羟醛缩合反应生成丁醇醛,然后再脱去一分子的水制得巴豆醛,最后经催化加氢生成正丁醇。该制备方法对设备的腐蚀很严重,而且生产成本偏高。正丁醇还可以采用乙醇自缩合反应制备[5],如下式所示,此过程中用到的乙醇可以由传统工业生产,也可以从成本较低的生物质路线获得[6];此外,由乙醇直接合成正丁醇,原子利用率较高。鉴于以上优点,乙醇作为原料合成正丁醇是一条很有潜力的新技术路线。
在现有的研究报道中,主要以均相金属配合物催化剂[7-10]、酸碱催化剂(液体酸碱和固体酸碱)[11-15]和负载型金属催化剂[16-22]3种催化体系研究较为广泛。其中,均相金属配合物催化剂上乙醇合成正丁醇转化率高,选择性高,要求的反应条件低,大部分采用贵金属(Ir、Rh等),成本较高,且分离回收困难,无法重复使用;液体碱对设备有严重的腐蚀性,反应过程中生成的含碱废水污染环境、处理费用高;固体碱需要的反应温度较高(>400 ℃),产物选择性较低;混合金属氧化物和羟基磷灰石(HAP)对反应温度要求比固体碱求略低,但必须达到300 ℃以上;过渡金属负载的γ-Al2O3催化剂具有较好的催化效果,但催化剂易在水的作用下转变为勃姆石而失活。
ZrO2是一种表面同时含有酸碱性和氧化还原性的氧化物,广泛用于催化剂或者载体。金属Cu是醇类催化脱氢的活性组分[23-26],毒性较小,价格低。虽然ZrO2单独作为催化剂可以催化乙醇合成正丁醇[27-28],但是脱氢效果较差,催化活性不高。若将脱氢效果较好的Cu组分引入ZrO2中,同时具有脱氢、酸碱性,为乙醇合成正丁醇提供了所需的活性中心,对于开展环境友好催化具有很好的应用前景。本文以ZrO2为催化剂,采用Cu和碱金属K对其进行改性,考察不同催化剂对乙醇一步合成正丁醇性能的影响。
1 实验部分
1.1 主要仪器和试剂
PC-24型液压压片机,天津精拓仪器科技有限公司;HJ-2A恒温加热磁力搅拌器,常州市亿能实验仪器厂;AL204电子天平,瑞士梅特勒托利多公司;GZX-9140MBE鼓风干燥箱,上海右一仪器有限公司;SXZ-2.5-12A马弗炉,上海沪粤明科学仪器有限公司;GC7820A气相色谱,美国Agilent公司。
无水乙醇、ZrOCl2·8H2O、氨水、Cu(NO3)2·3H2O、KOH、KBr,均为分析纯,国药集团化学试剂有限公司。
1.2 催化剂制备
称取48 g ZrOCl2·8H2O溶于500 mL去离子水中,室温下向该溶液中逐渐滴加氨水,机械搅拌,控制溶液pH=11。沉淀完成后继续搅拌1 h,静置3 h后进行抽滤、洗涤,直至无Cl-离子。将滤饼在100 ℃下干燥12 h,400 ℃下焙烧6 h得到ZrO2。
将上述ZrO2催化剂研磨后等体积浸渍质量分数5%的Cu(三水硝酸铜为前驱物),在100 ℃干燥12 h,然后在400 ℃焙烧 6 h,得到CuZrO2催化剂。
将上述CuZrO2催化剂等体积浸渍质量分数2%的K(KOH为前驱物),在100 ℃下干燥12 h,然后在400 ℃下焙烧 6 h后得到KCuZrO2催化剂,经成型、破碎、过筛后得(20~40) 目备用。
1.3 催化剂表征
比表面积表征采用美国Micromeritics公司的Tristar 3020型物理吸附仪,77 K温度下进行 N2吸附,根据脱附曲线采用BET方程计算比表面积。
XRD表征采用德国Bruker公司D8 Advance型X射线衍射仪,Cu Kα,Ni滤波,工作电压40 kV,工作电流100 mA。
催化剂表面羟基表征采用德国Bruker公司Tensor 27型红外光谱仪,KBr背景,催化剂粉末研细,装入检测器后,调节Ar气氛、控温350 ℃,催化剂脱除吸附水后采集光谱。
H2-TPR表征在自制测试装置上进行,称取100 mg催化剂在Ar气氛中升温至300 ℃,恒温2 h,然后降温至50 ℃,切换为还原气H2/Ar(体积比1∶10),稳定基线后以10 ℃·min-1的速率升温至400 ℃,TCD检测器分析气体组成。
XPS表征采用美国Thermo Fisher Scientific公司Escalab 250Xi型X-射线光电子能谱仪,以1 486.6 eV 的Al Kα射线,284.6 eV的污染碳结合能环境下进行测试。
乙醇-TPSR在自制装置上进行测试,350 ℃条件下还原100 mg催化剂2 h,切换气体为Ar降温至50 ℃,乙醇蒸汽随着Ar鼓泡引入至石英管,吸附30 min,然后以10 ℃·min-1速率升温到500 ℃,采用质谱检测脱附产物。
CO2-TPD在自制装置上进行测试,称取100 mg催化剂,在Ar气氛中程序升温至300 ℃恒温2 h,然后降温至50 ℃,采用脉冲法通入CO2气体,使其吸附饱和,再次用Ar气吹扫30 min,最后以10 ℃·min-1速率升温脱附到500 ℃, TCD检测器分析脱附产物。
1.4 催化剂活性评价
乙醇缩合制正丁醇催化剂活性评价流程如图1所示。将1 mL催化剂装入内径6 mm管式反应器中,反应管上下部均填充石英砂,通入10%H2/Ar(20 mL·min-1),程序升温至350 ℃(3 ℃·min-1)并保持3 h,切换纯H2至反应压力(5.0 MPa),在所需反应温度下进行缩合反应。在氢气气氛下引入无水乙醇溶液,经瓷环预热后,乙醇蒸汽经装有催化剂的固定床,催化缩合的产物经冷凝后收集。反应产物采用气相色谱仪进行分析,配备有TCD检测器和填料柱(10%NiSO4on coal,3 m×3 mm),用于检测一氧化碳和二氧化碳,FID检测器和毛细管柱(HP-FFAP,50 m×0.32 mm)用于检测有机化合物。
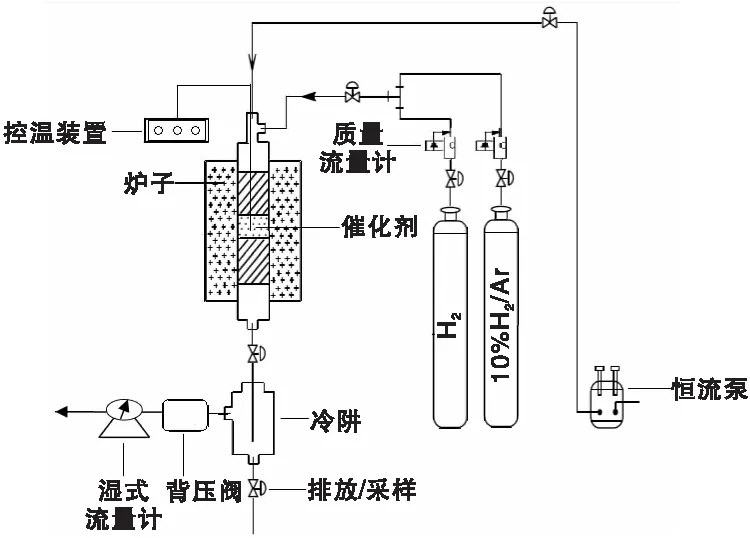
图1 乙醇缩合制正丁醇工艺流程简图Figure 1 Reaction setup for ethanol conversion into n-butanol
2 结果与讨论
2.1 表征结果
2.1.1 催化剂织构参数
ZrO2基催化剂焙烧后的结构参数如表1所示。由表1可知,ZrO2平均孔径和孔体积分别为6.7 nm和0.34 cm3·g-1,比表面积较高,达到199 m2·g-1。在ZrO2表面引入Cu和K时,催化剂的比表面积降低到169 m2·g-1和137 m2·g-1。平均孔径逐渐增加,孔容逐渐降低。
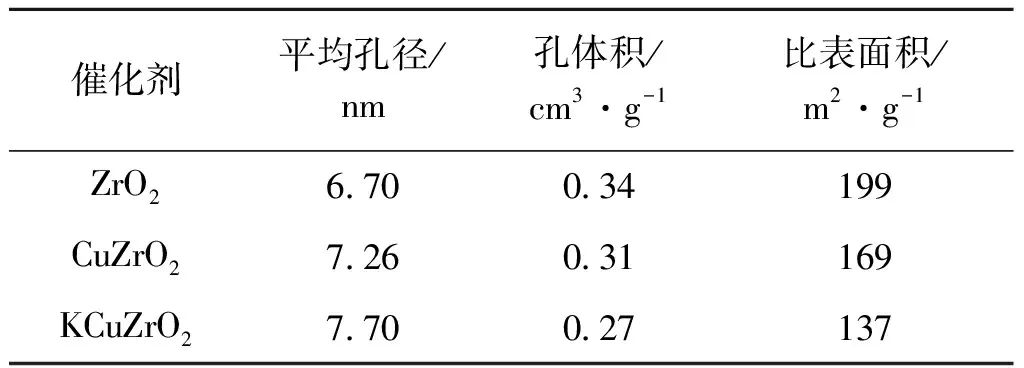
表1 催化剂织构参数
2.1.2 XRD
催化剂的XRD图如图2所示。由图2可以看出,3种催化剂呈现出相似的谱图,Cu和K的引入对ZrO2的结构影响较小。在30.5°、35.9°、50.8°和60.2°处出现了四方氧化锆(t-ZrO2)的特征峰。另外,31°附近的峰型较宽,这归因于无定形氧化锆(am-ZrO2)[29],表明ZrO2主要以t-ZrO2形态存在,同时含有部分无定形结构。催化剂担载Cu和K以后,并未观察到CuO和K2O的特征峰,表明CuO和K2O在ZrO2上分散较好,粒径较小,低于仪器检查下限。
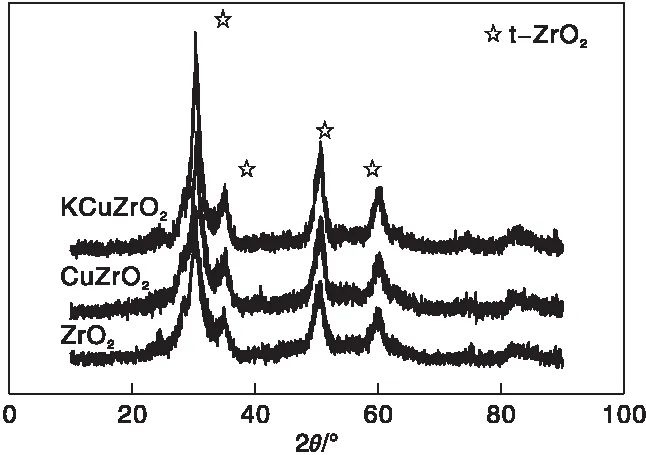
图2 不同催化剂的XRD图Figure 2 XRD patterns of different catalysts
2.1.3 FT-IR
采用FT-IR分析催化剂表面结构,结果如图3所示。
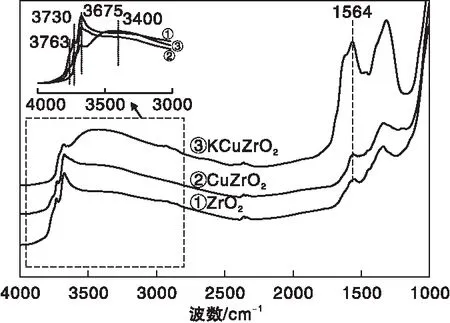
图3 不同催化剂的FT-IR谱图Figure 3 FT-IR spectra of different catalysts
由图3可以看出,在1 620 cm-1附近没有观察到与分子吸附水相关的特征峰,表明前期预处理已将物理吸附水完全脱除。在(3 000~4 000) cm-1处出现明显的包峰,归属为催化剂表面羟基吸收峰,同时,在1 564 cm-1处也观察到了明显的吸收峰,归属为表面羟基弯曲振动。当在ZrO2催化剂表面担载Cu以后,(3 000~4 000) cm-1处(3 763 cm-1、3 730 cm-1、3 675 cm-1、3 400 cm-1)归属为羟基的宽峰强度明显降低,1 564 cm-1处特征峰也明显降低,说明Cu的引入导致催化剂表面羟基含量降低。Chen Hao等[30]发现,Al2O3上的羟基是铂和镍的活性位点,羟基不仅对铂和镍的分散有重要影响,而且对铂和载体的相互作用也有影响。谷传涛等[31]也认为SiO2表面羟基是催化剂制备过程中影响其表面铜物种分散的关键因素。由此可知,由于ZrO2表面具有丰富的羟基,使得Cu在催化剂表面能够很好的分散,与XRD结果一致。当进一步担载K进行改性后,催化剂表面归属为羟基的特征峰(3 763 cm-1、3 730 cm-1、3 675 cm-1)强度进一步降低,而3 400 cm-1出的宽峰强度略有增加,可能来源于K2O物种表面的羟基。
2.1.4 H2-TPR
采用H2-TPR评估催化剂的还原行为,结果见图4。从图4可以看出,ZrO2催化剂上没有观察到明显的耗氢峰,表明在测试温度范围内ZrO2不会被还原。CuZrO2催化剂在193℃处出现一个对称性较好的耗氢峰,归属为Cu2+到Cu0的还原。当催化剂进一步采用K进行改性后,仍可以观察到一个明显的耗氢峰,峰温向高温方向发生了偏移(206 ℃),且峰型宽化。由于碱金属的引入对H2的活化具有抑制作用,H2解离变得困难,最终导致CuO耗氢峰向高温方向偏移[32-33]。
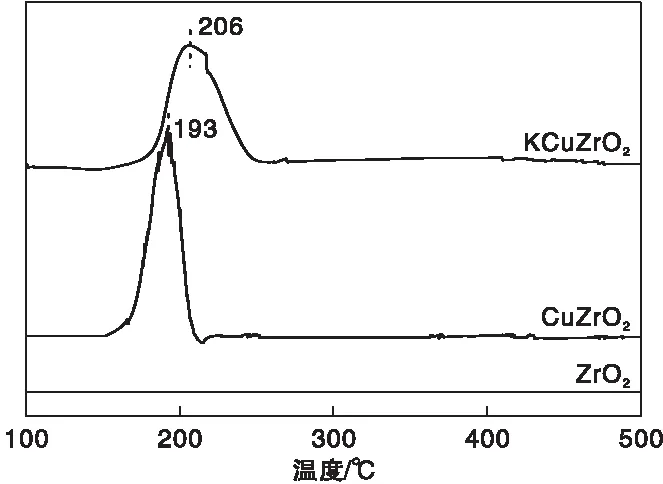
图4 不同催化剂的H2-TPR谱图Figure 4 H2-TPR profiles of different catalysts
2.1.5 XPS
为了考察Cu、K的引入对ZrO2催化剂电子环境的影响,对催化剂进行XPS分析,结果如图5所示。由图5可知,Zr 3d5/2位于约182 eV,表明Zr在催化剂中以Zr4+存在。Cu的引入对Zr电子结合能影响不大,而K的添加使Zr电子结合能降低;Cu 2p3/2峰的结合能约为934 eV,且在(940~945) eV可以观察到明显的卫星峰,说明Cu以Cu2+的形成存在,另外,K的引入同样使得Cu电子结合能明显降低,这可能是由于K的电子助剂特性引起。O 1s图中530 eV附近的特征峰归属为催化剂表面晶格氧,Cu的引入对其影响不大,而K引入后,O 1s结合能由530.2 eV偏移到529.9 eV,电子结合能降低。
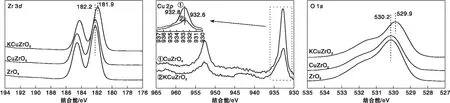
图5 不同催化剂的XPS谱图Figure 5 XPS profiles of different catalysts
2.1.6 乙醇-TPSR
图6是不同催化剂上的乙醇-TPSR谱图。由图6可知,少量乙醇以分子态形式脱附,大部分在催化剂表面分解,形成CO、乙烯、水、甲醇、H2和乙醛。乙醇在ZrO2催化剂上主要形成乙烯和CO,当催化剂引入Cu后,可以观察到明显的H2脱附峰,而且乙烯和CO脱附峰明显降低,说明Cu的引入促进了乙醇脱氢反应,抑制了其脱水反应。催化剂中引入K改性后,除了H2的脱附峰外,还观察到明显的甲醇和水脱附峰。ZrO2催化剂在低温区有一个乙醛脱附峰,而引入Cu和K后,催化剂表面观察到3个明显的乙醛脱附峰,分别位于低、中和高温区。对比发现,Cu的引入促进了乙醇脱氢形成乙醛过程,而K引入以后,虽然对乙醛脱附峰的种类没有明显的影响,但是K的添加使高温乙醛脱附峰向低温方向偏移,从381 ℃偏移到365 ℃,说明K的添加使乙醇容易脱氢转化为乙醛。另外,对比乙醛脱附峰强度发现,K的引入使中、高温乙醛脱附峰强度有所降低,说明乙醛脱附量略有下降,这可能是由于K改性CuZrO催化剂比表面积下降所致。
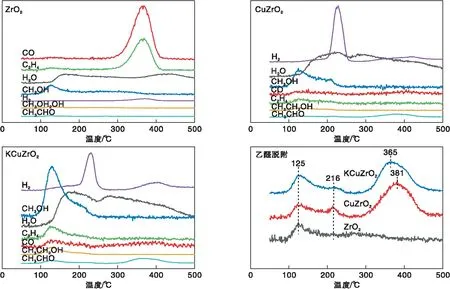
图6 不同催化剂的乙醇-TPSR谱图Figure 6 Ethanol-TPSR profiles of different catalysts
2.1.7 催化剂表面碱性
由于碱性中心对缩合反应有促进作用[34],为此,采用CO2-TPD对催化剂表面碱性进行考察,结果如图7所示。由图7可以看出,ZrO2催化剂有两个明显的CO2脱附峰,分别位于低温区(164 ℃)和中温区(416 ℃),归属为催化剂表面弱碱和中等强度碱性中心[35]。从不同CO2脱附峰面积可见,ZrO2表面碱性位以弱碱为主,中等强度碱性中心较少。Cu引入ZrO2中以后,催化剂表面可以观察到3个明显的CO2脱附峰,分别位于约128 ℃、195 ℃和300 ℃,其中128 ℃的脱附峰为催化剂表面物理吸附的CO2,吸附较弱。对比ZrO2和CuZrO2催化剂表面CO2脱附峰温和面积,Cu引入以后,催化剂表面弱碱中心强度有所增强,而中等碱性中心强度降低,同时,CuZrO2催化剂弱碱中心含量明显降低,而中等强度碱性位含量明显增加。催化剂进一步采用碱金属K改性后,除了145 ℃处的弱物理吸附峰之外,在215 ℃和400 ℃处出现两个明显的CO2脱附峰,分别对应弱碱中心和中等强度碱性中心,对比发现,K的添加使得催化剂表面弱碱和中等强度碱性位的碱性强度和数量都明显增加。
2.2 催化剂活性评价结果
表2为不同ZrO2基催化剂上乙醇制备正丁醇评价结果,反应温度320 ℃,反应压力5.0 MPa,载气空速2 000 h-1,乙醇进样量0.01 mL·(mLcat·h)-1。
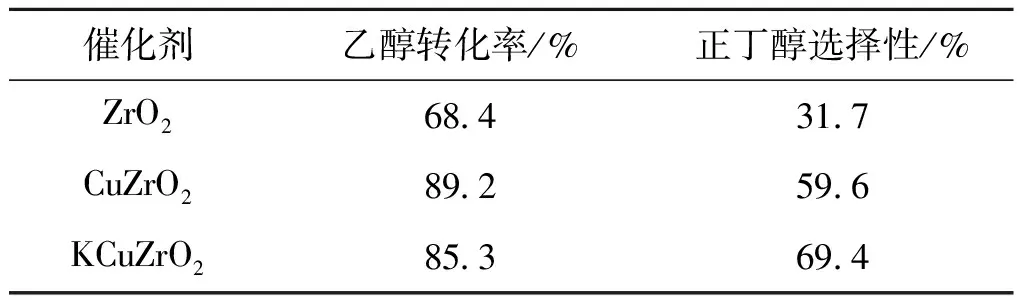
表2 ZrO2基催化剂催化乙醇合成正丁醇评价结果
由表2可以看出,ZrO2上乙醇转化率为68.4%,正丁醇选择性为31.7%;引入Cu后,乙醇转化率提高到89.2%,同时正丁醇选择性增加到59.6%;采用碱金属K改性后,乙醇转化率略有降低,为85.3%,而正丁醇选择性进一步提高到69.4%。
图8为反应温度对KCuZrO2催化剂上乙醇转化制正丁醇性能的影响。由图8可以看出,随着反应温度的增加,乙醇转化率逐渐增加,而正丁醇选择性呈现先增加后降低的趋势,在反应温度320 ℃时达到极大值,此时乙醇转化率为85.3%,正丁醇选择性为69.4%。
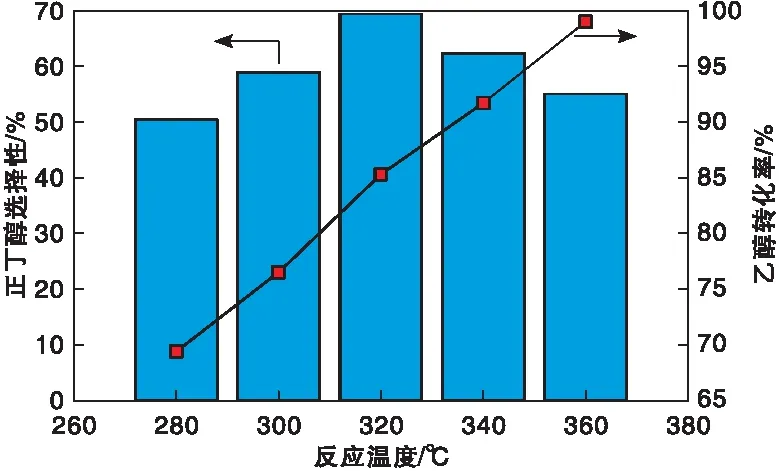
图8 反应温度对 KCuZrO2催化剂活性影响Figure 8 Effect of reaction temperature on KCuZrO2 catalyst activity
图9为KCuZrO2催化剂稳定性评价结果。由图9可知,催化剂在104 h内具有较好的稳定性,乙醇转化率约86%,而正丁醇选择性约70%。
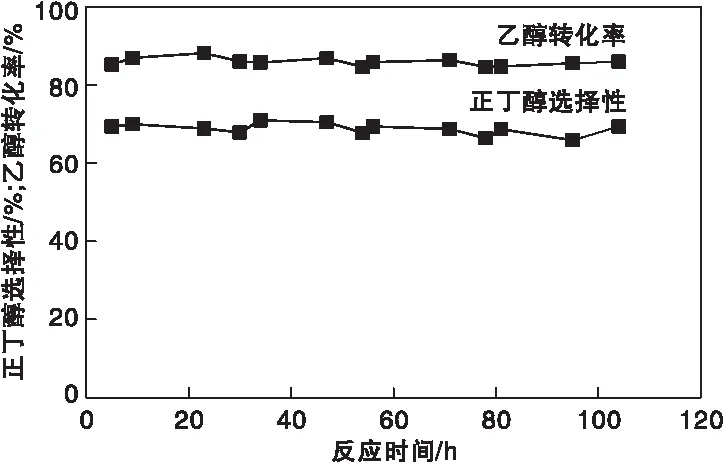
图9 KCuZrO2催化剂稳定性Figure 9 Stability of KCuZrO2 catalyst
从以上结果可见,Cu和K的添加对ZrO2催化剂织构性质、还原性能、电子环境以及催化性能的影响比较大,Cu和K的引入使ZrO2催化剂比表面积逐渐下降,但对其结构影响不大,仍以t-ZrO2为主。H2-TPR结果显示,K的添加不利于CuO的还原,这是由于K的引入使得Cu电子结合能降低,其周围电子云密度增加,不利于H2的解离吸附,CuO还原变得困难。乙醇-TPSR结果显示,Cu的引入明显促进了乙醇脱氢形成乙醛的能力,有利于目标产物的形成,而K的添加反而降低了乙醛脱附量,一方面可能是催化剂比表面积下降引起,另一方面,依据乙醇脱氢机理[36],乙醇的O—H 首先在Cu金属表面发生断裂,随后CH3CH2O—的α-C—H 键断裂生成乙醛,Cu电子结合能越高,其周围电子云密度越低,越有利于活化乙醇的O—H键,因此,K的引入降低了Cu电子结合能,使得Cu对乙醇脱氢能力有所减弱,乙醛脱附量略有降低,这也是为什么K的引入导致乙醇转化率略有降低的原因。
由于乙醇制备正丁醇过程需要不同的活性中心协同作用,乙醇脱氢形成乙醛后,需要在碱性中心的催化下缩合得到目标产物,而K的引入虽然不利于乙醇脱氢,但是K的添加增强了催化剂表面碱性强度,而且碱量也得到了明显的提升,对缩合反应有明显的促进作用。
从以上讨论可见,Cu和碱金属K的引入明显改善了ZrO2催化剂的乙醇脱氢性能和碱性,使得目标产物正丁醇的合成效率明显得到提升。
3 结 论
(1) 制备了ZrO2催化剂,采用Cu和碱金属K对其进行改性,并考察了不同催化剂在乙醇转化制备正丁醇反应中的催化性能。ZrO2催化剂上乙醇转化率和正丁醇选择性都较低,当催化剂中引入Cu后,乙醇转化率和正丁醇选择性都明显增加,进一步引入碱金属K改性后,乙醇转化率略有下降,而正丁醇选择性进一步提高。
(2) Cu的引入明显促进了乙醇脱氢性能,而K的引入提高了增强了催化剂表面碱性强度,提高了催化剂表面碱量,促进了缩合反应的进行,从而提高了正丁醇选择性。
(3) KCuZrO2催化剂在100 h反应过程中具有较好的稳定性。

