脑微出血相关危险因素分析及风险预测模型
宋彤彤,赵娜,陈竹,李芳
(锦州医科大学附属第一医院神经内科,辽宁 锦州 121000)
CMBs的发生是由于脑内微小血管淀粉样变性[1]或高血压性的小动脉病变[2]导致微小量出血后而产生的含铁血黄素沉积[3],是在出血和缺血双重机制作用下而产生的结果[4]。它在影像资料中是可见的,CMBs是CSVD主要表现当中的一个[5],它以微小出血量为特点,可以从磁共振T2加权像和磁敏感(susceptibility weighted imaging,SWI)成像上显像,在SWI常表现为低信号的,直径大小小于15 mm的,形状近似圆形的区域[6]。当前针对CMBs的产生原因以及后续治疗等许多方面还存在许多不同的意见,但是根据目前已有的研究结果发现空腹血糖、脂代谢异常、年龄、高血压病、肥胖、基因等因素或许与CMBs的发生有关[7-9],亦或是危险因素共同作用的结果。针对CMBs复杂的形成机制尚存在不同意见的情况,建立风险模型对CMBs的发生进行预测就显得尤为重要。利于早期分辨出暴露于CMBs危险因素的患者,对其进行早期干预,从而降低CMBs发生的可能性。
1 资料与方法
1.1 一般资料
1.1.1 对象
纳入对象为123例从2020年2月至2021年4月之间于我院神经内科就诊的CSVD患者,纳入标准:(1)年龄45~80岁;(2)具备头CT、头颅1.5T 磁共振(T1、T2、FLAIR、DWI+MRA+SWI)、颈部血管(包括颈动脉及椎动脉)二维彩色多普勒超声、实时三维心脏结构及血流+左心功能测定及心电图,以及各项血清学化验结果;(3)头颅1.5 T磁共振回报存在腔隙性脑梗死(lacunar cerebral infarction,LI)或脑白质疏松(leukoaraiosis,LA)。LI病灶表现为磁共振T1加权像低信号,在磁共振T2加权像和DWI、FLAIR表现为直径3~15 mm的周围高信号环;LA则为T2高信号,T1等信号或低信号的斑片状融合影[10];(4)头颅MRA回报颅内段血管轻度狭窄,颈部血管(包括颈动脉及椎动脉)二维彩色多普勒超声同样回报颅外段血管无严重狭窄;(5)心电图回报未见房颤,实时三维心脏结构及血流+左心功能测定回报未见附壁血栓;(6)经本院道德伦理委员会批准,患者或其家属签署知情同意书。因各种原因不能配合完善检查者不予纳入本研究。
1.1.2 方法
首先记录患者的相关信息,例如基本信息,脑出血史,既往TIA史、脑梗死史、空腹血糖、GHb、Hcy、血脂相关指标;影像学上是否存在LA、LI、CMBs及脑萎缩,MMSE评分,MTHFR基因型,与此同时完善头CT、各项头颅1.5T磁共振、颈部血管(包括颈动脉及椎动脉)二维彩色多普勒超声、实时三维心脏结构及血流+左心功能测定及心电图等各项检查。根据SWI有无CMBs,即是否存在直径小于10 mm的圆形低信号区,分为脑微出血组和对照组。CMBs的影像学检测则采用Siemens 1.5T磁共振机(西门子公司,德国),结果由2名专科医师采用盲法共同分析。在筛选出CMBs的独立危险因素后,通过分析对其进行赋值,制定风险预测模型来对CMBs的发生与否进行预测。
1.2 统计学方法
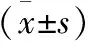
2 结 果
2.1 CMBs危险因素单因素分析
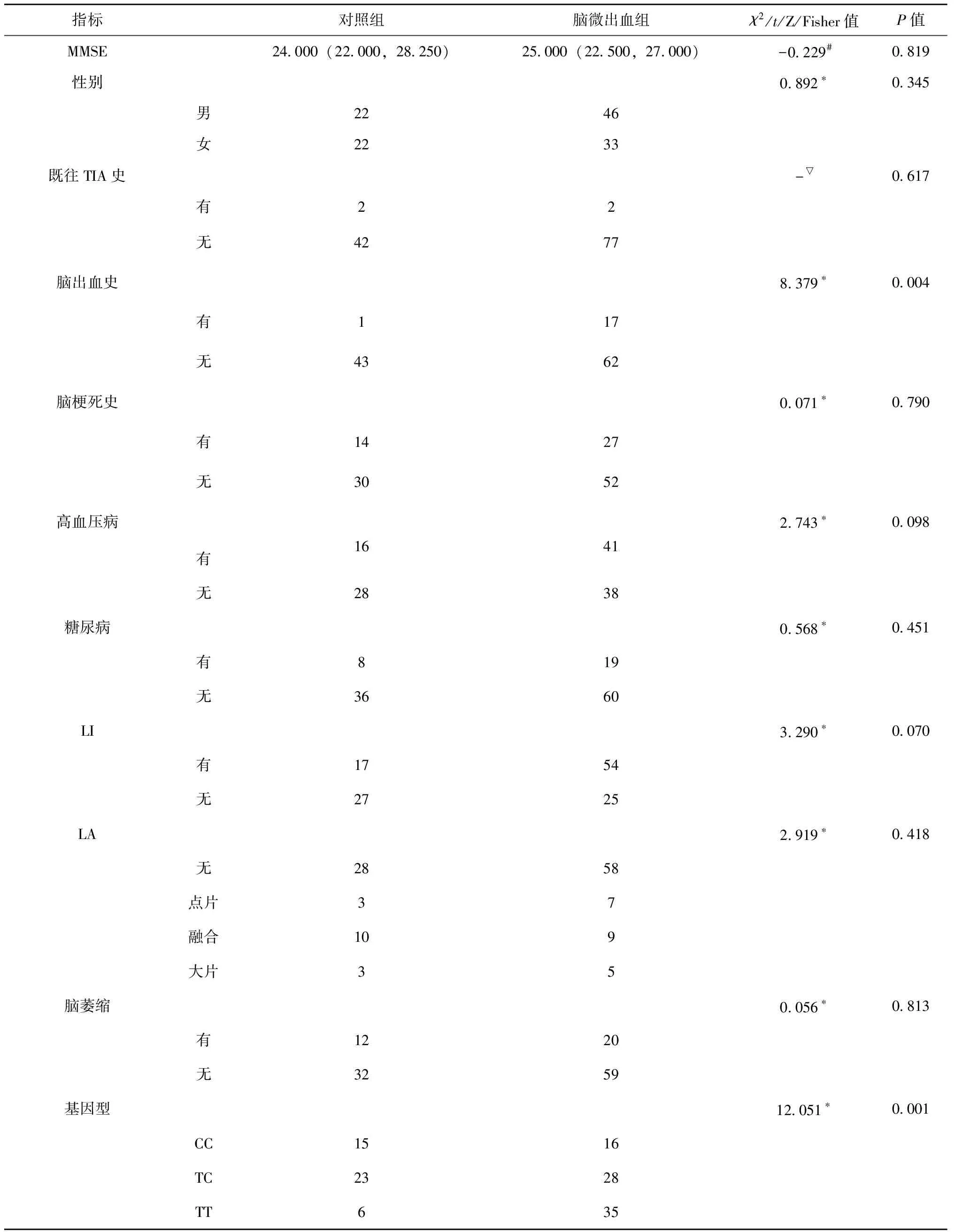
单因素分析结果表明,脑出血史(P=0.004)、Hcy(P=0.001)、GHb(P=0.005)、MTHFR基因型中CC型、TC型、TT型在两组间差异具有统计学意义(P<0.05),见表1。
2.2 CMBs危险因素的Logistic回归分析
将上述单因素分析P<0.05的指标纳入多因素分析中,其结果显示,脑出血史、Hcy、GHb、MTHFR基因TT型均对CMBs的发生有比较大的影响,见表2。脑出血史的OR值为7.356,即有此既往史的患者发生CMBs的风险是无脑出血史患者的7.356倍。TT型基因OR值为3.543,同样也可以认为TT型患者发生CMBs的可能性比CC基因型患者高3.543倍。
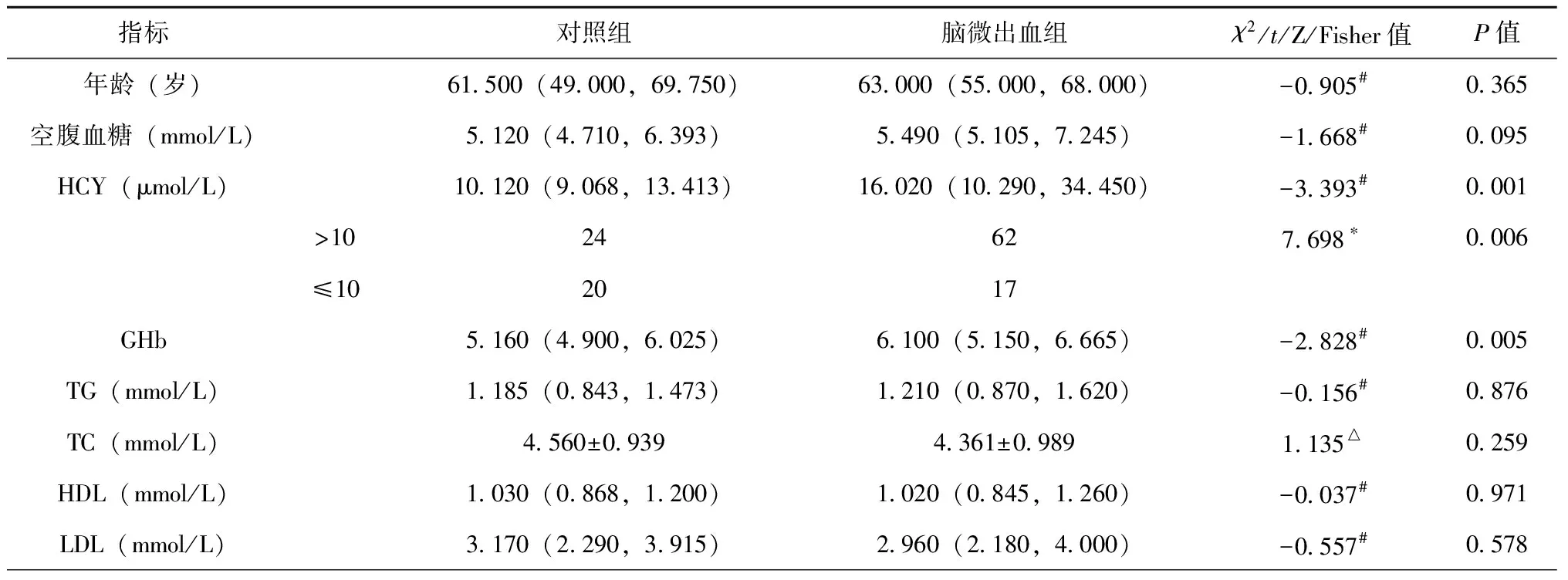
表1 CMBs 因素的单因素分析
续表
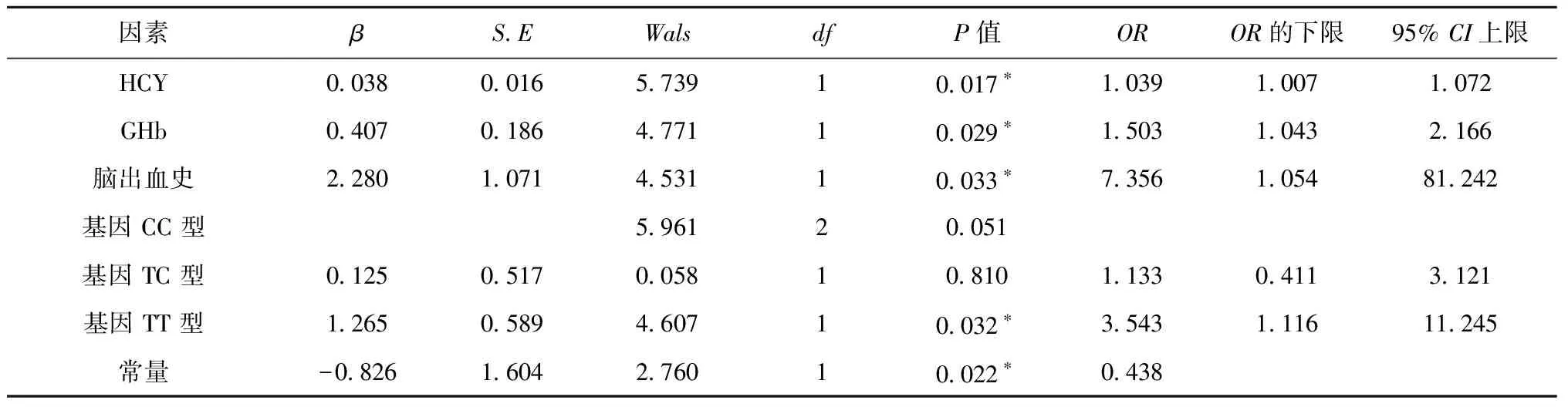
表2 多因素 Logistic 回归分析
2.3 制定CMBs风险预测模型
结合Logistic回归分析的回归系数,分别对不同的独立危险因素进行赋值,将最小的回归系数对应的独立危险因素Hcy(OR=1.039)赋值为1,其余各项回归系数除以最小回归系数所得结果四舍五入对其进行赋值,合计得CMBs的总风险得分为14,见表3。对纳入研究的123名患者进行风险预测评分,得到ROC曲线下面积为(0.678±0.053),P<0.001,ROC曲线下面积>0.5证明此模型具有一定的诊断价值。我们通过该曲线对预测模型的预测结果进行统计,选取优登指数最高的点作为划分风险高低的界值,见表4、图1。CMBs风险预测模型≥6分为高风险人群,在此截点时灵敏度为84.05%,特异度为68.64%,优登指数为52.69%。
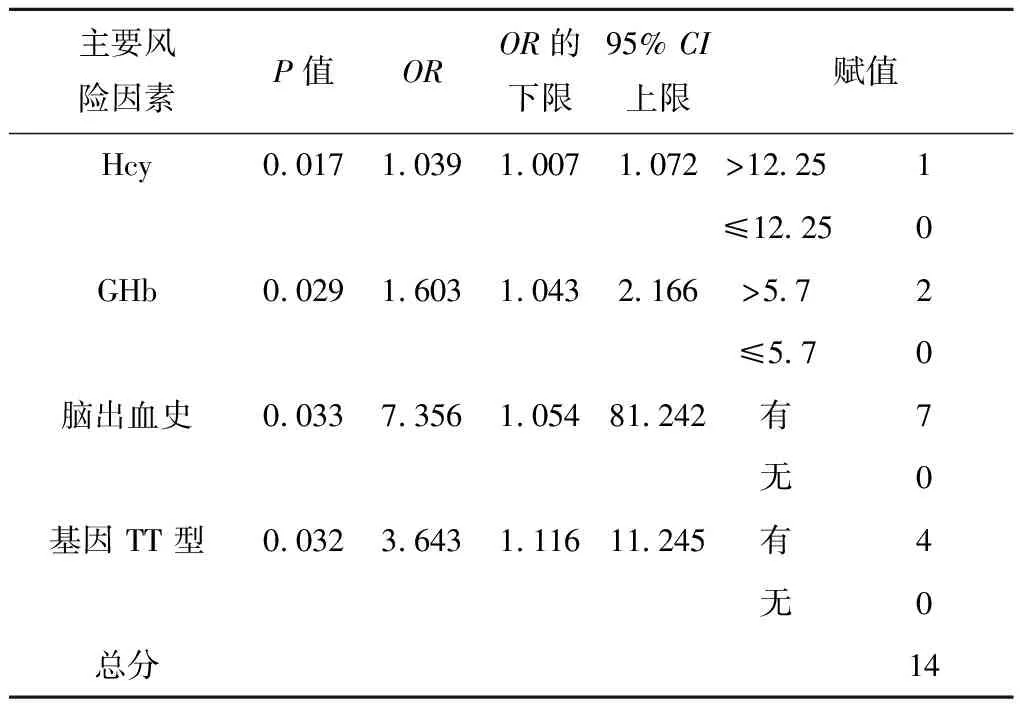
表3 Logistic回归分析CMBs主要风险因素及赋值
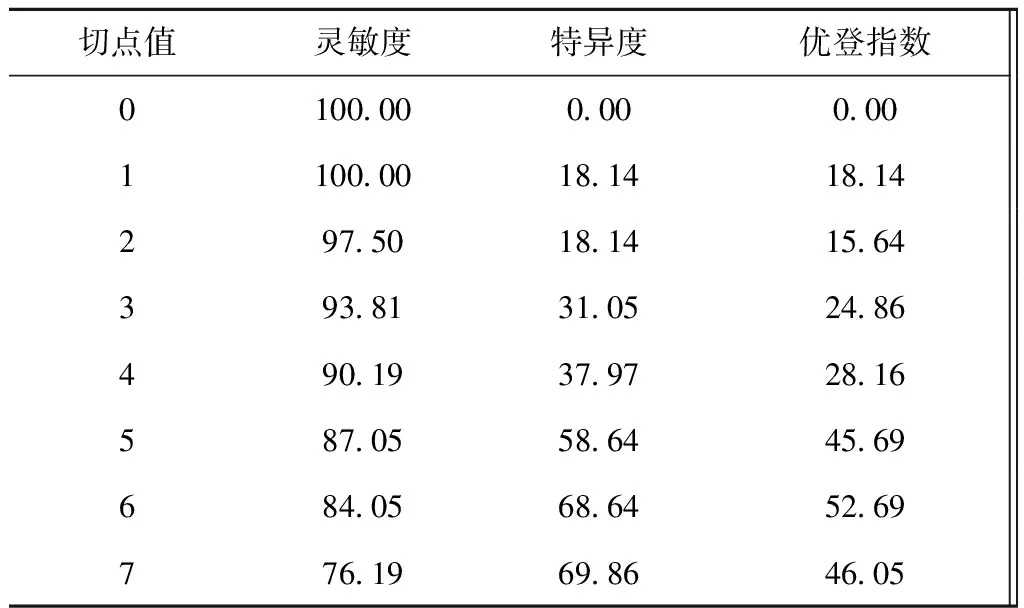
表4 CMBs风险预测模型在不同切点时的预测效果(%)
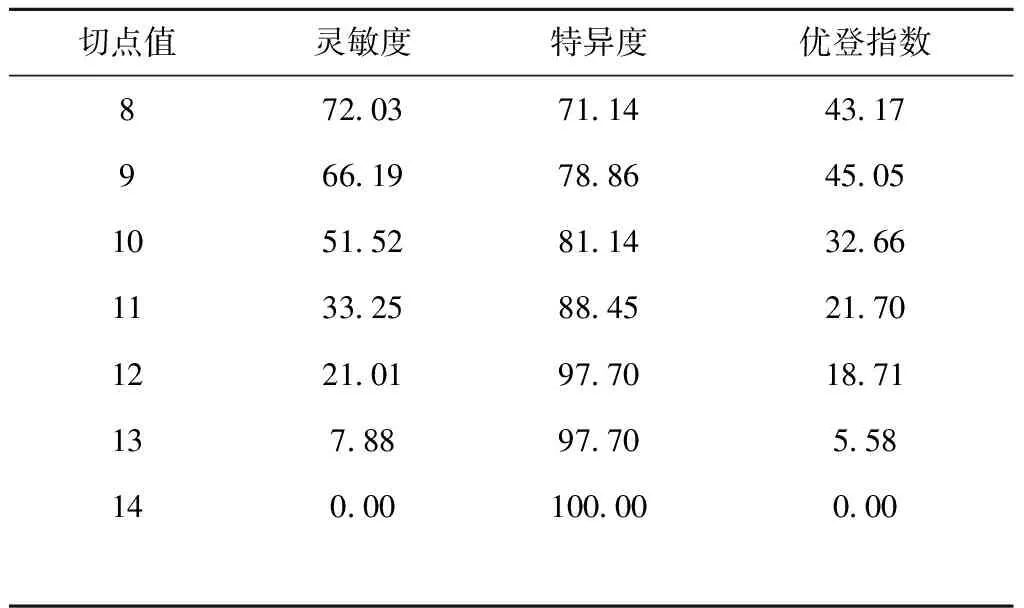
切点值灵敏度特异度优登指数872.0371.1443.17966.1978.8645.051051.5281.1432.661133.2588.4521.701221.0197.7018.71137.8897.705.58140.00100.000.00
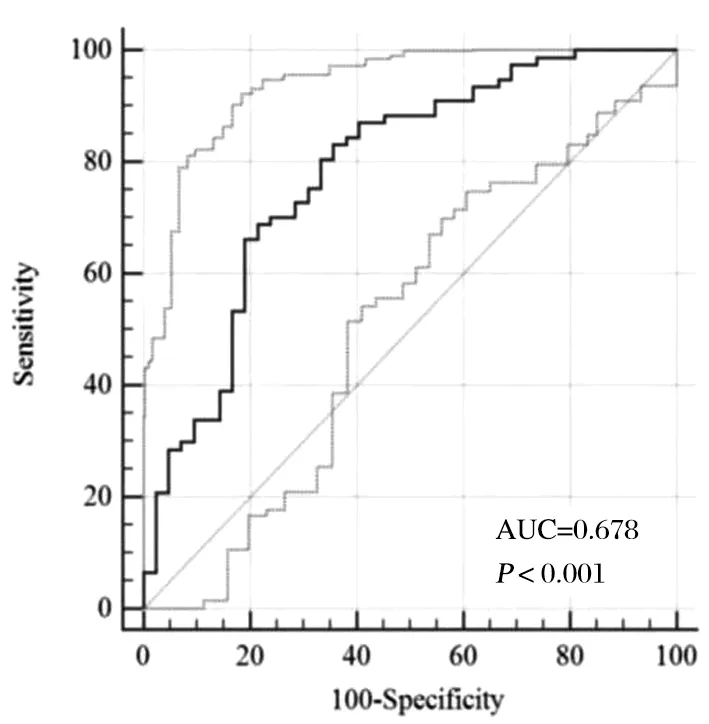
图1 CMBs风险预测模型的ROC曲线
3 讨 论
CMBs作为CSVD影像学的主要表现之一,常分布在深部脑区和皮层-皮层下分界处,本研究通过脑微出血组与对照组对比,筛选出Hcy、GHb、脑出血史及MTHFR基因型的TT型为CSVD患者发生CMBs的独立危险因素,同时制定风险预测模型对CMBs的发生进行预测。
既往有研究认为,CMBs的发病机制是与血管内皮损伤密切相关的[11-12],高水平Hcy也会导致内皮损伤。并且也有研究认为较高的Hcy水平与CMBs相关。此结论与本研究的结果基本上是一致的:Hcy是CMBs的独立危险因素。有相关文章发现在脑卒中的患者中,CMBs的发生与患者血糖的高低有关,而深部或幕下的CMBs与各种代谢紊乱相关[13]。本研究中空腹血糖未得到阳性结果,其原因或许与患者平素口服相关药物有关。但考虑到GHb可以反映患者一段时间内的血糖情况,我们将其作为危险因素纳入研究,或许比空腹血糖更具有代表性,结果也得到了GHb是CMBs独立危险因素的结论。有研究表明MTHFR基因型与Hcy相关,并证明血浆Hcy水平在TT基因型中最高,在TC基因型中最低,而在CC基因型则处于中间位置[14-15];但是该基因型是否与CMBs的发生相关尚存在争议,而本研究的结果表明:MTHFR基因TT型患者发生CMBs的风险是CC型患者的3.543倍,且TT基因型为CMBs的独立危险因素。另外,研究表明CMBs与发生脑出血的概率呈正相关,其实CMBs的存在本身就代表着有出血的可能性[16],CMBs数量的增多同样会明显增加脑出血的风险,甚至可能影响预后[17]。本研究结果证实了此观点,脑出血史作为CMBs的独立危险因素,有此既往史的患者发生CMBs的风险是无脑出血史患者的7.356倍。
通过本研究制定的风险预测模型共14分,且将优登指数最高的6分作为划分风险高低的截点,具有较为可观的可信度。但此模型能否准确预测CMBs的发生,仍需要继续进行大量的临床研究验证。且研究中仍存在一些不足之处,首先是纳入研究中的危险因素尚不完全,一些我们无法实现观察的暴露因素未纳入本研究;也未根据脑微出血组中CMBs发生位置[18]的不同进行分别讨论;最后,有一部分受试者服用的降血小板药物和降压药都有可能会对该研究结果产生一定的影响。
综上所述,可以通过本研究得出Hcy、脑出血史、GHb,还有MTHFR基因型中的TT型这四种可增加CMBs的患病风险,均为CMBs的独立危险因素。制定的风险预测模型中将≥6分认为是CMBs的高风险人群,具有较为可观的灵敏度和特异度,能够早期辨别患者是否暴露在CMBs的危险因素之中,以便建立早期的识别体系,提早发现并对其进行干预,以达到阻止或延缓疾病发生的目标。

