长链非编码RNA脑源性神经营养因子反义RNA靶向微小RNA-495-3p调控脂多糖诱导的大鼠肺泡巨噬细胞凋亡和炎症反应
高炜,张莉,金培田
慢性阻塞性肺疾病(以下简称“慢阻肺”)是呼吸系统常见的慢性气道炎症反应疾病,巨噬细胞参与慢阻肺的发生发展[1],巨噬细胞的吞噬功能受损可导致慢阻肺病人病情加重,因此调控炎症反应和抑制肺泡巨噬细胞凋亡是治疗慢阻肺的重要机制[2-3]。研究发现,长链非编码RNA(lncRNA)在多种疾病发生发展中具有重要作用,其中包含慢阻肺,有望成为诊断和治疗慢阻肺的靶点[4]。脑源性神经营养因子反义RNA(brain-derived neurotrophic factor antisense,BDNF-AS)是一种lncRNA,研究发现lncRNA BDNF-AS在MPTP诱导的帕金森细胞模型中上调表达,敲除BDNF-AS通过调节微小RNA(miR)-125b-5p提高SH-SY5Y细胞的活力,抑制MPTP诱导的帕金森细胞自噬和凋亡[5]。抑制ln‐cRNA BDNF-AS可通过miR-130b-5p/PRDM5轴抑制急性脊髓损伤中的神经细胞凋亡[6]。研究表明miRNA也参与调控慢阻肺的发生发展[7]。过表达miR-495-3p可通过靶向下调TLR4的表达,抑制核因子-κB(NF-κB)通路,进而抑制炎性因子的产生,促进人牙周膜细胞增殖[8]。miR-495-3p过表达通过抑制鞘氨醇-1磷酸受体3(shingosine-1 phosphate re‐ceptor 3,S1PR3)并抑制上皮-间质转化过程,从而减轻了辐射引起的肺纤维化[9]。然而lncRNA BDNFAS和miR-495-3p对肺泡巨噬细胞凋亡和炎症反应的影响及其机制还尚未可知,遂于2018年12月至2019年12月通过脂多糖(lipopolysaccharide,LPS)诱导大鼠肺泡巨噬细胞,研究lncRNA BDNF-AS和miR-495-3p对肺泡巨噬细胞凋亡和炎症反应的影响及lncRNA BDNF-AS是否通过靶向调控miR-495-3p的表达影响其巨噬细胞凋亡和炎症反应。
1 材料与方法
1.1材料大鼠肺泡巨噬细胞NR8383(货号XYR005)购自无锡欣润生物公司;胎牛血清、Ham's F12k培养基购自上海慧颖生物公司;LPS购自北京驰明瑞生公司;RNA提取试剂盒、反转录试剂盒、荧光定量试剂盒购自上海抚生实业公司;酶联免疫吸附测定(ELISA)试剂盒购自南京森贝伽生物公司;二辛可宁酸(bicinchoninic acid,BCA)试剂盒、RIPA蛋白裂解液购自爱必信(上海)生物公司;B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)、Bcl-2相关X蛋白(Bcl-2-associated X protein,Bax)一抗购自青岛捷世康生物公司;兔抗山羊IgG-HRP购自南京信帆生物公司;膜联蛋白V-异硫氰酸荧光素(Annexin VFITC)、碘化丙啶(PI)试剂盒、双荧光素酶报告基因检测试剂盒购自北京原平皓生物公司。
1.2细胞处理与分组大鼠肺泡巨噬细胞NR8383用含20%胎牛血清的Ham's F12k培养基于37℃、5%二氧化碳条件下培养,取对数期细胞用于实验。将细胞分为Con组:细胞常规培养,LPS组:细胞给予LPS(1 mg/L)处理12 h。将BDNF-AS小分子干扰RNA(si-BDNF-AS)及其阴性对照(si-NC)、miR-495-3p及其阴性对照(miR-NC)转染至NR8383细胞中再用1 mg/L的LPS处理,记为LPS+si-BDNF-AS组、LPS+si-NC组、LPS+miR-495-3p组、LPS+miR-NC组;将si-BDNF-AS分别与anti-miR-NC、anti-miR-495-3p共转染至NR8383细胞中,再用1 mg/L的LPS处理,记为LPS+si-BDNF-AS+anti-miR-NC组、LPS+si-BDNF-AS+anti-miR-495-3p组。将BDNF-AS过表达质粒(pcDNA-BDNF-AS)、空载体质粒(pcDNA)、BDNF-AS小干扰RNA(si-BDNF-AS)、小干扰RNA阴性对照(si-NC)转染NR8383细胞,记为pcDNABDNF-AS组、pcDNA组、si-BDNF-AS组、si-NC组。
1.3实时荧光定量PCR检测lncRNABDNF-AS和miR-495-3p的表达水平各组细胞培养24 h,提取总RNA,将RNA反转录成互补DNA(cDNA),按照荧光定量试剂盒使用说明进行PCR,每个样品设3个重复,循环条件为95℃5 min,95℃30 s,60℃30 s;72℃30 s,共40个循环;60℃延长5 min。相对表达量用2−ΔΔCt法计算。lncRNA BDNF-AS和miR-495-3p分别以甘油醛-3-磷酸脱氢酶(GAPDH)和U6为内参,lncRNA BDNF-AS正向引物序列:5'-TACCA‐CAAGGTACCAACCATATATG-3',反向引物序列:5'-CATGTGGTTCTGTTTCAATGCCC-3';GAPDH正 向引物序列:5'-TGTTGCCATCAATCACCCCTT-3',反向引物序列:5'-CTCCACGACGTACTCAGCG-3';miR-495-3p正向引物序列:5'-GCGGAAACAAA‐CATGGTGCA-3',反向引物序列:5'-CTTGCTTCG‐GCATCACA-3';U6正向引物序列:5'-CGCTTCG‐GCAGCACATATACTA-3',反向引物序列:5'-CGCTTCACGAATTTGCGTGTCA-3';引物由上海生工生物工程公司合成。
1.4ELISA检测IL-1β、TNF-α水平各组细胞培养24 h后取上清,具体按照试剂盒操作进行检测。
1.5流式细胞术检测细胞凋亡将0.25%蛋白酶消化的细胞,接种到无胎牛血清培养基过夜,24 h后收集细胞,每组选择3个样本,PBS洗涤1次,100μL接种于5 mL流式试管中,5μL的Annexin V-FITC与5μL PI混合后染色,无光条件下,孵育15 min后注入400μL结合缓冲液混匀,予以洗涤,后采用流式细胞仪分析细胞凋亡程度。
1.6蛋白质印迹法检测Bcl-2、Bax蛋白表达取各组细胞,提取总蛋白后用BCA法进行定量分析,首先进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDSPAGE),电泳完成后经电转将蛋白转移至甲醇活化的聚偏二氟乙烯(PVDF)上,用5%脱脂奶粉室温封闭90 min,加入稀释的Bcl-2、Bax一抗(1∶600),4℃孵育过夜,洗膜后加入二抗(1∶1 000),室温孵育2h,洗膜、显影、定影后,用ECL荧光试剂盒测定结果,拍照并进行蛋白条带灰度值分析,然后计算与GAPDH比值求得Bcl-2、Bax蛋白的相对表达含量。
1.7荧光素酶报告实验检测BDNF-AS对miR-495-3p的靶向调控利用点突变技术构建BDNFAS野生型(WT)和突变型(MUT)基因靶点荧光素酶表达载体后,分别将野生型和突变型BDNF-AS3′非翻译区(3′-UTR)插入LipofectamineTM2000载体,然后按照转染试剂说明书将其分别与miR-NC和miR-495-3p共转染至NR8383细胞中,转染48 h后,严格按照双荧光素酶报告基因检测试剂盒操作步骤检测各组细胞荧光素酶活性。将pcDNA、pcDNABDNF-AS、si-NC、si-BDNF-AS转染至NR8383细胞中,按照“1.3”中方法检测miR-495-3p表达水平。
1.8统计学方法采用SPSS20.0软件进行统计学分析,计量资料以±s表示,两组间比较行成组t检验,多组间比较采用单因素方差分析+LSD法,以P<0.05为差异有统计学意义。
2 结果
2.1lncRNABDNF-AS和miR-495-3p在LPS刺激的大鼠肺泡巨噬细胞中的表达与Con组相比,LPS组大鼠肺泡巨噬细胞中BDNF-AS表达水平升高[(1.00±0.06)比(3.41±0.31),t=22.90,P<0.001],miR-495-3p表达水平降低[(1.02±0.07)比(0.47±0.04),t=20.47,P<0.001]。
2.2抑制lncRNABDNF-AS表达对LPS诱导的大鼠肺泡巨噬细胞凋亡和炎症反应的影响与Con组相比,LPS组大鼠肺泡巨噬细胞中BDNF-AS表达水平显著升高,IL-1β、TNF-α水平升高,细胞凋亡率升高,Bax表达水平显著升高,Bcl-2表达水平降低;与LPS+si-NC组相比,LPS+si-BDNF-AS组大鼠肺泡巨噬细胞中BDNF-AS表达水平降低,IL-1β、TNF-α水平降低,细胞凋亡率降低,Bax表达水平降低,Bcl-2表达水平升高,均差异有统计学意义(P<0.05)。见图1,表1。
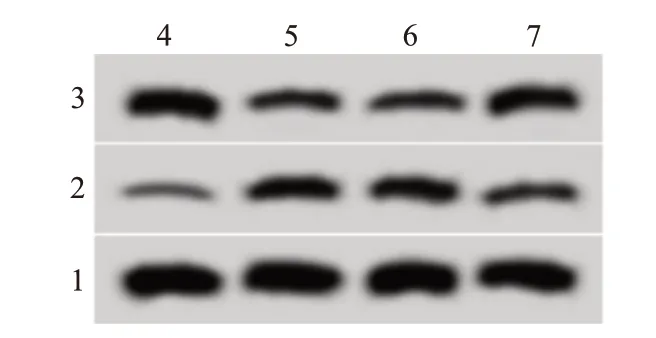
图1 抑制脑源性神经营养因子反义RNA(BDNF-AS)表达对脂多糖(LPS)诱导的大鼠肺泡巨噬细胞凋亡相关蛋白表达的影响
表1 抑制脑源性神经营养因子反义RNA(BDNF-AS)表达对脂多糖(LPS)诱导的大鼠肺泡巨噬细胞凋亡和炎症反应的影响/±s

表1 抑制脑源性神经营养因子反义RNA(BDNF-AS)表达对脂多糖(LPS)诱导的大鼠肺泡巨噬细胞凋亡和炎症反应的影响/±s
注:Bax为B细胞淋巴瘤-2相关X蛋白,Bcl-2为B细胞淋巴瘤-2,IL-1β为白细胞介素-1β,TNF-α为肿瘤坏死因子-α。①与Con组比较,P<0.05。②与LPS+si-NC组比较,P<0.05。
组别Con LPS LPS+si-NC LPS+si-BDNF-AS F值P值重复次数3 3 3 3 Bax 0.78±0.07 0.32±0.03①0.31±0.03 0.69±0.06②210.29<0.001 Bcl-2蛋白0.20±0.02 0.61±0.06①0.62±0.06 0.29±0.03②199.06<0.001 BDNF-AS 1.01±0.08 3.15±0.31①3.18±0.29 1.62±0.16②204.09<0.001 IL-1β/(ng/L)22.14±2.25 513.20±41.22①526.14±46.87 132.41±12.58②596.80<0.001 TNF-α/(ng/L)184.33±18.65 1 125.65±110.36①1 203.33±185.22 354.26±21.58②207.74<0.001凋亡率/%8.11±0.81 36.22±3.21①38.14±3.71 12.03±1.25②339.86<0.001
2.3miR-495-3p过表达对LPS诱导的大鼠肺泡巨噬细胞凋亡和炎症反应的影响结果表明,与LPS+miR-NC组相比,LPS+miR-495-3p组大鼠肺泡巨噬细胞中miR-495-3p表达水平升高,IL-1β、TNF-α水平降低,细胞凋亡率降低,Bax表达水平降低,Bcl-2表达水平升高,均差异有统计学意义(P<0.05)。见图2,表2。
表2 miR-495-3p过表达对脂多糖(LPS)诱导的大鼠肺泡巨噬细胞凋亡和炎症反应的影响/±s

表2 miR-495-3p过表达对脂多糖(LPS)诱导的大鼠肺泡巨噬细胞凋亡和炎症反应的影响/±s
注:Bax为B细胞淋巴瘤-2相关X蛋白,Bcl-2为B细胞淋巴瘤-2,IL-1β为白细胞介素-1β,TNF-α为肿瘤坏死因子-α。①与Con组比较,P<0.05。②与LPS+miR-NC组比较,P<0.05。
组别Con LPS LPS+miR-NC LPS+miR-495-3p F值P值重复次数3 3 3 3 Bax 0.77±0.07 0.31±0.03①0.29±0.03 0.63±0.06②198.06<0.001 Bcl-2蛋白0.21±0.02 0.60±0.06①0.61±0.06 0.33±0.03②168.67<0.001 miR-495-3p 1.00±0.06 0.42±0.04①0.40±0.03 0.78±0.07②277.96<0.001 IL-1β/(ng/L)26.34±2.61 524.33±49.65①536.14±51.02 175.98±18.41②433.04<0.001 TNF-α/(ng/L)193.22±19.24 1 232.11±121.54①1 248.65±115.28 628.47±53.69②300.05<0.001凋亡率/%7.25±0.73 34.58±3.41①36.98±3.61 14.87±1.42②283.57<0.001
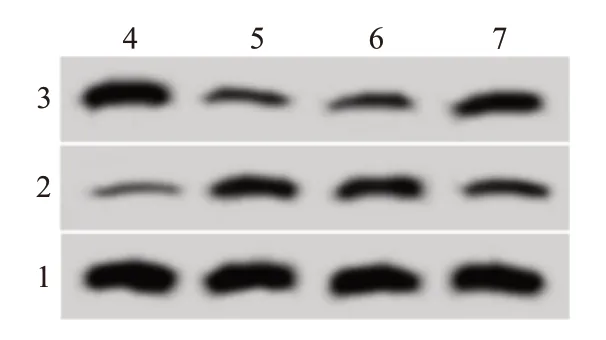
图2 miR-495-3p过表达对脂多糖(LPS)诱导的大鼠肺泡巨噬细胞凋亡相关蛋白的表达的影响
2.4lncRNABDNF-AS调控miR-495-3p表达(LncBasePredictedv.2)图3显示lncRNA BDNFAS、miR-495-3p具有相关结合点位。荧光素酶结果表明,同miR-NC组比较,miR-495-3p组转染WTBDNF-AS活性下降[(1.00±0.05)比(0.38±0.04),t=25.79,P<0.001];与miR-NC组比较,miR-495-3p组转染MUT-BDNF-AS差异无统计学意义[(1.02±0.07)比(1.01±0.06),t=0.32,P=0.749]。pcDNA组(0.99±0.08)、pcDNA-BDNF-AS组(0.51±0.05)、si-NC组(1.00±0.07)及si-BDNF-AS组(2.98±0.28)的miR-495-3p表达水平比较,F=470.24,P<0.001;pcDNABDNF-AS组比pcDNA组低(P<0.05),si-BDNF-AS组比si-NC组高(P<0.05)。
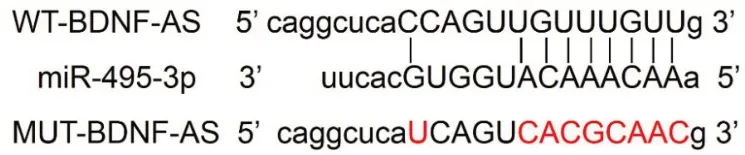
图3 脑源性神经营养因子反义RNA(BDNF-AS)的序列中含有与miR-495-3p互补的核苷酸序列
2.5沉默miR-495-3p抑制lncRNABDNF-AS表达对细胞活性及炎症反应的影响与LPS+si-BDNFAS+anti-miR-NC组相比,LPS+si-BDNF-AS+antimiR-495-3p组miR-495-3p降低,IL-1β、TNF-α升高,细胞凋亡率升高,Bax表达水平升高,Bcl-2表达水平降低,均差异有统计学意义(P<0.05)。见表3。
表3 干扰miR-495-3p表达逆转了抑制脑源性神经营养因子反义RNA(BDNF-AS)表达对脂多糖(LPS)诱导的大鼠肺泡巨噬细胞凋亡和炎症反应的作用/±s
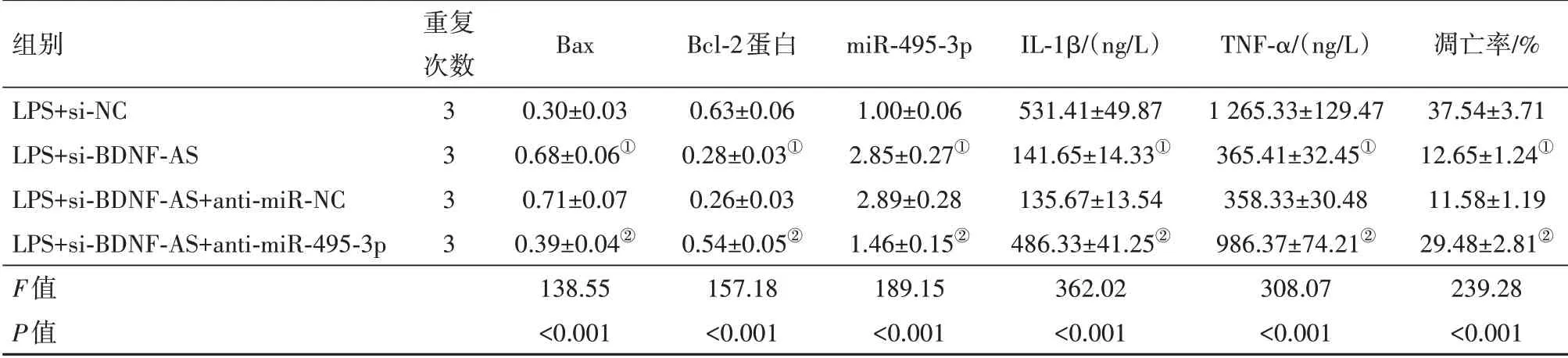
表3 干扰miR-495-3p表达逆转了抑制脑源性神经营养因子反义RNA(BDNF-AS)表达对脂多糖(LPS)诱导的大鼠肺泡巨噬细胞凋亡和炎症反应的作用/±s
注:Bax为B细胞淋巴瘤-2相关X蛋白,Bcl-2为B细胞淋巴瘤-2,IL-1β为白细胞介素-1β,TNF-α为肿瘤坏死因子-α。①与LPS+si-NC组比较,P<0.05。②与LPS+si-BDNF-AS+anti-miR-NC组比较,P<0.05。
组别LPS+si-NC LPS+si-BDNF-AS LPS+si-BDNF-AS+anti-miR-NC LPS+si-BDNF-AS+anti-miR-495-3p F值P值重复次数3 3 3 3 Bax 0.30±0.03 0.68±0.06①0.71±0.07 0.39±0.04②138.55<0.001 Bcl-2蛋白0.63±0.06 0.28±0.03①0.26±0.03 0.54±0.05②157.18<0.001 miR-495-3p 1.00±0.06 2.85±0.27①2.89±0.28 1.46±0.15②189.15<0.001 IL-1β/(ng/L)531.41±49.87 141.65±14.33①135.67±13.54 486.33±41.25②362.02<0.001 TNF-α/(ng/L)1 265.33±129.47 365.41±32.45①358.33±30.48 986.37±74.21②308.07<0.001凋亡率/%37.54±3.71 12.65±1.24①11.58±1.19 29.48±2.81②239.28<0.001
3 讨论
研究表明lncRNA在细胞炎症、免疫等方面具有重要作用,在慢阻肺中异常表达的lncRNA与慢阻肺发病机制密切相关,有望成为慢阻肺发生、发展的早期生物学标志物及治疗的潜在靶点[10]。研究报道抑制lncRNA BDNF-AS可挽救缺氧/复氧受损鼠心肌细胞的细胞死亡和凋亡[11]。抑制lncRNA BDNF-AS减弱了缺氧/复氧诱导的神经细胞凋亡[12]。沉默BDNF-AS增加了Aβ25-35诱导的PC12细胞的活力,并抑制细胞凋亡和氧化应激[13],该实验通过LPS诱导大鼠肺泡巨噬细胞的结果显示,IL-1β、TNF-α、Bax增加,Bcl-2降低,细胞的凋亡表达增加,且BDNF-AS高表达,说明LPS可诱导大鼠肺泡巨噬细胞凋亡和炎症反应。该实验进一步抑制BDNFAS表达,结果显示IL-1β、TNF-α、Bax降低,Bcl-2升高,细胞凋亡表达降低,表示降低BDNF-AS对抑制LPS诱导的大鼠肺泡巨噬细胞凋亡和炎症反应具有一定作用,且研究报道慢阻肺大鼠外周血压炎性因子IL-1β、IL-6、TNF-α水平升高[14],提示BDNF-AS可能参与慢阻肺进展。
研究表明慢阻肺主要出现慢性炎症反应,而miRNA与炎性疾病相关,参与慢阻肺的发生发展[15-16]。研究发现LPS诱导的牙周膜细胞中miR-495-3p下调表达[17]。miR-495-3p下调表达可能加剧LPS处理的RAW264.7细胞的炎症反应[18]。miR-495-3p在缺血再灌注损伤小鼠模型和过氧化氢诱导的H9C2细胞损伤中表达降低,过表达miR-495-3p可抑制TNF-α、IL-1β和IL-18的表达[19]。该实验结果显示,LPS诱导的大鼠肺泡巨噬细胞中miR-495-3p也低表达,过表达miR-495-3p后,IL-1β、TNF-α、Bax降低,Bcl-2升高,细胞凋亡降低。表示miR-495-3p的过度反应对降低LPS诱导的大鼠肺泡巨噬细胞凋亡和炎症反应具有一定影响。且该实验还发现BDNF-AS靶向调控miR-495-3p,抑制miR-495-3p表达逆转了降低了炎性的抑制效能。说明lncRNA BDNF-AS对抑制大鼠肺泡巨噬细胞凋亡和炎症反应具有一定作用。
综上所述,lncRNA BDNF-AS可通过miR-495-3p干预LPS诱导大鼠的肺泡巨噬细胞凋亡和炎症反应。

