肝细胞癌的细胞分裂周期基因20表达与临床病理特征关系及对预后的影响
宋应周,孟松峰
肝细胞癌在全球肝脏恶性肿瘤中发病率呈上升趋势,已成为癌症死亡的第二大诱因[1]。乙型肝炎病毒或丙型肝炎病毒慢性感染、肝硬化、酒精性肝病和黄曲霉毒素等造成了肝细胞癌的高发病率[2-4]。然而,促进肝癌发病机制仍不清楚。在肝细胞癌发生过程中,细胞周期检查点的改变可能与癌症形成密切相关[5]。细胞分裂周期基因20(CDC20)是细胞周期检查点的调节剂,与细胞周期后期中复合物/环体相互作用的调节蛋白和有丝分裂相关[6]。CDC20可与APC结合并在有丝分裂和G1期激活细胞周期蛋白的泛素化活性,促进细胞增殖[7]。CDC20可通过调节细胞周期、促进细胞凋亡,抑制恶性转化[8]。研究表明,多种癌症中CDC20的高表达,与肿瘤的增殖、侵袭及不良预后有关[9-12]。然而,CDC20在肝细胞癌中的研究较少,该研究通过检测肝细胞癌组织中CDC20的水平,分析CDC20的表达与病人临床病理特征的关系及对预后的影响,为肝细胞癌的预后判断提供参考。
1 资料与方法
1.1一般资料收集2016年5月至2017年12月在商丘市第三人民医院行手术治疗的肝细胞癌病人146例,男115例,女31例,年龄范围为38~62岁,收集病人的临床资料。收集手术切除的肝细胞癌组织及对应的癌旁组织,放置于−80℃超低温冰箱中。术后采用电话的方式定期随访,最短随访时间5个月,最长随访时间36个月,随访截止日期为2020年12月1日,146例的临床资料及随访资料完整。该研究经商丘市第三人民医院伦理委员会批准(20160412),病人或其近亲属同意并签署知情同意书。
1.2研究方法
1.2.1实时荧光定量逆转录聚合酶链反应(qRTPCR) qRT-PCR检测肝细胞癌组织中CDC20mRNA的表达。组织中的总RNA根据Trizol试剂盒进行提取。提取的RNA逆转录为互补DNA(cD‐NA),进行实时荧光定量PCR。CDC20正向引物序列5′-TCGAAGTCACTCGGTAGCGT-3′,反向引物序列5′-GATCCTGCATACTGCTTGCA-3′;U6正向引物序 列5′-GGCCTCATCCTCATCATGGCAGUAG-3′,反向引物序列5′-AGCCAGATGCCTAGCGACGTGC‐GC-3′。总反应体系为20μL,反应条件:95℃预变性5 min,95℃变性30 s,60℃退火30 s,72℃延伸30 s,40个循环。以管家基因U6 mRNA水平作为内参照,采用2−ΔΔCt法计算CDC20 mRNA的相对表达水平。
1.2.2蛋白质印迹法 蛋白质印迹法检测肝细胞癌组织中CDC20的表达。取组织中的总蛋白,根据BCA蛋白定量试剂盒取30μg的蛋白,行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),将电泳凝胶上的蛋白湿转至聚偏二氟乙烯(PVDF)膜上,PVDF膜放置含有1%BSA的盒子中,孵育2 h、之后经过一抗孵育(1∶1 000稀释,4℃过夜)、TBST洗涤3次、二抗孵育(1∶4 000稀释,室温1 h)、TBST洗涤3次后,在PVDF膜上滴加适量化学发光显色液,在凝胶成像系统中拍照,根据灰度值估测CDC20蛋白表达水平。
1.2.3免疫组织化学实验 免疫组织化学检测肝细胞癌组织中CDC20的表达。切制冷冻切片,经过脱蜡和梯度乙醇水化处理后,利用PV6000法染色,加入3%过氧化氢灭活内源性过氧化物酶。置于修复液中,加热行抗原进行修复,然后放置室温自然冷却。经封闭后,滴加一抗(1∶200),置于4℃冰箱孵育过夜。利用磷酸缓冲盐溶液(PBS)冲洗,滴加相应种属二抗(1∶400),室温下孵育60 min,并用PBS进行3遍冲洗。滴加新鲜配制的显色液,利用苏木素染料复染,中性树胶封固,最后置于显微镜下观察。染色强度评分:强阳性、中等阳性、弱阳性和阴性评分分别为3分、2分、1分和0分,阳性细胞数的评分:>75%~100%、>50%~75%、>25%~50%、5%~25%和<5%评分分别为4分、3分、2分、1分和0分,染色强度评分和阳性细胞数的评分的乘积即为总分,0~7分为低水平,8~12分为高水平。
1.3统计学方法应用SPSS 21.0软件行统计分析。计量资料以±s表示,组间比较采用配对t检验;计数资料以例(%)表示,组间比较采用χ2检验,多组间的两两比较检验水准α=0.016;采用Kaplan-Meier法绘制疾病无进展生存率和总生存率曲线,log-rank检验比较不同组间的生存率。以P<0.05为差异有统计学意义。
2 结果
2.1qRT-PCR检测肝细胞癌组织中CDC20mRNA的表达CDC20 mRNA在肝细胞癌组织表达水平(2.33±0.67)高于对应的癌旁组织(0.97±0.29)(t=5.95,P<0.001)。
2.2蛋白质印迹法检测肝细胞癌组织中CDC20的表达CDC20蛋白在肝细胞癌组织中相对表达水平(0.91±0.05)高于对应的癌旁组织(0.14±0.05)(t=34.30,P<0.001)。
2.3免疫组织化学检测肝细胞癌组织中CDC20的表达CDC20在肝细胞癌阳性表达率(77.4%,113/146)高于对应癌旁组织(8.2%,12/146),差异有统计学意义(χ2=142.69,P<0.001)。见图1(仅展示3例病人的结果)。
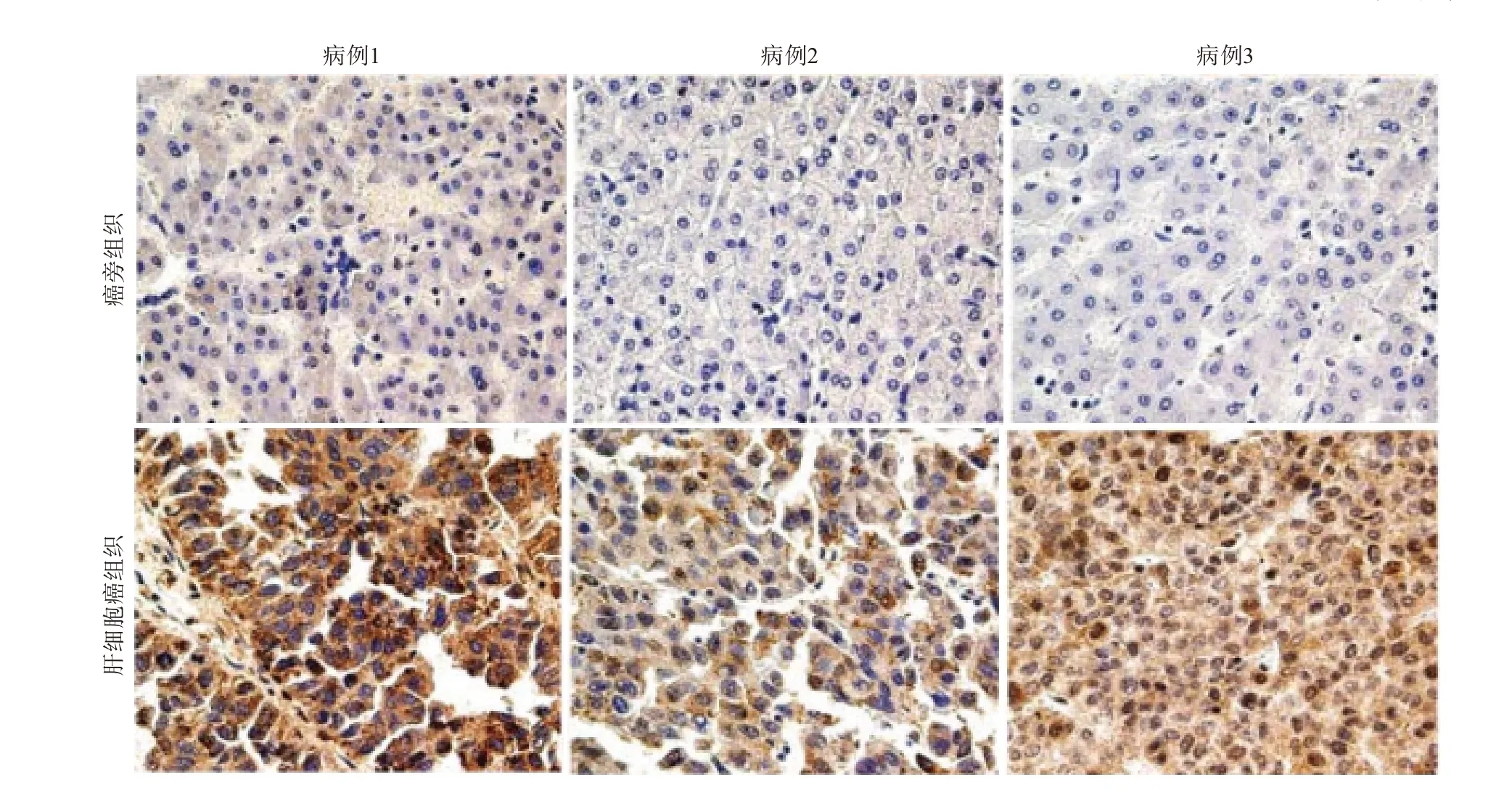
图1 细胞分裂周期基因 20(CDC20)在3例肝细胞癌组织中的表达情况(免疫组织化学×200)
2.4CDC20表达与病人临床病理特征的关系CDC20的表达与病人的肿瘤长径、被膜侵犯、脉管侵犯、肿瘤多发、分化程度和TNM分期有关(P<0.05),见表1。

表1 细胞分裂周期基因20(CDC20)表达水平与肝细胞癌病人临床病理特征的关系/例(%)
2.5CDC20表达对病人术后生存率的影响CDC20高水平组总生存率为(61.7%)和疾病无进展生存率(50.0%)均低于CDC20低水平组(87.2%、69.8%)(log-rankχ2=14.19,P<0.001;log-rankχ2=9.61,P=0.005)。
3 讨论
肝细胞癌是常见的恶性肿瘤,在过去的20年中,观察到与肝细胞癌相关的年死亡率显著增加[13-14]。此外,根据美国国立癌症研究所“监测、流行病学和结果数据库”SEER注册机构项目研究,到2030年肝细胞癌的发病率将继续上升[15]。准确估计预后,在肝细胞癌治疗中起着至关重要的作用。寻找预测肝细胞癌预后的生物标志物具有重要的临床价值。许多CDC20底物都参与有丝分裂过程,包括细胞周期蛋白B1、细胞周期蛋白A、分离酶抑制蛋白(Securin)、双能蛋白(Geminin)和周期素依赖激酶抑制剂p21(P21)[16]。最近,越来越多的研究显示CDC20在人类癌症中起致癌作用,在多种人类肿瘤中观察到CDC20的过度表达,与生存率降低有关[17]。
CDC20在结直肠癌、乳腺癌、前列腺癌和胃癌中的表达均增加[9-12],在该研究中,肝细胞癌组织中CDC20 mRNA和蛋白质水平均高于癌旁组织,提示CDC20促进肝细胞癌的发生发展。目前多项研究显示,CDC20高水平参与多种肿瘤的进展,例如Kim等[12]研究显示,CDC20在肠化生、低度不典型增生、高度不典型增生和早期胃癌中的表达明显高于正常黏膜,且在高度不典型增生中的表达水平最高,且CDC20过表达与胃癌病人的年龄、肠道组织学、较低的肿瘤-淋巴结-转移阶段以及较长的无复发生存期和癌症特异性生存期相关。CDC20与前列腺癌的恶性进展相关,CDC20高水平病人更具侵略性的临床病理特征和不良预后[11]。Li等[18]证明了膀胱尿路上皮癌病例中CDC20升高,而CDC20高水平与病人的无复发生存期较短和总体生存期较差相关。该研究中,CDC20在肝细胞癌中的表达水平与肿瘤长径、被膜侵犯、脉管侵犯、肿瘤多发、分化程度和TNM分期有关,说明在肿瘤长径、被膜侵犯、脉管侵犯、肿瘤多发分化程度低和TNM晚期的病人中CDC20的表达水平更高。提示CDC20可能与肝细胞癌的增殖与侵袭有关,CDC20高水平的肝细胞癌病人具有较强的增殖活性和更强的侵袭能力,与肝细胞癌的发展密切相关。在该研究中,CDC20高水平病人的术后3年总生存率和疾病无进展生存率均较低,提示CDC20有可能成为评价肝细胞癌预后的有效标志物。CDC20促进肝细胞癌的进展,其失活可能对治疗肝细胞癌有一定疗效。目前已发现几种CDC20抑制剂,例如类毒素-抗毒素混合物酯酶、pro-TAME和2-[苄基-(2-硝基-苯磺酰基)-氨基]-N-羟基-3-甲基-N-丙基-丁酰胺[19-20]。对CDC20抑制剂的研究可能有助于阐明CDC20在人类癌症中的作用机制,这也是后期该研究的方向之一。
综上所述,CDC20在肝细胞癌中的表达水平增加,可能参与肿瘤的增殖和侵袭。CDC20高水平预示病人的预后不良,有望成为判断肝细胞癌预后的肿瘤标志物。

