肥胖2型糖尿病导致小鼠睾丸生精功能障碍的研究
苏亚珊,王强强,王春红,李 健,孙亚群,李广永,吴 际,何 瑞
(1.宁夏医科大学基础医学院,生育力保持教育部重点实验室,银川 750004;2.宁夏医科大学总医院,银川 750004)
不孕不育是21世纪仅次于肿瘤和心血管疾病的第3位疾病,在全球范围内,有10%~15%的育龄期夫妇受不孕不育困扰,其中男性因素约占50%[1]。男性不育发生的主要机制是精子发生障碍。精子发生障碍在临床上主要表现为无精子症、少精子症、畸形精子症和(或)弱精子症。少弱精症是指精子数量减少,活力降低,精子形态和功能异常,除先天遗传因素外,吸烟、饮酒、肥胖症、代谢性疾病、心理压力、环境或职业暴露等外在原因都是造成男性不育的潜在危险因素[2]。据报道[3],90%以上的糖尿病患者伴随生殖功能紊乱,体质量指数(BMI)增加与精液质量、浓度以及运动性的下降相关。且母亲受孕时父亲的健康可以通过表观遗传修饰的跨代传播来影响后代的代谢健康和生殖潜力[4]。因此,肥胖及肥胖2型糖尿病对男性生殖功能有重要影响,不仅会导致男性生育能力降低,也会损害子代的健康,但其机制尚不明确。本文通过高脂饮食诱导C57BL/6J小鼠,探寻肥胖2型糖尿病引起的小鼠睾丸生精功能损伤及其机制。
1 材料与方法
1.1 仪器与试剂
电泳仪、免疫印记实验转膜仪(韦克斯(北京)有限公司)、Multiskan GO全波长酶标仪(美国Thermo Fisher公司)、凝胶成像系仪(美国Bio-Rad公司)、超净工作台(苏州安泰空气技术有限公司)、荧光倒置显微镜(德国Bresser公司)、高速台式离心机(上海力申科学仪器有限公司)、高脂饲料(45%fat,D12451;美国Research Diets公司)、普通饲料、BCA蛋白定量试剂盒(江苏凯基生物技术股份有限公司)、化学发光检测试剂盒(苏州宇恒生物科技有限公司)。
1.2 实验动物
16只4周龄15~20 g的SPF级雄性C57BL/6J小鼠,购自宁夏医科大学实验动物中心。小鼠饲养在宁夏医科大学SPF级屏障环境中的实验动物设施IVC系统,自然光源,湿度30%~40%,温度(25±2)℃,噪声水平保持在85 dB以下,所有小鼠自由饮水,自由饮食。所有涉及的动物实验及程序均获得宁夏医科大学医学伦理委员会批准(No.10752309202100057),所有操作均根据国家研究委员会的实验室动物护理和使用指南进行。
适应性喂养1周后,16只C57BL/6J小鼠按照体质量梯度抽样法分为对照组(n=8)和实验组(n=8):对照组小鼠喂养标准饮食16周,实验组小鼠饲喂高脂饮食16周。造模开始前,测量所有小鼠的初始体质量和空腹血糖,造模完成后再次测量,以确认造模成功。
1.3 实验方法
1.3.1 样本处理 饮食诱导期间,每3 d记录两组小鼠的体质量和摄食量。不同饮食诱导16周后,所有小鼠均进行口服葡萄糖耐量试验(OGTT)和胰岛素耐量试验(ITT),并对其曲线下面积进行比较。造模结束后,两组小鼠均在麻醉后进行心脏采血,3 500 r·min-1,离心15 min后,取上清于-80℃保存。用手术剪剪开小鼠腹部,充分暴露双侧睾丸,除去周围的脂肪组织及结缔组织,取出睾丸、附睾以及精囊腺,吸干表面的血液后用电子天平准确称取重量,并计算其脏器系数。将左侧睾丸放置于-80℃低温保存进行蛋白水平检测,右侧睾丸用4%多聚甲醛固定后进行组织学检查。
1.3.2 精子参数检测 右侧小鼠附睾尾切碎,摇匀,水浴5 min,使精子游离出来,用200目细胞筛过滤附睾组织,获得精子悬液。取20μL精子悬液滴在血细胞计数板上,在400倍光镜下计数精子数量,计算单位重量附睾尾精子数。根据附睾的重量,进一步计算附睾的平均精子数。采用半定量方法评价精子活力,每个样本取20μL精子悬液。在400倍光镜下观察约200个精子的游动状态,计算精子活力的比例。在精子悬液中加入适量的Diff-Quick溶液,高倍镜下观察精子形态,记录畸形精子数并计算畸形率。精子畸形大致可分为卷曲、大头、双头、双尾、无钩、香蕉等形。有头无尾、轮廓不清、重叠和明显被剪碎的精子不计。精子畸形率(%)=畸形的精子数/检查的精子数×100%。将大约20μL的伊红-苯胺黑染液(1.67%尹红,10%苯胺黑)和等体积的精子上清悬液混合,在室温下孵育2 min,死精子被染成粉色,活精子不能着色,在400倍光镜下观察大约200个精子并计算精子活率。精子活率(%)=活精子数/总精子数×100%。
根据第四版《世界卫生组织人类精液检查与处理实验室手册》提供的正常精液参考值评定,少精子症:一次射精的活精子浓度<1×106/mL;少弱畸精子症:精子浓度<20×106/mL,同时a+b级运动精子<20%和/或精子形态异常率>85%;弱畸精子症:精子浓度>20×106/mL,正常形态精子<10%,同时a+b级运动精子<50%。
1.3.3 Western blot实验 取小鼠睾丸组织100 mg,液氮研磨后加入RIPA裂解液+1%蛋白酶抑制剂+1%磷酸酶抑制剂,冷冻研磨机研磨5 min后,4℃、12 000 r·min-1,离心10 min,取上清;按照凯基生物BCA蛋白质浓度测定试剂盒说明进行蛋白定量。用PAGE凝胶快速制备试剂盒制备聚丙烯酰胺凝胶,并进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE),将蛋白转移到聚偏二氟乙烯(PVDF)膜上,室温下在脱脂奶粉中封闭1 h,用TBST洗膜,洗膜3次,每次10 min。将膜放在一抗稀释液中,加入一抗,在4℃冰箱孵育过夜。次日复温30 min后用TBST洗膜3次,每次10 min。将洗好的膜放入稀释好的二抗中,室温孵育1 h,用TBST洗膜3次,每次10 min。用碧云天ECL发光试剂盒显影,用化学发光成像仪曝光显像,用Image J软件工具进行灰度值分析,以β-actin(表1)为内参蛋白,计算目的蛋白与β-actin的比值,可反映表达水平的变化。

表1 抗体名称、种属、来源、稀释比例
1.4 统计学方法
采用Prism 7.0(美国GraphPad公司)统计学软件进行数据分析。计量资料以均数±标准差(±s)表示,两组比较采用t检验。P≤0.05为差异有统计学意义。
2 结果
2.1 高脂饮食对小鼠体质量、血糖的影响
造模开始前,两组小鼠体质量差异无统计学意义(P>0.05),给予不同饮食诱导16周后,实验组小鼠体质量重于对照组(P<0.01);口服葡萄糖耐量(OGTT)结果显示,实验组小鼠血糖值在给糖后第15、30、60、120 min均高于对照组(P均<0.05),实验组小鼠OGTT曲线下面积(AUC)大于对照组(P<0.01);胰岛素耐量试验(ITT)结果显示,实验组小鼠血糖值在腹腔注射胰岛素后第15、30、60、120 min的血糖值均高于对照组(P均<0.05),ITT的AUC均大于对照组(P均<0.01),见图1。
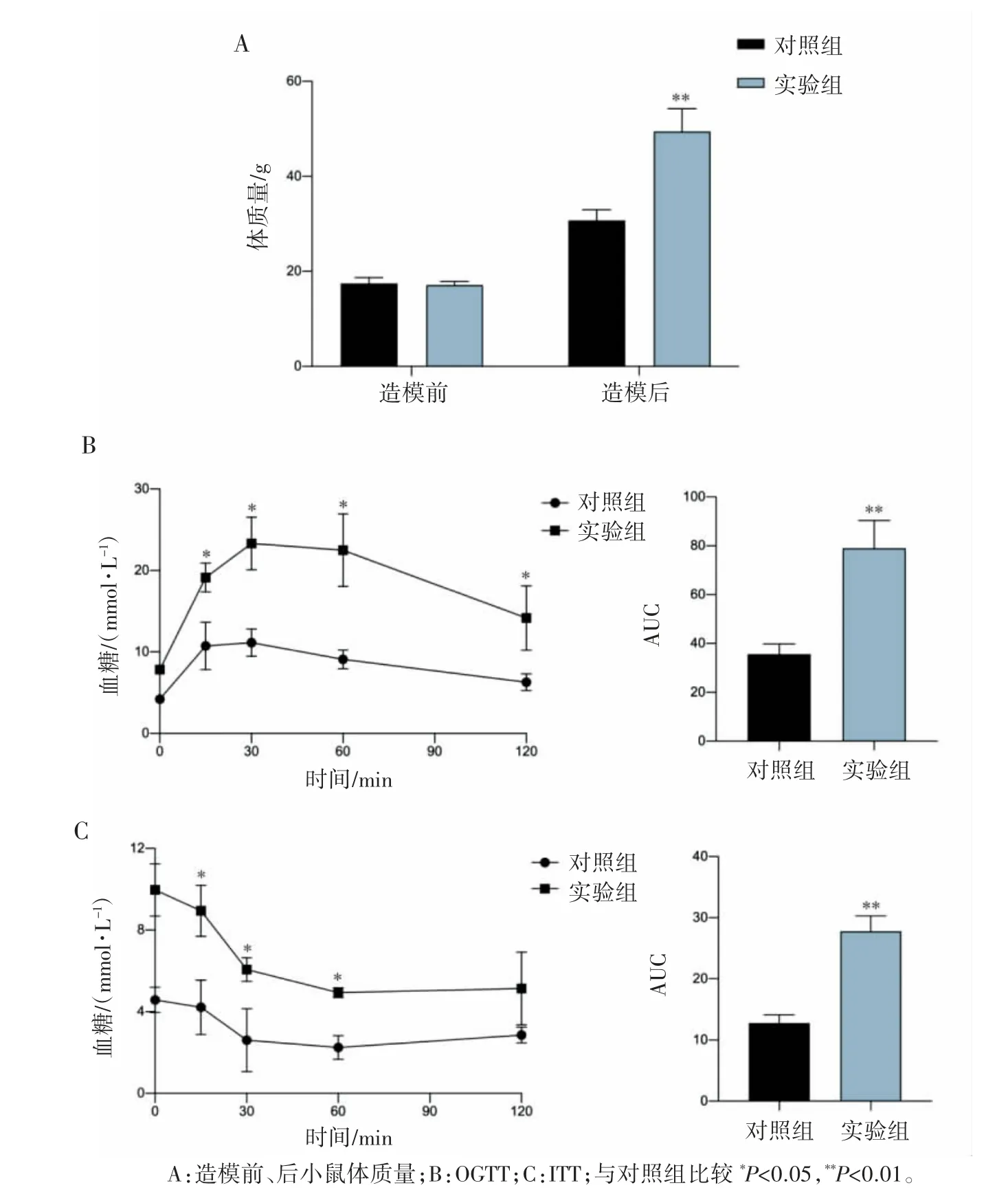
图1 不同饮食诱导小鼠体质量和血糖的变化
2.2 高脂饮食对小鼠生殖器官质量及脏器系数的影响
用不同饮食喂养16周后,实验组小鼠生殖器官睾丸、附睾、精囊腺的质量均低于对照组小鼠,实验组小鼠睾丸系数、附睾系数和精囊腺系数均低于对照组小鼠(P均<0.05),见表2。
表2 不同饮食诱导小鼠生殖器官质量与系数的变化(±s)

表2 不同饮食诱导小鼠生殖器官质量与系数的变化(±s)
与对照组比较*P<0.05,**P<0.01。
分组对照组实验组n 8 8器官质量/mg 器官系数睾丸 附睾 精囊腺 睾丸 附睾 精囊腺216.82±89.24 93.23±13.27 239.60±84.49 0.74±0.03 0.32±0.03 0.82±0.07 189.59±13.28** 82.51±8.05** 219.43±42.45** 0.46±0.04** 0.20±0.03** 0.54±0.08*
2.3 高脂饮食对小鼠精子参数的影响
用不同饮食诱导16周后,实验组小鼠精子数量减少、精子活力降低(P均<0.01),根据diff quik快速染色法,在高倍镜下观察精子形态,记录卷曲、大头、双头、双尾、无钩、香蕉形等畸形精子,实验组畸形精子增加(P均<0.05),见图2。

图2 不同饮食诱导小鼠精子参数的变化
2.4 高脂饮食对小鼠睾丸生精小管病变的影响
对照组小鼠睾丸生精小管之间连接紧密,排列整齐。精原细胞、精母细胞、精子细胞以及精子均处于不同发育阶段,呈放射状排列,有5~8层,腔内有致密的精子,间质细胞排列整齐紧密;实验组小鼠生精小管明显皱缩,生精上皮细胞数量逐渐减少,排列紊乱,层次不清,生精细胞数量明显减少,曲细小管间质组织部分甚至全部缺失,间质细胞数量明显减少。精子数量明显减少,见图3。

图3 不同饮食诱导小鼠睾丸形态学的变化
2.5 高脂饮食引起了睾丸组织的过度自噬
与对照组相比,实验组小鼠睾丸组织中LC3Ⅱ/Ⅰ和Beclin-1蛋白表达均增加(P均<0.05),见图4。

图4 不同饮食诱导小鼠自噬的变化
3 讨论
高脂饮食与许多疾病的发生、发展相关,如糖尿病、高血压、脂肪肝等[5]。据世界卫生组织(WHO)统计,目前全球糖尿病患者超过1.5亿,我国糖尿病患者数量居世界第2位,已超过4 000万[6]。肥胖2型糖尿病是目前全球发病率最多也是最容易被忽视的公共卫生问题之一[7]。
生殖系统损伤在肥胖糖尿病患者中发病率高达90%,是非糖尿病人群发病率的3倍以上,严重影响了患者的健康和寿命以及育龄夫妇的生育[8]。睾丸是糖尿病患者长期高血糖状态下最敏感的器官之一,糖尿病患者长期处于高血糖环境,睾丸结构及生精功能受到损害,从而导致少弱精子症的发生,甚至造成不育。
本课题组通过对雄性C57BL/6J小鼠进行高脂饮食诱导,探讨肥胖2型糖尿病对睾丸生殖功能的损伤机制。C57BL/6J小鼠经16周高脂饮食,造成体质量增加和血糖异常,是代谢研究领域公认且成熟的肥胖型2型糖尿病模型[9-10]。基于此模型,本研究验证高脂饮食在诱导肥胖2型糖尿病的同时,可造成雄性睾丸功能障碍,精子发生异常。高脂饮食16周后,实验组小鼠体质量增加,葡萄糖耐量异常,ITT显示胰岛素敏感性降低,提示实验组小鼠为肥胖伴有2型糖尿病。在此基础上,本课题组检测了小鼠精子参数,发现精子数量减少、活力降低,且出现少弱精症。进一步进行睾丸形态学检测,发现小鼠睾丸形态异常,生精细胞损伤。
睾丸是保证精子发生的场所,是精子发生的组织学基础,睾丸一旦受损,就会导致精子产生相应的功能改变[11]。超重或肥胖男性与BMI正常男性相比,精子活力和顶体反应下降,同时精子DNA损伤指数增高,形成的胚胎碎片率高,质量下降[12]。
Western blot结果显示,自噬相关蛋白在高脂饮食组小鼠中的表达增加。自噬是一种分解代谢过程,起到了生存机制的双重作用,适当自噬可减少高脂饮食对睾丸造成的损伤,过度自噬会导致睾丸组织不可逆的损伤,引起生精细胞功能障碍。因此,高脂饮食导致的睾丸生精功能障碍,可能是因为高脂饮食诱导睾丸组织的过度自噬,从而引起生精细胞的过度自噬,造成生精功能紊乱。
综上,高脂饮食诱导小鼠肥胖伴2型糖尿病,可导致睾丸精子发生障碍,其机制可能是高脂饮食诱发了睾丸组织的过度自噬,从而引起睾丸生精细胞数量及功能异常。

