过表达LncRNA IFNG-AS1急性淋巴细胞白血病细胞株的定量蛋白质组学分析
吴 珊,蒋 丹,徐广贤
(1.宁夏医科大学临床医学院,银川 750004;2.广东医科大学医学技术学院医学检验系,东莞 523000)
急性淋巴细胞白血病(ALL)起源于淋巴祖细胞在骨髓、血液和髓外部位的恶性转化和异常增殖,5年的总存活率为45%~90%。ALL的发病率呈双峰分布,第一个高峰发生在儿童时期,第二个高峰发生在50岁左右[1]。尽管诱导化疗的反应率很高,但只有30%~40%的成年ALL患者能实现缓解。长链非编码RNA(LncRNA)IFNG-AS1,又称TMEVPG1或NeST,最初发现是由于小鼠对Theiler病毒反应差异[2]。研究[3]表明,IFNG-AS1调控IFN-γ表达,以及调控Theiler病毒和沙门氏菌的应答。同时,IFNG-AS1在免疫性疾病和肿瘤中高表达,如垂体腺瘤、炎症性肠病、类风湿关节炎、乳腺癌和宫颈癌等。然而,关于IFNG-AS1在ALL中的机制作用研究较少。本研究通过构建IFNG-AS1过表达细胞系,以验证IFNG-AS1过表达的体外效果,以期为ALL发病机制中涉及的靶点提供新的思路。
1 材料与方法
1.1 材料与试剂
急性淋巴细胞白血病jurkat T细胞株源于本实验室保存。RPMI 1640培养基(01-100-1A)和胎牛血清FBS(04-001-1A)购于美国Biological Industries公司;TMT Mass Tagging Kits(90064B)、RevertAid First Strand cDNA Synthesis Kit(K1622)和SYBR Green qPCR Supermix(11733046)均购于美国Thermo Fisher Scientific公司;碘乙酰胺(IAA,144-48-9)、二硫苏糖醇(DTT,16096-97-2)、尿素(57-13-6)、乙二胺四乙酸(EDTA,60-00-4)和硼氢化四乙基铵(TEAB,17083-85-1)均购于美国Sigma公司;可表达绿色荧光蛋白(green fluorescent protein,GFP)的慢病毒购于北京合生基因公司。
1.2 细胞系、细胞培养和慢病毒侵染
将jurkat T细胞株置入含5%胎牛血清和1%青霉素/链霉素1640培养基中培养细胞(37℃,5%CO2)。慢病毒侵染jurkat细胞后通过实时荧光定量PCR(qRT-PCR)验证病毒侵染效率。
1.3 qRT-PCR检测
从IFNG-AS1过表达慢病毒侵染的jurkat细胞中使用TRIzol试剂提取总RNA。RevertAid First Strand cDNA Synthesis Kit合成cDNA第一链。SYBR Green qPCR Supermix进行qRT-PCR。使用2-ΔΔCT模式对所有数据进行量化。GAPDH作为内参,所有实验均重复3次。
1.4 蛋白质提取、胰蛋白酶消化和TMT标记
用高强度超声粉碎仪在冰上(8 mol·L-1尿素,1%蛋白酶抑制剂,2 mmol·L-1EDTA)对jurkat细胞进行3次超声粉碎(每次4~6 s)。取剩余细胞碎片,4℃12 000×g离心10 min后收集上清,根据BCA试剂盒说明书测定蛋白浓度。消化时,用5 mmol·L-1DTT 56℃,30 min还原蛋白溶液,接着通过11 mmol·L-1IAA室温暗室孵育15 min。稀释蛋白质样品直至尿素浓度低于2 mol·L-1。胰蛋白酶37℃消化过夜,Strata X C18 SPE柱去除多肽后进行真空干燥。
1.5 高效液相色谱(HPLC)分离
采用反相高效液相色谱柱(Agilent 300 Extend C18)(5μm颗粒,4.6 mm内长,250 mm全长)分离胰蛋白酶肽。首先用8%~32%的乙腈(pH 9.0)梯度在60 min内将多肽分成60个馏分。而后组合多肽成9个馏分,真空离心干燥。
1.6 液相色谱-质谱(LC-MS/MS)分析
多肽溶解在(0.1%甲酸和2%乙腈)溶剂A中,使用EASY-nLC 1000系统进行分离。(0.1%甲酸和90%乙腈)溶剂B液相梯度设置为:0~30 min:8%~16%B;30~55 min:16%~30%B;55~57 min:30%~80%B;57~60 min:80%B,流速恒定为400 nL·min-1。使用超高效液相色谱(UPLC)分离肽段,并置于纳米电喷雾离子源(NSI),然后在Orbitrap Fusion Lumos系统(Thermo Fisher Scientific,美国)进行质谱分析(MS)。电喷雾电压为2.0 kV,利用高分辨率的Orbitrap检测并分析肽前体离子和次级片段。对于分辨率为60 000的MS扫描,m/z扫描范围为350~1 550,MS/MS扫描范围固定起始点100 m/z,分辨率为15 000。
1.7 质谱数据处理
MS/MS数据使用Maxquant搜索引擎进行处理。蛋白质组分析,串联质谱在SwissProt Human数据库(包含20 317条序列)中搜索。通过增加常见污染物数据库消除蛋白质污染对鉴定结果的影响。胰酶/P被指定为一种切割酶,最多允许有2个缺失切割。第一次搜索中前驱体离子的质量容差为20 ppm,主搜索中是5 ppm,片段离子质量容差是0.02 Da。Cys的烷基化修饰选择固定修饰,Met的氧化和N端乙酰化修饰选择可变修饰。定量方法设置为TMT-6plex,用于蛋白质鉴定的误检率(FDR)和肽谱匹配(PSM)的阈值均低于1%。
1.8 生物信息学分析
通过UniProt-GOA数据库对蛋白质组进行基因本体论(GO)注释,采用InterProScan软件将所有未被该数据库标注的蛋白质进行序列比对GO注释。GO注释将蛋白质分为生物过程、细胞成分和分子功能三大类。运用WoLF PSORT软件预测亚细胞定位,KEGG数据库进行蛋白质通路注释。鉴定蛋白的功能富集分析应用Perl module进行Fisher精确检验。P≤0.05为差异有统计学意义。
2 结果
2.1 鉴定jurkat T细胞中IFNG-AS1的表达
提取过表达IFNG-AS1的jurkat细胞总RNA,验证慢病毒侵染效率。荧光倒置显微镜结果显示,镜下观察到大量绿色荧光斑点,说明IFNG-AS1慢病毒侵染效率较高。qRT-PCR结果显示,过表达IFNG-AS1组的jurkat细胞组表达量较空载体组增加约395倍(P<0.001)。说明IFNGAS1过表达成功,且效率较高(图1)。
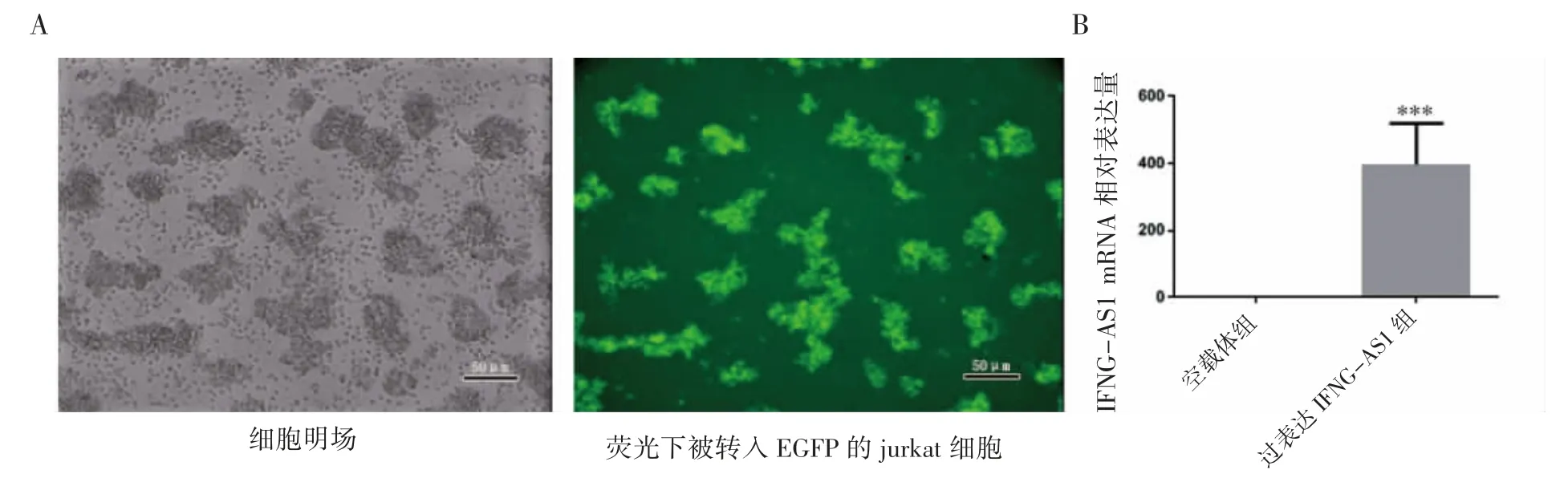
图1 过表达LncRNA IFNG-AS1的jurkat细胞系
2.2 过表达IFNG-AS1对jurkat细胞蛋白质组学的影响
利用LC-MS/MS分析jurkat细胞中IFNGAS1过表达后蛋白质表达的变化,共鉴定出429个差异表达蛋白(DEPs),其中188个下调,241个上调。共获得402 574个二级光谱,鉴定出6 984个蛋白质。质谱分析鉴定了50 099个肽,包括47 898个特异性肽(图2A)。本结果鉴定的相对分子质量为10~100 kDa的蛋白质数量最多(图2B)。肽段大部分分布在7~20个氨基酸,符合碎裂方式基于trypsin酶解和HCD的一般规律(图2C),具有两个以上的肽段(图2D)。绝大多数谱图符合轨道阱质谱的高精度特性,一级质量误差在10 ppm以内(图2E)。在样本的蛋白定量主成分分析(PCA)结果中,重复样本之间的聚集程度越好代表重复性越好。各重复样本间蛋白质定量值相对标准差(RSD)箱线图中,整体RSD值越小,定量重复性越好。结果显示过表达IFNG-AS1的jurkat细胞组和空载体组的RSD<0.2,即两组蛋白定量重复性较好(图3)。
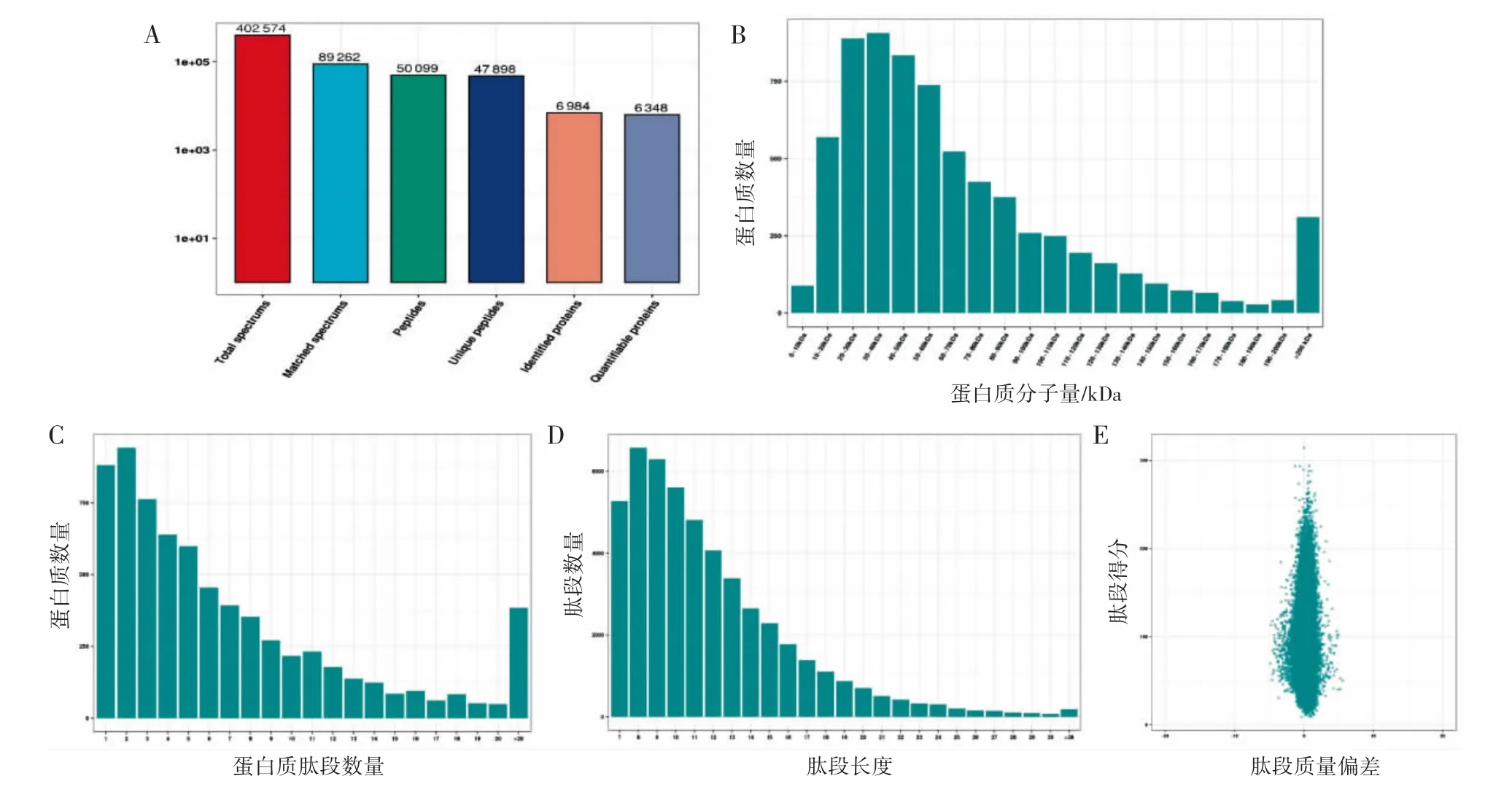
图2 IFNG-AS1过表达jurkat细胞表达改变的蛋白
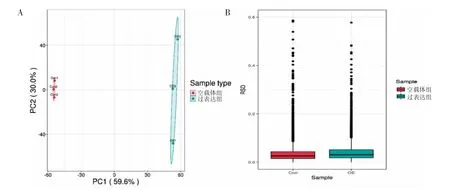
图3 重复实验样本一致性检验
2.3 定量蛋白质组学对过表达LncRNA IFNGAS1的jurkat细胞的差异蛋白筛选
通过定量蛋白质组学对LncRNA IFNG-AS1改变的jurkat细胞中的DEPs进行分析,细胞中有141个蛋白表达发生了显著变化(至少增加1.5倍或减少0.67倍,P<0.05),其中91个蛋白表达上调,50个蛋白表达下调(图4)。
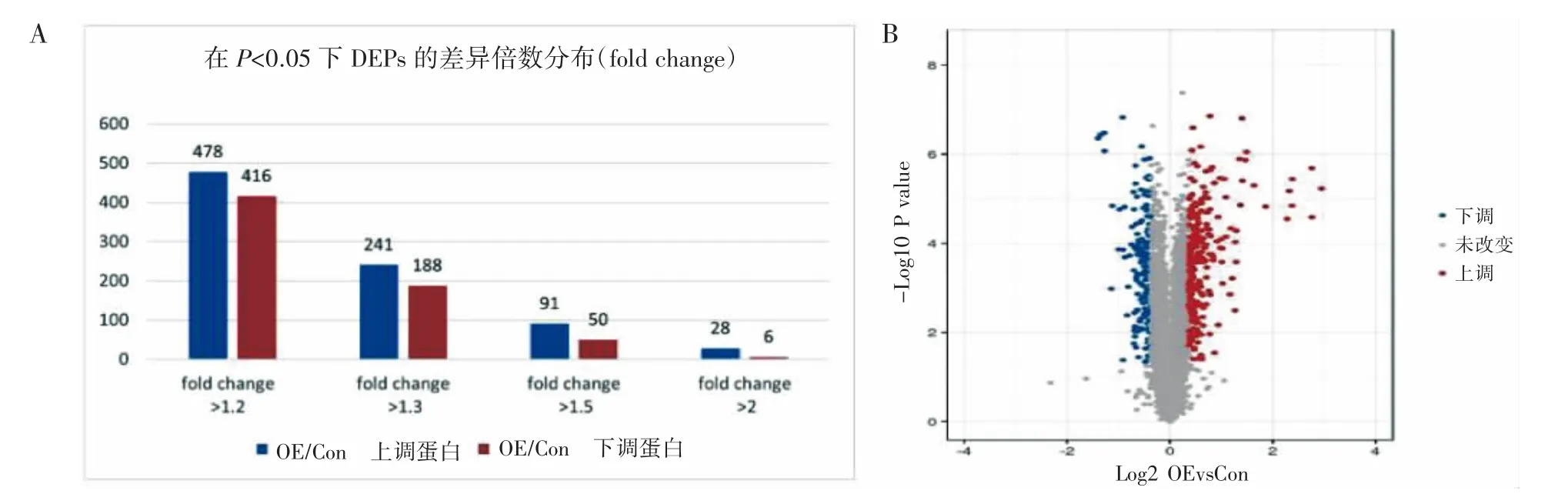
图4 jurkat细胞中IFNG-AS1调控蛋白的定量蛋白质组学鉴定
2.4 DEPs的功能分类与注释
通过亚细胞定位分析、同源群/真核同源群(COG/KOG)功能分类和GO分析来评价这141个DEPs的生物学功能。亚细胞定位分析显示,DEPs广泛分布于细胞核、细胞质、胞外间隙和细胞质膜(图5A)。COG/KOG分类表明,前5种功能分别为信号转导机制、转录、细胞骨架、翻译后修饰、脂质转运和代谢(图5B)。GO分析注释将这141个蛋白质分为3类,即生物过程、细胞成分和分子功能(图5C)。

图5 过表达IFNG-AS1的jurkat细胞DEPs的亚细胞定位、COG/KOG、GO分析的分类和注释
2.5 过表达IFNG-AS1的jurkat细胞中相互作用蛋白的功能富集分析
利用GO富集的聚类分析方法,比较过表达IFNG-AS1的细胞中差异蛋白功能的相关性。生物过程分析结果表明,上调的蛋白与细胞表面受体信号通路和中性粒细胞免疫调节有关,下调的蛋白与细胞分裂、脂质生物合成有关(图6A、图6B)。细胞成分分析结果表明,上调的蛋白与细胞质膜和分泌颗粒相关,下调的蛋白与染色体相关(图6C、图6D)。分子功能结果显示,上调的蛋白与肌动蛋白结合有关,下调的蛋白与DNA作用有关(图6E、图6F)。此外,KEGG通路分析表明,这141个DEPs在一些基本的生物通路中发挥作用,包括PPAR信号通路、T细胞受体信号通路和PI3K/Akt信号通路(图7)。
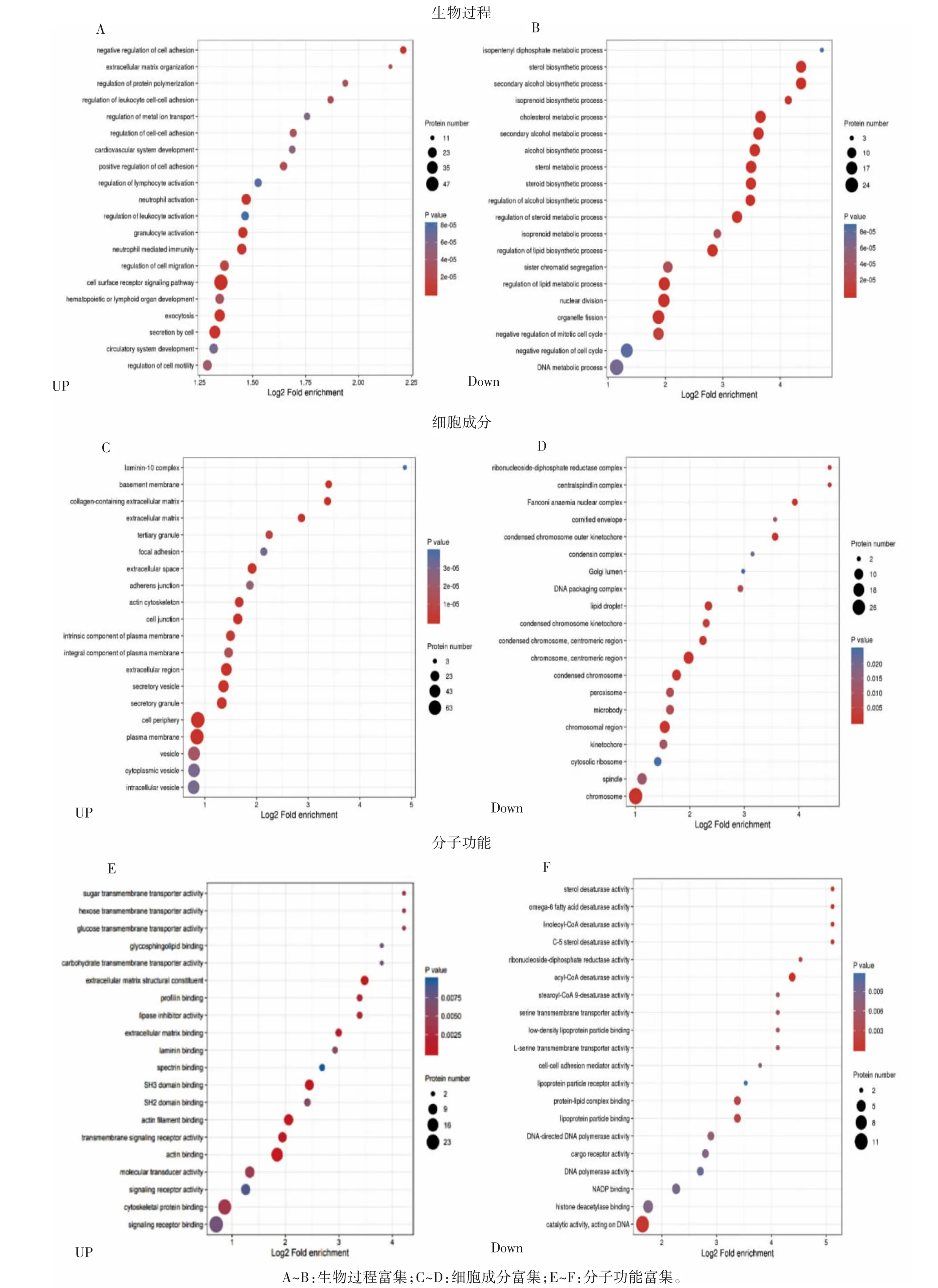
图6 jurkat细胞过表达LncRNA IFNG-AS1后DEPs的GO富集分析
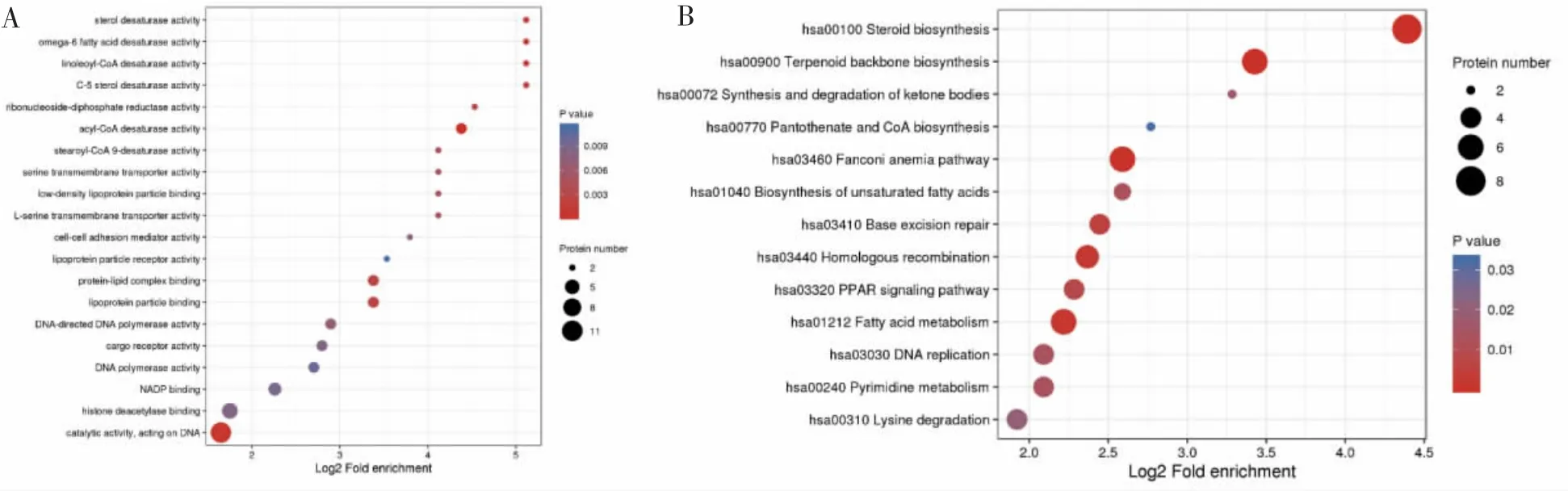
图7 jurkat细胞过表达LncRNA IFNG-AS1后DEPs的KEGG富集分析
2.6 qRT-PCR验证过表达LncRNA IFNG-AS1的jurkat细胞中差异蛋白表达
为验证基因水平的变化是否与蛋白质水平一致,对所选的蛋白质进行qRT-PCR验证。选择LIM结构域蛋白2(LIMD2)、纤维鞘相互作用蛋白2(FSIP2)、肌糖原磷酸化酶(PYGM)、管蛋白-酪氨酸连接酶样蛋白1(TTLL1)、姐妹染色单体内聚蛋白2(ESCO2)、DNA甲基化转移酶3B(DNMT3B)、内质网钙ATP酶1(ATP2A1)进行qRT-PCR验证,结果显示LIMD2、FSIP2、PYGM、TTLL1、ESCO2、DNMT3B、ATP2A1的相对基因表达水平与蛋白表达水平一致(图8)。
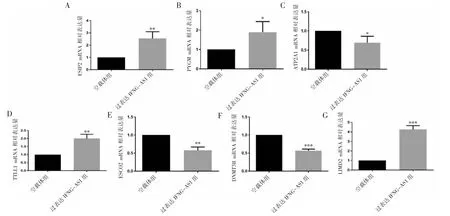
图8 qRT-PCR验证过表达LncRNA IFNG-AS1的jurkat细胞中差异蛋白变化
3 讨论
研究[4]表明,LncRNA IFNG-AS1在人类免疫性疾病和肿瘤的发生发展中发挥重要作用。本研究利用定量蛋白质组学、生物化学分析和生物信息学分析,系统地描述了LncRNA IFNG-AS1过表达对jurkat细胞的整体蛋白质组谱的影响,以此筛选LncRNA的潜在调控靶点。实验结果表明,共141个蛋白在IFNG-AS1过表达jurkat细胞中差异表达。生物信息学分析表明,许多DEPs在生物过程、细胞成分、分子功能、亚细胞定位和信号通路中发挥作用。GO和KEGG通路富集分析表明,本实验所鉴定的DEPs在几个基本的分子功能和生物调控通路中富集。亚细胞定位分析表明,DEPs主要分布在细胞质和细胞核中。GO分析表明,这些DEPs与细胞分裂和免疫调节相关,具有催化活性和离子结合功能。KEGG通路分析表明,DEPs参与了多种重要的信号通路(PPAR信号通路和PI3K/AKt信号通路)、代谢通路、DNA复制的调控。LncRNA IFNG-AS1通过激活这些信号通路,可以判断出LncRNA在jurkat细胞的几个重要病理反应中的作用,包括迁移、侵袭和增殖。此外,通过定量蛋白质组学数据的深度挖掘,以及qRT-PCR检测,最终确定了7个表达显著的差异蛋白。
ESCO2是一种姐妹染色单体内聚蛋白,通过与MCM复制解旋酶的相互作用促进内聚[5]。依据KEGG结果可得,ESCO2参与了mTOR信号通路的调节。现有研究[6]表明,ESCO2通过活化AMPKα抑制mTOR的激活,进而降低S6K1的磷酸化水平并抑制RPS6的激活,导致细胞生长能力减弱。差异蛋白PYGM与糖原代谢有关,已被证实在乳腺癌中下调,其表达与患者生存时间相关[7]。先前的研究表明糖原代谢可能在癌症进展中起着重要作用[8]。与正常组织相比,实体瘤中糖原含量较高,糖原的正确储存和管理可能与肿瘤细胞的生存有关[9-12],提示PYGM在肿瘤中可能具有调节作用。LIMD2是一种在转移性肿瘤中过度表达的小型LIM-only蛋白,通过直接结合和激活整合素连接激酶来调节细胞运动和肿瘤进展[13]。FSIP2可作为肾细胞癌透明细胞预后的预测生物标志[14]。ATP2A1表达在乳腺癌患者中高度改变[15]。TTLL1在细胞重组过程中在Glu381位点上对Klf4进行聚谷氨酰胺化,阻碍了其赖氨酸48连锁泛素化,维持了Klf4的稳定性,而Klf4聚谷氨酰基化在调节细胞重编程和多能性维持中发挥着关键作用[16]。DNMT3B作用于活性基因的主要酶甲基化内区,其招募受染色质修饰、转录水平、非编码RNA和存在的DNA结合因子机制调节。而DNMT3B表达的改变与肿瘤的发生有关[17]。此结果提示,IFNG-AS1可通过FSIP2、PYGM、TTLL1和LIMD2的表达增加,ATP2A1、ESCO2和DNMT3B表达降低,从而促进细胞增长、DNA重组和染色体修饰。本研究验证的7个DEPs与TMT标记定量结果高度一致,证实了蛋白质组学结果的可靠性。
综上,本实验通过定量蛋白质组学分析,在jurkat细胞中鉴定LncRNA IFNG-AS1的下游效应因子。结果表明LncRNA IFNG-AS1上调FSIP2、PYGM、TTLL1、LIMD2,下调ATP2A1、ESCO2、DNMT3B在促进ALL进展中发挥了关键作用,并提示了LncRNA IFNG-AS1上调反应的复杂性。本实验蛋白质组学结果为ALL的诊断和治疗提出了新的可能策略。

